高丹草种子半透特性的研究
孙秋瑾,吕燕燕,韩云华,王彦荣
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
种皮的通透性可控制种胚与外界环境间水分、气体和养分的交换,对种子的萌发、休眠和贮藏等具有重要的作用[1]。以往研究表明大多数植物种由于半透层的存在,胚包被物显示出特殊的通透性[2]。半透层(semipermeable layer)是指种胚包被物中存在的一层具有半透性的组织,它允许种子内外水分和气体的自由交换,而限制或阻止某些溶质的通透[3]。种皮一旦阻碍物质的渗漏,基于渗漏差异的种子质量测定方法将无法检测出不同活力种子之间的差异。
Thornton[4]在测定种子生活力时发现,由于半透层的存在,常用的四唑盐测定法并不适用于西瓜(Citrulluslanatus)种子的测定。Beresniewicz等[3]对蔬菜种子种皮透性的研究表明,完整番茄(Lycopersiconesculentum)和辣椒(Capsicumannuum)种子种胚四唑盐(TTC)染色率低,但刺破种皮后种胚四唑盐染色率和氨基酸渗漏量均显著增加,认为种子半透层的存在限制了种皮对四唑盐的吸收和氨基酸的渗漏,并且不同物种由于种子半透层的存在,种皮透性差异明显,可根据半透性差异将其分为高透性、中透性和低透性3种类型。在种子活力测定研究中,Hill等[5]的研究表明具有完整种皮的老化和未老化莴苣(Lactucasativa)种子的电解液测定值之间无显著差异,电导率法也不适用于甜瓜(Cucumismelo)[6]、辣椒[7]及大多数禾草如多年生黑麦草(Loliumperenne)[8]、雀麦(Bromusjaponicus)[9]和老芒麦(Elymussibiricus)[10]等种子活力水平的评价。2003年,王彦荣[11]研究发现苏丹草(Sorghumsudanense)种皮存在半透层,该组织具有阻碍种子内部电解质外渗和四唑盐渗入的作用,认为半透层的存在可能是引起电导率法不适用于一些禾草种子活力测定的主要原因。然而迄今为止,关于禾本科牧草高丹草种子半透特性的研究国内外尚未见报道。
高丹草(Sorghumbicolor×Sorghumsudanense)是高粱(Sorghumbicolor)与苏丹草种间杂交产生的杂种类型。具有分蘖能力强,抗逆性高,适口性好等优良特性,为综合农艺性状优良的一年生禾本科饲料作物[12]。本研究以3个高丹草品种冀草2号,冀草8号和冀草008号种子为材料,研究高丹草种子是否存在半透层以及品种间种皮半透性差异,探讨种子半透特性与种子活力测定的关系,为种子质量评价方法的应用提供重要的科学依据。
1 材料与方法
1.1 供试品种
供试高丹草品种为:冀草2号、冀草8号和冀草008号,由河北省农林科学院旱作农业研究所李源副研究员提供。供试品种收获于2015年,均贮藏于室温条件下,初始质量详见表1。试验于2016年7月至2017年1月在兰州大学农业部牧草与草坪草种子质量监督检验测试中心(兰州)进行。
1.2 试验方法
1.2.1种子老化处理 采用12 cm×12 cm×6.5 cm种子老化盒,盒内加水250 mL,精确称重后将种子放入盒内支架上,种子距水面约2.5 cm,置于45 ℃,100%相对湿度(老化环境由预试验确定)培养箱老化。设置9个老化时间梯度,分别为24、36、48、60、72、84、96、108和120 h。严格按照老化后的相应时间梯度取出种样,室温摊晾使其恢复原重。获得不同质量的种子用于如下发芽率和电导率试验。以未老化种样为对照。
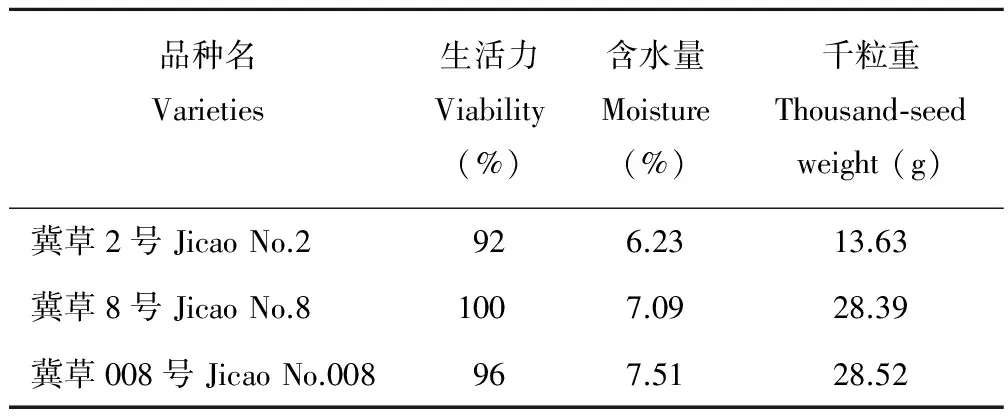
表1 供试种初始质量Table 1 Primary quality of testing seeds
1.2.2吸水率测定 参照王彦荣等[13]的方法测定种子吸水率。每品种数取50粒种子,3次重复,将种子放在三角瓶中,加入100 mL蒸馏水,置于20 ℃恒温条件下,用称重法测定种子在24 h内的吸水量。种子吸水率以种子吸水量占种子初始重量的百分比表示。
1.2.3发芽率测定 参照《牧草种子检验规程》(GB/T 2930.4-2001)[14]测定高丹草种子发芽率。选取均匀饱满一致的种子50粒,设4次重复。采用纸上发芽法,放置光照培养箱中,在20 ℃/30 ℃变温条件下培养。初次计数为第4天,末次计数为第10天,最终统计正常种苗数、不正常种苗数、新鲜未发芽种子数及死种子数。按以下公式计算种子发芽率:
发芽率=发芽终期全部正常种苗数/供试种子数×100%
1.2.4四唑盐染色率的测定 随机数取100粒种子,3次重复。将种子置于蒸馏水中30 ℃预浸泡3 h后取出。预湿后的种子参照《牧草种子检验规程》(GB/T 2930.5-2001)[15],用0.1%的氮红四唑溶液(TTC)在35 ℃黑暗条件下染色1 h,然后在立体解剖镜下进行观察鉴定,以胚完全染成红色的种子确定为具有生活力的种子。染色结果分为重度染色、轻度染色和未染色。对各种样用解剖针进行刺破种皮处理,测定刺破种皮种子四唑盐染色率,测定方法同完整种子。
1.2.5电导率测定 自未老化和老化84 h的种样中随机数取50粒种子,每种样3次重复,精确称重至0.01 g。将已知重量的种子倒入150 mL三角瓶内,加蒸馏水100 mL,充分摇荡,用保鲜膜封住瓶口,以仅盛100 mL蒸馏水的瓶子为对照。将各种样置于20 ℃培养箱,24 h后取出在20 ℃条件下用DDSJ-308A型电导率仪测定浸种液的电导率。根据ISTA活力测定方法[16],按下式计算各种样的电导率:

1.2.6荧光染色剂示踪及观察 参考Salanenka等[17]荧光染料处理种子的方法。随机数取40粒种子,用荧光染料干粉包埋种子,避免水分接触。处理过的种子置于湿沙中20 ℃恒温培养18~24 h,于胚根伸出前取出,用蒸馏水冲洗种子,滤纸吸干表面水分。将种子用双面刀片沿胚纵切,用荧光体式显微镜(Leica MZ16FA)在蓝光(495 nm)下进行观察并拍照,以未经荧光染料处理的种子为对照。荧光染色剂理化性质见表2。
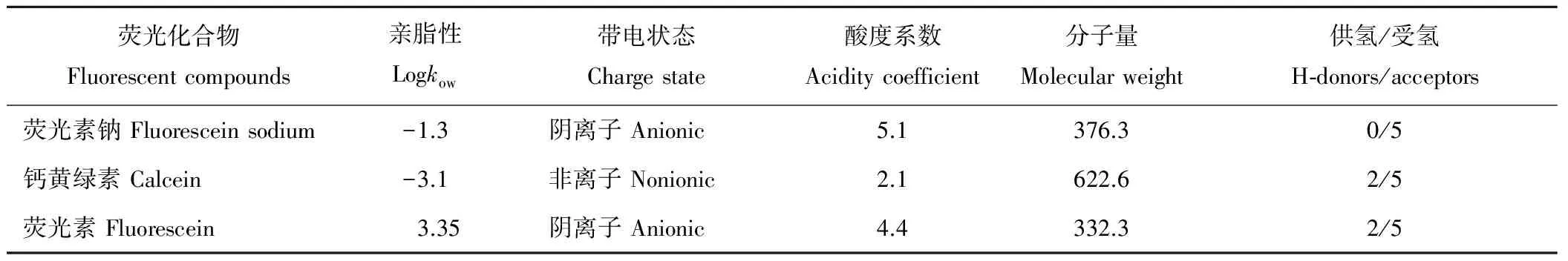
表2 荧光染色剂理化性质Table 2 Physicochemical properties of fluorescent tracers
1.2.7种子半透层X射线能量色散分析 参考Beresniewicz等[3]硝酸镧示踪和X射线能量色散分析的方法,随机数取50粒种子,去稃,浸泡于双蒸水中,20 ℃孵育24 h,去除表皮破裂的种子,将剩余种子于4%硝酸镧溶液(去除CO2的双蒸水配制)浸泡24 h,室温晾干。用双面刀片将种子沿胚纵切,用扫描电镜(JSM5600LV,日本JEOL)结合X射线能量色散分析仪(EDAX,美国KEVE2)进行镧元素微区定点分析。
1.2.8种皮透性与种子质量测定的关系 对各种样进行刺破种皮处理,依据1.2.5方法测定电导率值。
1.3 数据处理
用Microsoft Excel录入数据,并作图。采用SPSS 20.0统计分析软件进行单因素方差分析和相关性分析。
2 结果与分析
2.1 高丹草种子吸水率的变化
供试高丹草种子的吸水率均符合典型的吸水动态曲线(图1)。在0~6 h为种子吸胀阶段,之后在最初吸胀的基础上,进入吸水滞缓期,16~24 h种子吸水率逐渐平稳。24 h时种子吸水率达34.7%(冀草8号)至42.2%(冀草2号),说明高丹草种皮对水分的通透性良好。20~24 h种子胚根伸出,进一步说明高丹草种皮不影响水分和气体的交换。
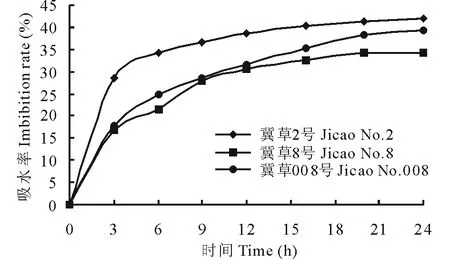
图1 高丹草种子吸水率的动态变化Fig.1 Dynamic changes of imbibition rate of seeds for Sorghum bicolor×Sorghum sudanense
2.2 高丹草种子对四唑盐的吸收
完整高丹草种子对四唑盐的通透性较差,种胚重度染色率冀草2号为5%,冀草8号为0%,冀草008号为2%,其余种子轻度染色或未染色(表3)。刺破种皮处理后3个品种的高丹草种子种胚四唑盐重度染色率均为100%,与完整种子差异显著(P<0.01)。

表3 高丹草种子四唑盐染色率Table 3 Percentage of seeds stained with TTC for Sorghum bicolor×Sorghum sudanense (%)
2.3 不同发芽率种子电导率的比较

图2 不同发芽率种子电导率比较Fig.2 Comparison of electrical conductivity (EC) of Sorghum bicolor×Sorghum sudanense under different germination rates
老化84 h后获得发芽率分别为23.0%(冀草2号),34.7%(冀草8号)和35.3%(冀草008号)的种子。结果显示,高发芽率种子(未老化)与低发芽率种子的电导率值无显著差异(P>0.05)(图2),如发芽率为92%(未老化)和23%(老化)的冀草2号种子电导率分别为11.93和11.70 μs·cm-1·g-1。表明高丹草种子浸泡液的电导率不随种子生活力或活力的下降而改变。
2.4 高丹草种子对荧光化合物的吸收
荧光素钠和钙黄绿素均能渗透供试3种高丹草种皮(表4)。荧光素(绿色荧光)能渗透冀草2号高丹草种皮,进入种子内部被种胚所吸收,并在种胚部位检测到明显的荧光信号;却被冀草8号和冀草008号高丹草种皮所阻挡,仅在种皮部位出现少量荧光(图3)。
2.5 高丹草种子半透层的X射线能量色散分析
对照种子内部主要含有C、O、K、Ca元素,无镧元素(图片未展示)。图4A,B和C为经硝酸镧处理后高丹草种子微区元素的面分布, 种子内部均含有La、C、O、K、Ca元素,其中C、O、K、Ca呈均匀分布。 图4a, b和c分别为图4A,B和C相对应部位镧元素的分布,由此(图4a,b和c)可见,镧元素(绿色)均呈条带状分布于高丹草种皮靠近胚乳处,未渗入到种子内部。证明高丹草种子存在阻挡镧盐渗入的半透层结构。
2.6 高丹草种子发芽率与电导率的相关性分析
完整高丹草种子发芽率与电导率相关性不显著(P>0.05)(图5),相关系数冀草2号为0.103,冀草8号为-0.398,冀草008号为-0.036。刺破种皮处理后,3个品种的高丹草种子发芽率(x)与电导率值(y)均呈极显著负相关(P<0.01),可用如下回归方程表示:

表4 高丹草种子对荧光化合物的吸收Table 4 Seed coat permeability of Sorghum bicolor×Sorghum sudanense to applied fluorescent compounds
冀草2号:y=-0.1897x+41.76(r=-0.976**)
冀草8号:y=-0.29x+52.961(r=-0.951**)
冀草008号:y=-0.2378x+107.52(r=-0.902**)

图3 高丹草种子对荧光素的吸收Fig.3 Uptake of fluorescein by seeds of Sorghum bicolor×Sorghum sudanense

图4 镧示踪下高丹草种子纵切面微区元素面分布Fig.4 Surface distribution of elements in micro-area under lanthanum tracer
3 讨论

图5 高丹草种子发芽率与电导率的相关性 Fig.5 Correlation between germination and electrical conductivity for Sorghum bicolor×Sorghum sudanense
本研究对高丹草种皮通透性的测定结果表明,高丹草种皮不阻碍水分的吸收(图1),未老化种子均能正常发芽表明种皮也不限制气体的通透,但具有阻碍四唑盐(表3)、部分荧光染色剂渗入(表4和图3)和内部电解质渗出(图2)的作用。通过硝酸镧示踪结合X射线能量色散分析证明高丹草种子种胚包被物中存在阻挡镧盐渗入的半透层(图4),该组织的存在解释了高丹草种皮显示特殊通透性的原因。以往对蔬菜种子和禾草种子的研究也表明,半透层具有限制氨基酸[18]等种子内含物渗出、四唑盐[3-4,11]和镧盐[3,19]等大分子物质渗入的作用。
本研究中,钙黄绿素和荧光素钠均能渗透3种高丹草种皮(表4),进入种子内部被种胚所吸收。荧光素能渗透冀草2号高丹草种皮,却被冀草8号和冀草008号高丹草种皮所阻挡(图3)。钙黄绿素能够渗透高丹草种皮,证明分子量不是限制物质通透的唯一因素,这和Salanenka等[20]对莴苣(Lactucasativa)种子的研究结果一致。荧光素不能渗透冀草8号和冀草008号高丹草种皮,这可能和荧光素相对较高的亲脂性有关,较高亲脂性的化合物具有有限的亲水性,在通过植物组织时会被脂质类物质所阻挡。这一结论似可揭示高丹草种子脂质化的半透层限制了荧光素的通透。以往主要基于对黄瓜(Cucumissativus)[17]、番茄和莴苣[20]等蔬菜种子以及少量牧草种子[21]种皮透性的研究也表明,存在半透层的种子对不同理化性质荧光化合物的渗透特性不同,其半透性差异可能与种皮结构、成分及化合物理化性质等有关。
种皮对电解质渗漏的限制使得基于渗漏差异的种子质量评价方法无法检测出不同活力种子之间的差异[6-8]。本研究中,完整高丹草种子随活力下降,电导率与发芽率不相关(图5),证明电导率法不适用于高丹草种子活力测定。以往学者对雀麦(Bromusjaponicus)[9]、新麦草(Psathyrostachysjuncea)[22]等禾本科牧草的研究也发现电导率与发芽率不相关的结果。一些学者认为可能由于禾草种子胚乳淀粉含量高[23],不溶性物质较多[24],有研究表明这可能与种子代谢强度[25]和内在物质浓度[26]有关而非膜透性变化所致,但也有研究者认为这可能与种皮透性[11]、结构和化学组成有关[27-28]。刺破种皮处理后,高丹草种子电导率与发芽率均呈极显著负相关,进一步证明高丹草种子种胚包被物中半透层的存在阻挡了种子内部电解质的渗出,从种皮结构和半透性角度揭示了电导率法不能用于高丹草种子活力评价的原因,为其他禾本科牧草种子的透性和基于物质渗漏差异的种子活力测定方法的研究提供参考。
电导率法是评价种子质量和预测田间出苗的有效方法[25,29],该法已被国际种子检验协会(ISTA)推荐为大粒豆类种子活力测定的标准方法[16]。但是许多禾草种子质量下降并非可通过电导率进行检测[10,13,28]。本研究中,刺破种皮处理后,可用电导率法测定高丹草种子劣变程度,这为确定电导率法的适用范围提供科学依据,对具有半透层种子活力适宜测定方法的研究奠定了基础。但刺破种皮后电导率值能否准确预测种子的田间出苗率和耐贮藏性还需要进一步的研究。
参考文献References:
[1] Simpson G M. Seed dormancy in grasses. Cambridge, UK: Cambridge University Press, 1990.
[2] Ramakrishna P, Amritphale D. The perisperm-endosperm envelope in cucumis: structure, proton diffusion and cell wall hydrolysing activity. Annals of Botany, 2005, 96: 769-778.
[3] Beresniewicz M M, Taylor A G, Terhune B T,etal. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology, 1995, 23(1): 123-134.
[4] Thornton M L. Seed dormancy in watermelonCitrullusvulgarisShrad. Proceedings of the Association of Official Seed Analysis, 1968, 58: 80-84.
[5] Hill H J, Taylor A G. Relationship between viability, endosperm integrity and imbibed lettuce seed density and leakage. Hort Science, 1989, 24: 814-816.
[6] Welbaum G E, Bradford K J. Water relations of seed development and germination in muskmelon (CucumismeloL.) IV. Characteristics of the perisperm during seed development. Plant Physiology, 1990, 92: 1038-1045.
[7] Sundstorm F J, Amstrong J E, Edwards R L,etal. Relationship between laboratory indices of hot pepper seed vigor and crop greenhouse performance. Seed Science and Technology, 1986, 14(3): 705-714.
[8] Marshall A H, Naylor R E L. Seed vigor and field establishment in Italian ryegrass (LoliummultiflorumL.). Seed Science and Technology, 1985, 13: 781-794.
[9] Hall R D, Wiesner L E. Relationship between seed vigor tests and field performance of ‘Regar’ meadow bromegrass. Crop Science, 1990, 30: 967-970.
[10] He X Q. Seed coat permeability and location of semipermeable layer in seeds of several grass species. Lanzhou: Lanzhou University, 2011.
何学青. 数种禾草种皮透性及种子半透层定位研究. 兰州: 兰州大学, 2011.
[11] Wang Y R. Membrane damage during seed deterioration and its measurement and control in forage species. Nanjing: Nanjing Agricultural University, 2003.
王彦荣. 牧草种子劣变的膜损伤及其检测与调控. 南京: 南京农业大学, 2003.
[12] Zhan Q W, Lin P, Li J,etal. Research and prospect of hybrid between sorghum (Sorghumbicolor) and smut (Sorghumsudanense). Acta Prataculturae Sinica, 2001, 10(2): 56-61.
詹秋文, 林平, 李军, 等. 高粱-苏丹草杂交种研究与利用前景. 草业学报, 2001, 10(2): 56-61.
[13] Wang Y R, Yu L, Liu Y L. Relationship between seed viability and membrane permeability during seed deterioration in several forage species. Acta Prataculturae Sinica, 2002, 11(3): 85-91.
王彦荣, 余玲, 刘友良. 数种牧草种子劣变的生活力与膜透性的关系. 草业学报, 2002, 11(3): 85-91.
[14] State Bureau of Quality Technical Supervision. Rules for forage seed testing, GB/T 2930.4-2001. Beijing: China Standards Press, 2001.
国家质量技术监督局. 牧草种子检验规程, GB/T 2930.4-2001. 北京: 中国标准出版社, 2001.
[15] State Bureau of Quality Technical Supervision. Rules for forage seed testing, GB/T 2930.5-2001. Beijing: China Standards Press, 2001.
国家质量技术监督局. 牧草种子检验规程, GB/T 2930.5-2001. 北京: 中国标准出版社, 2001.
[16] Hampton J G, TeKrony D M. Handbook of vigour test methods. Zurich, Switzerland: International Seed Testing Association, 1995.
[17] Salanenka Y A, Taylor A G. Seed coat permeability and uptake of applied substances. Acta Horticulture, 2008, 782: 151-154.
[18] Taylor A G, Lee S S, Beresniewicz M M,etal. Amino acid leakage from aged vegetable seeds. Seed Science and Technology, 1995, 23: 113-122.
[19] Yan X J, Wang Y R. Location of semi-permeable layer and permeability of seed inSorghumsudanense. Acta Prataculturae Sinica, 2008, 17(5): 54-59.
颜新娟, 王彦荣. 苏丹草种子半透层定位与透性研究. 草业学报, 2008, 17(5): 54-59.
[20] Salanenka Y A, Taylor A G. Seedcoat permeability: uptake and post-germination transport of applied model tracer compounds. Hort Science, 2011, 46(4): 622-626.
[21] Salanenka Y A, Taylor A G. Uptake of model compounds by soybean, switchgrass and castor seeds applied as seed treatments//Seed production and treatment in a changing environment. Hampshire, UK: British Crop Protection Council, Alton, 2009: 76-81.
[22] Li Y R, Han J G, Sun Y,etal. Physiological and biochemical changes in russian wildryegrass seed during seed deterioration. Acta Agrestia Sinica, 2005, 13(3): 180-183.
李玉荣, 韩建国, 孙彦, 等. 新麦草种子劣变过程中生理生化变化. 草地学报, 2005, 13(3): 180-183.
[23] Yi J, Cao Z C, Li Q F,etal. Problems and methods of testing seed vigour in Leguminosae and Gramineae. Grassland of China, 1994, 3: 42-44.
易津, 曹自成, 李青风, 等. 豆科、禾本科牧草种子活力测定中的问题及测定方法. 中国草地, 1994, 3: 42-44.
[24] Han J G, Mao P S. Changes of physiology and biochemistry during seed development of siberian wildrye. Acta Agrestia Sinica, 2000, 8(4): 237-244.
韩建国, 毛培胜. 老芒麦种子发育过程中的生理生化变化. 草地学报, 2000, 8(4): 237-244.
[25] Xu B M, Gu Z H, Ren Z S. Discussion on conductivity measurement for determination of seed vigor. Seed, 1983, (1): 18-23.
徐本美, 顾增辉, 任祝三. 测定种子活力方法的探讨—IV电导法. 种子, 1983, (1): 18-23.
[26] Abdul-Baki A A, Anderson J D. Viability and leaching of sugars from geminating barley seeds. Corp Science, 1970, 10: 31-34.
[27] Beresniewicz M M, Taylor A G, Goffinet M C,etal. Chemical nature of a semipermeable layer in seed coats of leek, onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology, 1995, 23(1): 135-145.
[28] Li Y R, Han J G, Sun Y,etal. Physiological and biochemical changes in rosana western wheatgrass seed during seed deterioration. Seed, 2007, 26(2): 10-13.
李玉荣, 韩建国, 孙彦, 等. 蓝茎冰草种子劣变过程中生理生化变化. 种子, 2007, 26(2): 10-13.
[29] Abreu L A S, Carvalho M L M, Pinto C A G,etal. Electrical conductivity test to evaluate quality of sunflower seeds stored at different temperatures. Revista Brasileira De Sementes, 2011, 33: 637-644.
夏方山, 董秋丽, 毛培胜, 等. PEG引发对老化燕麦种胚细胞与线粒体结构及抗氧化性能的影响. 草业学报, 2018, 27(5): 170-177.
Xia F S, Dong Q L, Mao P S,etal. Effect of PEG priming on the cellular and mitochondrial structure and oxidation resistance of aged oat seed embryos. Acta Prataculturae Sinica, 2018, 27(5): 170-177.

