PEG引发对老化燕麦种胚细胞与线粒体结构及抗氧化性能的影响
夏方山,董秋丽,毛培胜,王明亚,陈玲玲,程航
(1.山西农业大学动物科技学院,山西 晋中 030801;2.中国农业大学动物科技学院,草业科学北京市重点实验室,北京 100193;3.山西农业大学林学院,山西 晋中 030801)
种子是植物种质资源创新的重要原料及其有效保存体,也是农牧业生产成败的先决条件。然而,种子在储藏过程中总会不同程度地发生老化现象,并导致其萌发及幼苗生长能力下降,从而造成植物产量及品质的大幅降低,给农牧业生产带来巨大的经济损失[1-2]。贮藏种子的含水量越大,其活力的下降速度也就越快[3]。超干贮藏由于保持了种子的生理功能及其膜结构的完整性,从而最大限度地延长种子的贮藏寿命,因而成为保护植物种质资源、维持其遗传稳定性的重要方法,并越来越受人们的关注[4-5]。然而,种子不仅在超干处理过程会受到损伤,还会在萌发过程发生吸胀损伤,导致其萌发及幼苗生长能力下降[6]。因此,种子引发称为当今种子科学领域的一个研究热点。聚乙二醇(PEG)是最常用的引发剂,可降低萌发过程中水分进入种子的速度,从而修复种子的老化损伤[7-8]。PEG引发已应用于穿心莲(Andrographispaniculata)[9]、茎瘤芥(Brassicajuncea)[10]及蔓性千斤拔(Moghaniaphilippinensis)[11]等植物老化种子的研究。目前,已报道了PEG引发对超干燕麦(Avenasativa)种子老化后种子萌发、幼苗生长及其细胞结构和抗氧化性能的影响[5,12-14]。然而,尚未有关于PEG引发影响超干种子老化后种胚细胞与线粒体结构和抗氧化性能关系的报道。
燕麦是具有耐瘠薄,耐盐碱,抗旱及耐寒等优良特性的传统优质粮饲兼用作物[15-16]。燕麦秸秆含有较高的粗蛋白、粗脂肪以及无氮浸出物等营养成分,而其难消化的粗纤维含量却较低[17]。燕麦籽实则富含均衡蛋白质、可溶性膳食纤维β-葡聚糖、不饱和脂肪酸、维生素及矿物质等对人类健康至关重要的营养成分[18]。燕麦籽实含有较高的油脂,含量为3.1%~11.6%,其中不饱和脂肪酸达80%以上[19-20]。然而,由于脂肪衍生物容易酸败或劣变,所以燕麦籽实的高脂肪含量会导致其更容易发生劣变,从而限制了燕麦籽实在食物及种子方面的广泛应用[21]。因此,研究燕麦种子的老化对其种子资源的保存与利用具有重要意义。试验以老化的超干燕麦种子为材料,分析PEG和水引发对其活力影响的细胞与线粒体协同作用机理,为预防超干种子萌发过程的吸胀损伤,以及老化种子的修复机理研究提供理论基础。
1 材料与方法
1.1 材料来源
供试燕麦(品种:三冠王)种子由中国农业大学牧草种子实验室提供,2009年收集于河北省张家口市沽源牧场,在-20 ℃保存至2014年12月进行试验。种子自然含水量为9.8%,正常种苗数为89%,不正常种苗数为5%,含油量为5.0%。
1.2 超干处理
称量种子初始重量,并将其放置于装有变色硅胶的干燥器内,反复称重,当种子达到所需重量时(种子含水量为4%,鲜重),立即密封于12 cm×17 cm的锡箔袋中,每袋20 g种子,放入4 ℃冰箱备用。含水量的测定方法参照文献[5]进行。
1.3 老化及PEG引发处理
将种子放于45 ℃恒温水浴箱内劣变48 d,然后用水势为0(蒸馏水,DW)和-1.2 MPa的PEG-6000在20 ℃黑暗条件引发处理12 h,PEG浓度及引发时间的筛选结果见文献[5]。蒸馏水冲洗2次,用滤纸吸干表层水分后, 25 ℃室内风干。以未引发的老化燕麦种子为对照(CK)。重复4次。
1.4 测定指标
1.4.1发芽试验及指标测定 参照国际种子检验协会(International Seed Testing Association,ISTA)的种子检验规程(2013)[22]进行。选取均匀饱满的种子100粒放入培养皿(11.5 cm×11.5 cm),20 ℃恒温条件培养,4次重复。每天统计种子发芽数(胚根突破种皮2 mm),末次计数第10天,最终统计正常种苗数,并测定全部正常种苗的平均苗长及苗鲜重,种子发芽率参照ISTA的种子检验规程(2013)[22]进行,发芽指数及幼苗活力指数参照Abdul-Baki等[23]的方法进行,平均发芽时间参照Ellis等[24]的方法进行。
1.4.2细胞及线粒体超微结构观察 参照Xia等[3]的方法进行。随机选取待测燕麦种子,在蒸馏水中吸胀4 h后,用解剖针在体视镜下快速取出种胚,浸泡于4%的戊二醛固定液。经过脱水、包埋、染色处理后,用透射电镜(日立H-7500)在10000倍范围内观察样品切片,并拍摄其细胞及线粒体照片。
1.4.3粗酶液及线粒体的提取 酶的提取:参照Kibinza等[25]的方法进行。剥取50个种胚于预冷的研钵,用3.5 mL提取液研磨至匀浆,24188 r·min-1离心15 min。上清液在4 ℃冰箱保存备用。所有操作均在1~4 ℃进行。
线粒体的提取与纯化:参照Yin等[26]的方法进行。剥取200个燕麦种胚于预冷的研钵,加入20 mL预冷的提取缓冲溶液,冰浴研磨5 min,4层纱布过滤后,反复离心洗涤获得线粒体悬浮液,最后用1∶2的Percoll梯度分离液纯化。所有操作均在1~4 ℃进行。
1.4.4抗氧化酶活性测定 酶活性所需可溶性蛋白含量按照考马斯亮蓝测定试剂盒说明书(南京建成生物工程研究所-南京建成科技有限公司)进行。
超氧化物歧化酶(superoxide dismutase,SOD)活性的测定:参照Rao等[27]的方法进行。1 mL反应体系中加入0.5 mL酶液或10 μL线粒体(约含20 μg蛋白),SOD的活性以每mg酶液或线粒体蛋白抑制氮蓝四唑(nitroblue tetrazolium,NBT)光化还原的50%作为一个酶活性单位。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性的测定:参照Nakano等[28]的方法进行。1 mL反应体系中加入0.5 mL酶液或10 μL线粒体(约含20 μg蛋白),利用抗坏血酸(ascorbic acid,AsA)在290 nm处吸光值的减少来表示APX的酶活性。
谷胱甘肽还原酶(glutathione reductase,GR)活性的测定:参照Madamanchi等[29]的方法进行。1 mL反应体系中加入0.5 mL酶液或10 μL线粒体(约含20 μg蛋白),通过测定由于还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)的氧化导致的340 nm处吸光值的降低来表示GR的活性。
1.4.5丙二醛(malonaldehyde,MDA)含量测定 参照Bailly等[30]的方法进行,1 mL反应体系中加入0.5 mL酶液或10 μL线粒体(约含20 μg蛋白)。
1.5 数据处理与统计分析
采用Excel 2010和SAS 8.0统计分析软件处理试验数据,采用Duncan’s法进行多重比较,结果以平均值±标准误表示。
2 结果与分析
2.1 PEG引发对老化燕麦种子萌发的影响
PEG引发后老化燕麦种子发芽率和发芽指数显著(P<0.05)高于CK(表1),而其平均发芽时间显著(P<0.05)低于CK;DW引发后其发芽指数显著(P<0.05)高于CK,但其发芽率却显著(P<0.05)低于CK,而DW引发后其平均发芽时间与CK差异不显著(P>0.05)。
2.2 PEG引发对老化燕麦种子幼苗生长的影响
PEG引发后老化燕麦种子的苗长显著(P<0.05)低于CK(表2),其幼苗活力指数显著(P<0.05)高于CK,而其苗鲜重与CK差异不显著(P>0.05);DW引发后其苗长与CK差异不显著(P>0.05),而其苗鲜重和幼苗活力指数显著(P<0.05)低于CK。
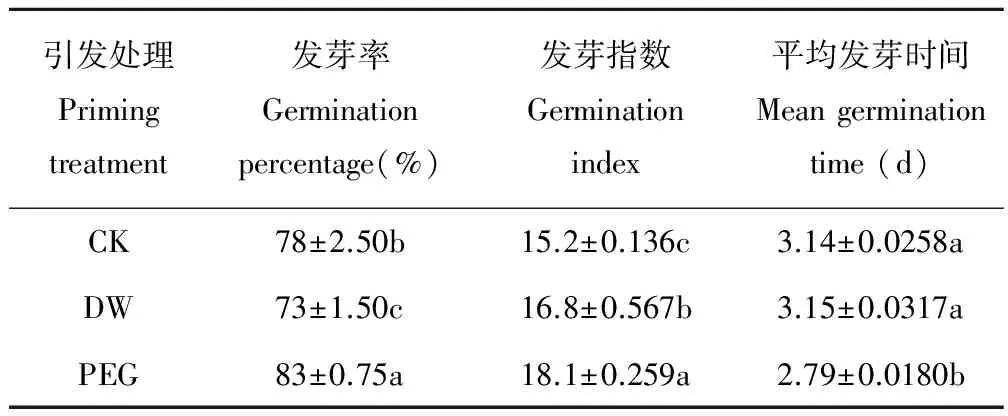
表1 不同引发条件下老化燕麦种子萌发的变化Table 1 Changes in germination of aged oatseeds with different priming

表2 不同引发条件下老化燕麦种子幼苗生长的变化Table 2 Changes in germination of aged oat seeds with different priming
2.3 PEG引发对老化燕麦种胚细胞及线粒体超微结构的影响
CK老化燕麦种胚细胞及其细胞核维持正常形状,并有大量的线粒体和液泡状结构,细胞发生了明显的质壁分离,线粒体膜清晰可见,其基质稠密(图1A和D)。DW引发后老化燕麦种胚细胞核和线粒体膜模糊,且细胞核膜出现褶皱,线粒体基质变稀(图1B和E)。PEG 引发后老化燕麦种胚细胞及其核结构正常,有大量线粒体、内质网及液泡状结构存在,其细胞核及线粒体双层膜结构清晰可见,线粒体嵴也清晰可见(图1C和F)。

图1 不同引发条件下超干燕麦种子老化后种胚细胞及线粒体结构的变化Fig.1 Changes of different priming in cellular and mitochondrial structure of ultra-dried oat seeds after ageing
2.4 PEG引发对老化燕麦种胚细胞及线粒体抗氧化酶的影响
老化燕麦种胚细胞内SOD、APX和GR活性显著(P<0.05)低于其线粒体(表3)。PEG引发后老化燕麦种胚细胞及线粒体内SOD、APX和GR活性均显著(P<0.05)高于CK,其种胚细胞内SOD、APX和GR活性分别提高了26.7%、20.9%和26.9%,其线粒体内SOD、APX和GR活性分别提高了19.2%、19.4%和17.1%;而DW引发后其细胞及线粒体内SOD、APX和GR活性均显著(P<0.05)低于CK,其种胚细胞内SOD、APX和GR活性分别降低了11.8%、8.3%和18.3%,其线粒体内SOD、APX和GR活性分别降低了17.8%、21.9%和28.8%。
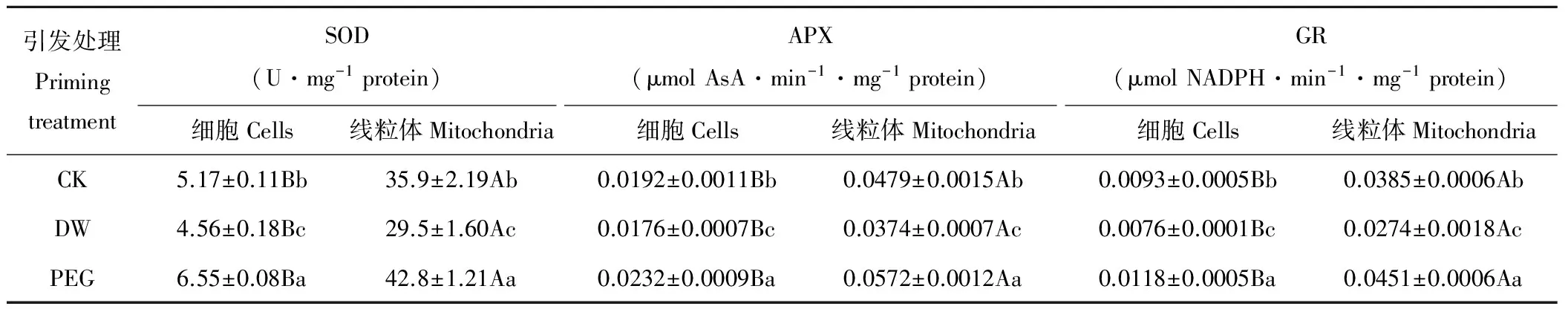
表3 不同引发条件下老化燕麦种胚线粒体抗氧化酶的变化Table 3 Changes in mitochondrial antioxidant enzymes activity of aged oat seeds with different priming
2.5 PEG引发对老化燕麦种胚细胞及线粒体MDA含量的影响
老化燕麦种胚细胞内MDA含量显著(P<0.05)高于其线粒体内(表4)。PEG引发后燕麦种胚细胞及线粒体MDA含量均显著(P<0.05)低于CK,其种胚细胞内MDA含量降低了28.3%,其线粒体内MDA含量降低了13.7%;然而,DW引发后其细胞及线粒体MDA含量均显著(P<0.05)高于CK,其种胚细胞内MDA含量提高了29.1%,其线粒体内MDA含量提高了40.4%。
3 讨论
种子萌发及幼苗建成是植物生命周期的关键时期,此时对外界环境因子反应最敏感。而PEG引发可修复种子的老化损伤并显著提高其活力水平[31]。Bailly等[7]研究发现,浓度为-2.0 MPa 的PEG在15 ℃引发7 d提高了老化向日葵(Helianthusannuus)种子的萌发速度,并恢复其最初的发芽能力。Sharanappa等[32]研究发现,浓度为-1.0 MPa的PEG引发72 h能提高老化向日葵种子的发芽率、发芽速度及幼苗活力指数。本研究发现,与CK相比,浓度为-1.2 MPa的PEG引发12 h后显著(P<0.05)提高了老化燕麦种子的发芽率和发芽指数,并显著(P<0.05)降低了其平均发芽时间,这说明浓度为-1.2 MPa的PEG引发12 h能有效修复超干燕麦种子的老化损伤。PEG引发显著提高了老化燕麦种子的幼苗活力指数,但对其苗鲜重影响不显著(P>0.05),并显著(P<0.05)降低了其苗长,这说明PEG引发抑制了老化燕麦种子的幼苗生长。PEG引发促进了老化燕麦种子幼苗根的伸长生长,但降低了其幼苗根和芽的鲜重及芽长[12]。
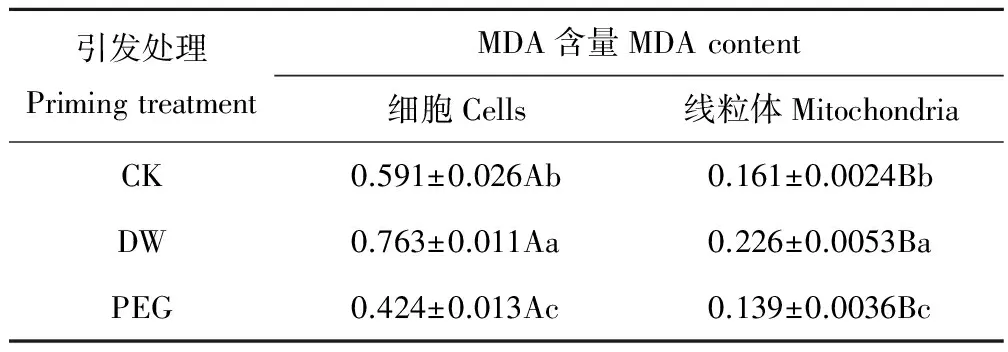
表4 不同引发条件下老化燕麦种胚细胞及线粒体MDA含量的变化Table 4 Changes in cellular and mitochondrial MDA contents of aged oat seeds with different priming (μmol·mg-1 protein)
Dorna等[33]研究发现,与对照相比,DW引发(500 μL DW·g-1种子在20 ℃黑暗条件下48 h)后老化(20 ℃贮藏12个月)洋葱(Alliumcepa)种子(20 ℃和45%的相对空气湿度干燥48 h)的发芽率没有变化。Sharanappa等[32]研究发现,DW引发(25 ℃浸泡18 h)能够有效提高老化[在(40±1) ℃和90%相对空气湿度下0、24和48 h]向日葵种子的活力水平。然而,本试验发现,DW引发后虽显著(P<0.05)提高了老化燕麦种子发芽指数,但对其平均发芽时间与苗长影响不显著(P>0.05),并显著(P<0.05)降低了其发芽率、幼苗活力指数和苗鲜重,DW引发后其苗长与CK差异不显著(P>0.05),这说明DW引发造成了老化的超干燕麦种子萌发的吸胀损伤。本试验结果与老化向日葵[32]和洋葱[33]种子的研究结果之间存在的差异,而这可能主要是由于种子含水量不同引起的。种子含水量高低是影响引发成败的关键[34]。本试验以超干燕麦种子(含水量为4%)为材料,这是造成不同于前人以安全含水量植物种子为材料报道的主要原因[32-33]。
超干种子通过提高抗氧化酶系统的活力来减轻老化过程产生的细胞损伤。超干种子通过提高细胞SOD、POD、CAT、APX和GR活性来缓解老化过程的脂质过氧化损伤,降低其MDA含量,从而延缓其活力水平的下降速度[35-36]。因此,抗氧化酶的变化是评价PEG引发后超干种子活力的早期快速预警系统[13]。PEG引发能提高老化种子细胞SOD、CAT、POD、DHAR和GR等抗氧化酶的活性,并降低其MDA的产生[7,37]。本研究发现,浓度为-1.2 MPa的PEG引发12 h后显著提高了老化燕麦种胚细胞及线粒体SOD、APX和GR活性(P<0.05),从而显著(P<0.05)降低了其细胞及线粒体的MDA含量,使其细胞保持正常结构,表现为细胞核膜清晰可见,并有内质网及液泡存在,其线粒体数量增多,基质稠密,双层膜和嵴清晰可见。这说明PEG引发通过提高超干燕麦种胚细胞及线粒体SOD、APX和GR活性来缓解脂质过氧化损伤,以修复细胞及线粒体的结构与功能,从而使老化种子的活力水平得到提高。然而,DW引发显著(P<0.05)降低了其种胚细胞及线粒体SOD、APX和GR活性,从而显著(P<0.05)增加了其细胞及线粒体MDA含量,致使其细胞结构异常,表现为细胞核膜出现褶皱,线粒体数量较少,基质稀薄,双层膜模糊,嵴消失。这说明DW引发不仅加剧了其老化损伤,还导致了超干燕麦种子的吸胀损伤。高水势使超干种子快速吸胀,加剧了老化种子细胞膜完整性的丧失,从而不可逆地伤害细胞,形成吸胀损伤,表现为种子活力下降[6]。适当浓度的PEG引发主要通过提高超干燕麦种子的抗氧化能力来修复其老化损伤,并避免其吸胀损伤[13-14]。
本试验中,老化的超干燕麦种子经PEG引发后,其种胚细胞及线粒体SOD、APX和GR活性均显著(P<0.05)高于DW引发,而其细胞及线粒体MDA含量均显著(P<0.05)低于DW引发,这说明PEG引发不仅能修复其老化损伤,还能避免其萌发过程的吸胀损伤。老化的超干燕麦种子经PEG和DW引发后,其细胞及线粒体内SOD、APX和GR活性,以及MDA含量的变化规律相同,说明细胞及其线粒体在维持老化超干燕麦种子的活力方面具有协同作用。然而,燕麦种胚线粒体是其种子老化及修复最敏感的细胞器[14,38]。本试验发现,老化的超干燕麦种胚线粒体SOD、APX、GR活性显著(P<0.05)高于细胞,而其线粒体MDA含量显著(P<0.05)低于细胞,这说明线粒体是超干燕麦种子老化后清除脂质过氧化损伤的主要部位,因此,线粒体是对PEG引发最敏感的细胞器。
4 结论
PEG引发通过提高超干燕麦老化种胚细胞及线粒体的SOD、APX及GR活性,以缓解其脂质过氧化损伤,并修复其细胞及线粒体超微结构,从而促进其萌发。然而,蒸馏水引发与此相反。在老化的超干燕麦种子的引发过程中,其种胚细胞与线粒体协同发挥作用,但线粒体是其发挥作用的最主要部位。
参考文献References:
[1] Liu J, Gui J, Gao W,etal. Review of the physiological and biochemical reactions and molecular mechanisms of seed aging. Acta Ecologica Sinica, 2016, 36(16): 4997-5006.
刘娟, 归静, 高伟, 等. 种子老化的生理生化与分子机理研究进展. 生态学报, 2016, 36(16): 4997-5006.
[2] Chen H, Chen L L, Xia F S,etal. Advances in the molecular biology study of seed aging. Pratacultural Science, 2017, 34(1): 129-137.
程航, 陈玲玲, 夏方山, 等. 种子老化的分子生物学研究. 草业科学, 2017, 34(1): 129-137.
[3] Xia F, Chen L, Sun Y,etal. Relationships between ultrastructure of embryo cells and biochemical variation during ageing of oat (AvenasativaL.) seeds with different moisture content. Acta Physiologiae Plantarum, 2015, 37(89): 1-11.
[4] Perez-Garcia F, Gomez-Campo C, Ellis R H. Successful long-term ultra-dry storage of seed of 15 species of Brassicaceae in a genebank: variation in ability to germinate over 40 years and dormancy. Seed Science and Technology, 2009, 37(3): 640-649.
[5] Xia F S, Yan H F, Mao P S,etal. Effects of polyethylene glycol priming on the seed vigor for aged oat seeds. Acta Prataculturae Sinica, 2015, 24(11): 234-239.
夏方山, 闫慧芳, 毛培胜, 等. PEG引发对燕麦老化种子活力的影响. 草业学报, 2015, 24(11): 234-239.
[6] Bewley J D, Bradford K J, Hilhorst H W M,etal. Seeds: Physiology of development, germination and dormancy. 3rd Edi. New York: Springer Press, 2013: 341-374.
[7] Bailly C, Benamar A, Corbineau F,etal. Free radical scavenging as affected by accelerated ageing and subsequent priming in sunflower seeds. Physiologia Plantarum, 1998, 104(4): 646-652.
[8] Butler L H, Hay F R, Ellis R H,etal. Priming and re-drying improve the survival of mature seeds ofDigitalispurpureaduring storage. Annals of Botany, 2009, 103(8): 1261-1270.
[9] Pan C L, Huang Y F, Deng Z J,etal. Effect of PEG treatment on fresh and aged seed germination and seedling growth ofAndrographispaniculata(Burm. F.) Nees. Seed, 2013, 32(12): 30-34.
潘春柳, 黄燕芬, 邓志军, 等. PEG处理对新鲜和老化穿心莲种子萌发及幼苗生长的影响.种子, 2013, 32(12): 30-34.
[10] Wang H C, Zhao C Q, Zheng M N,etal. Effects of PEG-soaking on aged seed vigor and seedling growth of tumorous stem mustard (Brassicajunceavar. tumida Tsen et Lee ‘Yonganxiaoye’). Plant Physiology Communications, 2010, 46(2): 131-134.
王慧超, 赵昌琼, 郑美娜, 等. 聚乙二醇(PEG)浸种对茎瘤芥老化种子活力及其幼苗生长的影响. 植物生理学通讯, 2010, 46(2): 131-134.
[11] Feng S X, Ma X J, Li X Y,etal. The impact of soaking in PEG on the germination and vigor of the aging seed of trailing flemingia. Crops, 2013, (1): 136-139.
冯世鑫, 马小军, 李小勇, 等. PEG浸种对老化的蔓性千斤拔种子萌发及活力的影响. 作物杂志, 2013, (1): 136-139.
[12] Xia F S, Yan H F, Mao P S,etal. Effects of PEG priming on germination and seedlings growth of accelerated ageing oat seeds. Pratacultural Science, 2015, 32(5): 731-737.
夏方山, 闫慧芳, 毛培胜, 等. PEG引发对燕麦老化种子萌发与幼苗生长的影响. 草业科学, 2015, 32(5): 731-737.
[13] Xia F S, Mao P S, Wang M Y,etal. Effect of PEG priming on oxidation resistance of aged oat seeds. Acta Agrestia Sinica, 2016, 24(5): 933-938.
夏方山, 毛培胜, 王明亚, 等. PEG引发对老化燕麦种子抗氧化性能的影响. 草地学报, 2016, 24(5): 933-938.
[14] Xia F S, Chen L L, Yan H F,etal. Antioxidant and ultrastructural responses to priming with PEG in aged, ultra-dry oat seed. Seed Science and Technology, 2016, 44(3): 1-13.
[15] Qin F C, Zhao G Q, Jiao T,etal. Effects of different moisture contents and additives on the quality of baled oat silage. Acta Prataculturae Sinica, 2014, 23(6): 119-125.
覃方锉, 赵桂琴, 焦婷, 等. 含水量及添加剂对燕麦捆裹青贮品质的影响. 草业学报, 2014, 23(6): 119-125.
[16] Liu F Q, Liu J L, Zhu R F,etal. Physiological responses and tolerance of four oat varieties to salt stress. Acta Prataculturae Sinica, 2015, 24(1): 183-189.
刘凤歧, 刘杰淋, 朱瑞芬, 等. 4种燕麦对NaCl胁迫的生理响应及耐盐性评价. 草业学报, 2015, 24(1): 183-189.
[17] Zheng X, Wei Z W, Wu Z N,etal. Adaptability evaluation of differentAvenasativavarieties in Yangzhou area. Acta Agrestia Sinica, 2013, 21(2): 272-279.
郑曦, 魏臻武, 武自念, 等. 不同燕麦品种(系)在扬州地区的适应性评价. 草地学报, 2013, 21(2): 272-279.
[18] Shewry P R, Piironen V, Lampi A M,etal. Phytochemical and fiber components in oat varieties in the HEALTHGRAIN diversity screen. Journal of Agricultural and Food Chemistry, 2008, 56(21): 9777-9784.
[19] Claudine C, Tom S, Susan R V,etal. Comparison of two headspace sampling techniques for the analysis of off-flavour volatiles from oat based products. Food Chemistry, 2012, 134(3): 1592-1600.
[20] Qi X Y, Cao S Q, Liu H S,etal. Studies on the lipid composition of different oat varieties and its relationship with the other nutrients. Journal of Chinese Instituto of Food Science and Technology, 2014, 14(5): 63-71.
戚向阳, 曹少谦, 刘合生, 等. 不同品种燕麦的油脂组成及与其它营养物质相关性研究. 中国食品学报, 2014, 14(5): 63-71.
[21] Heini R L, Oksman-Caldentey K M, Lehtinen P,etal. Effect of drying treatment conditions on sensory profile of germinated oat. Cereal Chemistry, 2001, 78(6): 707-714.
[22] International Seed Testing Association. International rules for seed testing. Bassersdorf: Zurich, 2013.
[23] Abdul-Baki A A, Anderson J D. Vigour determination in soybean seed multiple criteria. Crop Science, 1973, 13(6): 630-633.
[24] Ellis R H, Roberts E H. The influence of genotype, temperature and moisture on seed longevity in chickpea, cowpea and soybean. Annals of Botany, 1982, 50(1): 69-82.
[25] Kibinza S, Vinel D, Cme D,etal. Sunflower seed deterioration as related to moisture content during ageing, energy metabolism and active oxygen species scavenging. Physiologia Plantarum, 2006, 128(3): 496-506.
[26] Yin G, Sun H, Xin X,etal. Mitochondrial damage in the soybean seed axis during imbibition at chilling temperatures. Plant and Cell Physiology, 2009, 50(7): 1305-1318.
[27] Rao K V M, Sresty T V S. Antioxidant parameters in the seedlings of pigeon pea (Cajanuscajan(L.) Millspaugh) in response to Zn and Ni stresses. Plant Science, 2000, 157(1): 113-128.
[28] Nakano Y, Asada K. Hydrogen peroxide scavenged by ascorbate-specific peroxidase in spinach chloroplast. Plant and Cell Physiology, 1981, 22(5): 867-880.
[29] Madamanchi N R, Alscher R G. Metabolic bases for differences in sensitivity of two pea cultivars to sulfur dioxide. Plant Physiology, 1991, 97(1): 88-93.
[30] Bailly C, Benamar A, Corbineau F,etal. Changes in malondialdehyde content and superoxide dismutase, catalase and glutathione reductase activities in sunflower seeds as related to deterioration during accelerated aging. Physiologia Plantarum, 1996, 97(1): 104-111.
[31] Inayat-ur-rahman, Ali N, Rab A,etal. Role of storage seed priming in controlling seed deterioration during storage. Sarhad Journal of Agriculture, 2013, 29(3): 379-386.
[32] Sharanappa, Devaraju P J, Siddaraju R,etal. Studies on the influence of accelerated ageing and seed priming on seed quality parameters of sunflower (HelianthusannuusL.) hybrid KBSH-41 and its parents. Mysore Journal of Agricultural Sciences, 2013, 47(1): 81-88.
[33] Dorna H, Jarosz M, Szopińska D,etal. Germination, vigour and health of primedAlliumcepaL. seeds after storage. Acta Scientiarum Polonrum-Hortorum Cultus, 2013, 12(4): 43-58.
[34] McDonald M B. Seed deterioration: physiology, repair and assessment. Seed Science and Technology, 1999, 27(1): 177-237.
[35] Li Y, Feng H Y, Chen T,etal. Physiological responses ofLimoniumaureumseeds to ultra-drying. Journal of Integrative Plant Biology, 2007, 49(5): 569-575.
[36] Cui K, Wang H Y, Li K,etal. Physiological and biochemical effects of ultra-dry storage onbarbadosnutseeds. Crop Science, 2014, 54(4): 1748-1755.
[37] Jisha K C, Vijayakumari K, Jos Puthur T. Seed priming for abiotic stress tolerance: an overview. Acta Physiologiae Plantarum, 2013, 35(5): 1381-1396.
[38] Kong L Q, Mao P S, Yu X D,etal. Physiological changes in oat seeds aged at different moisture contents. Seed Science and Technology, 2014, 42(2): 190-201.
朱永群, 彭丹丹, 林超文, 等. 苏丹草转录组SSR分子标记开发及遗传多样性评价. 草业学报, 2018, 27(5): 178-189.
Zhu Y Q, Peng D D, Lin C W,etal. Development of SSR markers based on transcriptome sequence and analysis of genetic diversity inSorghumsudanense. Acta Prataculturae Sinica, 2018, 27(5): 178-189.

