微囊化嗅鞘细胞移植周围神经损伤痛及下调背根神经节P2X3嘌呤受体的表达*
张文俊 熊梅娟 刘怡果 薛国勇 刘曾旭△
(1 南昌大学解剖学教研室, 南昌 330000; 2 井冈山大学解剖学教研室, 吉安 343000)
神经损伤引起的疼痛机制复杂,未能完全闸明。嘌呤受体P2X家族在神经损伤引起的疼痛中发挥着重要的作用[1]。研究表明嘌呤P2X3受体表达水平与神经病理性疼痛呈正相关[2-3]。目前,用细胞移植治疗周围神经损伤效果较好,而嗅鞘细胞(olfactory ensheathing cells, OECs)是一种特殊的神经胶质细胞,能终生不断更新存活,释放多种神经营养因子,改变神经周边的损伤局部环境,利于神经修复[4-5]。微囊化(microencapsulation,MC)具有隔离移植细胞与宿主直接接触,免受宿主免疫排斥作用[6],延长细胞存活时间,更有利于细胞修复神经损伤[7-8]。而微囊化嗅鞘细胞移植治疗神经损伤,国内外报道较少。本研究通过结扎SD大鼠的坐骨神经,制作周围神经损伤的动物模型,用微囊化嗅鞘细胞和非微囊化嗅鞘细胞移植到坐骨神经损伤周围,于术后10d和20d 用行为学方法检测各组大鼠机械刺激缩足反射阈值,原位杂交组织化学方法检测大鼠P2X3受体的表达情况并进行对比。
1 材料和方法
1.1 实验动物及主要材料
健康SD大鼠40只,雌雄不拘,体质量80~100g,周龄3周。
4%多聚甲醛,1%DEPC水(中国博士德公司);15%胎牛血清(Transgen,北京);DMEM/F12培养基(博士德,武汉);1.5%海藻酸钠(美国Sigma公司);专用PBS缓冲液(1000ml双蒸水、NaCl 30g、Na2HPO4·12H2O 6g、NaH2PO4·2H2O 0.4g,pH 7.2~7.6),3%柠檬酸,2×SSC缓冲液(1000ml双蒸水加氯化钠17.6g、柠檬酸三钠8.8g),0.5×SSC(300ml双蒸水+100ml 2×SSC),0.2×SSC(270ml双蒸水+30ml 2×SSC),P2X3受体专用原位杂交试剂盒(中国武汉博士德生物公司)包括:10×胃蛋白酶、预杂交液2ml、P2X3寡核苷酸探针杂交液2ml、封闭液5ml、生物素化鼠抗地高辛5ml、SABC-POD 5ml、生物素化过氧化物酶5ml。冰冻切片机(Promega company,美国),倒置显微镜(Olympus BX-41,日本);原位杂交专用盖玻片,高速离心机(Affinity,美国);Aesthesio VonFrey细丝及玻璃盒(Danmic,CA,USA)。
1.2 嗅鞘细胞的取材及培养
取1只健康SD大鼠,用无菌注射器吸取1ml 2%戊巴比妥钠腹腔注射麻醉,用碘伏消毒大鼠头颈部3遍,用无菌外科剪断头,打开皮肤及皮下组织,充分暴露嗅球组织,并将其完整取下,放于准备好的PBS中漂洗,约5min,再用眼科剪将嗅球组织剪成碎末,经过小滤过网,将滤过后的嗅球组织碎末置于10ml离心管中,用一次性吸管吸取5ml 0.5%的胰蛋白酶进行消化,约5min,加入5ml培养基终止消化,将离心管放于离心机中(1000r/min,10min),倒掉上清液,加入15%胎牛血清的DMEM/F12培养基,用一次性滴管,轻轻吹打(60~80次)混匀,将细胞悬液种植到无菌培养瓶中,将培养瓶放入CO2孵箱中,按NASH差速贴壁方法进行培养,第1次36h换液1次,以后根据细胞生长情况,隔2~3d进行换液,并在倒置显微镜下观察细胞贴壁情况及生长状况,原代培养5d可进行细胞扩增培养。
1.3 制备微囊化嗅鞘细胞
取扩增第9天的细胞悬液,将细胞悬液在显微镜下计数2.4×106/ml,加1滴锥虫蓝染色与细胞悬液混匀,加到细胞计数板上,在倒置显微镜下计算细胞存活率>95%后,将细胞悬液与1.5%海藻酸钠生理盐水溶液1∶1混匀,经自制双腔喷头(事先经过消毒)将其均匀缓慢喷入20mmol/L的氯化钡生理盐水溶液中,轻摇混匀后静置沉淀,吸去上清,生理盐水洗涤2次,最后将所得微囊悬浸于生理盐水中备用。
1.4 动物模型建立及分组
实验分4组,对照组(sham)、慢性坐骨神经损伤组(CCI)、非微囊化嗅鞘细胞组(non-MC-OECs)及微囊化嗅鞘细胞组(MC-OECs),各组10只。Sham组:取1%戊巴比妥钠(40mg/kg),从大鼠腹腔进行麻醉,将大鼠固定在手术台上,先剪掉右下肢毛发,用碘伏进行外在皮肤消毒3遍,逐层打开皮下组织,暴露右下肢坐骨神经,不做坐骨神经结扎处理,然后逐层缝合皮肤,再次消毒,做好标记。CCI组:按照上述同样方法暴露大鼠右下肢坐骨神经,用玻璃分针分离开坐骨神经周边的筋膜组织,用4号羊肠线结扎4道,间距为1mm,结扎力度以右下肢抽动为宜,然后缝合,消毒,做好标记。non-MC-OECs组:按照以上方法暴露坐骨神经,用可吸收明胶海绵吸1ml嗅鞘细胞悬液(2.4×106/ml),置于坐骨神经两侧,缝合,消毒,做好标记。MC-OECs组:按照同样方法暴露右下肢坐骨神经,用可吸收明胶海绵吸同等量的微囊化嗅鞘细胞悬液置于坐骨神经两侧,逐层缝合,消毒,做好标记。以上4组在常温,湿度适宜下,分别分开饲养,定期更换垫料并加饲料,补充水分,并观察各组大鼠右下肢的情况。
1.5 大鼠机械刺激诱发反射阈值检测
于术后10、20d,将各组大鼠放于VonFrey痛阈测量玻璃仪器中,有机玻璃仪底部为铁丝网构成,玻璃仪器放于水平面上,在常温,安静环境下,让其在仪器中适应15min,用VonFrey细丝刺激大鼠右后肢足底,刺激强度逐渐增加,直到大鼠右后肢出现缩足、舔足的反应即可,每次刺激时间不少于15s,当用细丝针刺激大鼠后肢时,出现大鼠右后肢抬足,缩足的最小刺激强度为机械缩足反射阈值(WMT),重复3次,取平均值。
1.6 原位杂交组织化学方法
于术后10、20d,将各组大鼠进行麻醉灌注,取第4~5 腰椎(L4-5)处背根神经节放入4%多聚甲醛固定4h,再放入15%和30%的蔗糖溶液(1%DEPC水配置)中进行梯度脱水过夜,将组织放入冰冻切片机中切片,厚度10nm,将组织吸附于载玻片上,常温下放置30min,将载玻片放入PBS中漂洗3×5min;加3%柠檬酸胃蛋白酶,室温下作用1~2min,PBS洗涤3×5min;加预杂交液,并放入38℃水浴箱中作用2h,不洗;加杂交液,盖上专用盖玻片,放入38℃水浴箱中过夜;2×SSC,0.5×SSC,0.2×SSC在38℃水浴箱中依次洗涤3次,每次5min,加封闭液,水浴箱中封闭30min,不洗;加生物素化鼠抗地高辛,水浴箱中作用90min,PBS洗涤3×5min;加SABC水浴箱中作用20min,PBS洗涤3×5min;加生物素化过氧化物酶,水浴箱中作用30min,PBS洗3×5min;加DAB显色液显色2min,载玻片上组织变成黄色即可,放入水中冲洗;乙醇梯度脱水,二甲苯透明,封片,倒置显微镜下观察,染成棕黄色和褐色为P2X3受体表达阳性细胞,用Image-Pro Plus 6.0软件测量P2X3受体阳性细胞百分比及平均吸光度表达情况。
1.7 统计学处理
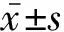
2 结果
2.1 大鼠饲养及观察情况
术后定期观察大鼠饲养情况,大鼠生长情况良好,未见咬伤及死亡情况,术后10、20d观察大鼠右下肢情况,sham组大鼠右下肢活动正常;CCI组大鼠右下肢瘫痪,无活动,拉其右下肢无收缩;non-MC-OECs组大鼠右下肢有活动,拉其后肢有收缩反应,收缩缓慢,下肢能支撑;相比non-MC-OECs组,MC-OECs组大鼠右下肢活动有力,拉其下肢收缩时间较快。术后20d比术后10d大鼠右下肢恢复较好。
2.2 大鼠机械刺激缩足反射阈值
于术后10、20d分别检测各组大鼠右后肢机械刺激缩足反射阈值,与sham组对比,CCI组大鼠机械缩足反射阈值明显减低(P<0.05);与CCI组对比,non-MC-OECs组与MC-OECs组大鼠右后肢机械缩足反射阈值明显增高(P<0.05);与non-MC-OECs组对比,MC-OECs组大鼠右后肢机械缩足反射阈值增高(P<0.05);与术后10d相比,术后20d的MC-OECs组大鼠机械缩足反射阈值较高(图1)。

图1 术后10d和20d大鼠机械刺激缩足反射结果Fig 1 Mechanical stimulation constraining thresholds of rats at the 10th and 20th day after surgery*P<0.05 vs sham group; △P<0.05 vs CCI group;#P<0.05 vs non-MC-OECs
2.3 背根节P2X3 mRNA表达
术后10、20d原位杂交检测大鼠背根神经节P2X3受体杂交阳性细胞百分比及平均吸光度表达情况。P2X3受体阳性细胞为黄色及褐色,以细胞核表达为主,细胞质和细胞膜少量表达,较细胞核淡。与sham组对比,CCI组P2X3受体杂交阳性细胞染色较深,细胞核呈深黄色及褐色,细胞质呈棕黄色,阳性细胞百分比及平均吸光度明显增高(P<0.05);与CCI组对比,non-MC-OECs组及MC-OECs组P2X3受体杂交阳性细胞染色变淡,阳性细胞百分比及平均细胞吸光度明显减低(P<0.05);而与non-MC-OECs组对比,MC-OECs组的杂交阳性细胞百分比及细胞平均吸光度降低(P<0.05)。与术后10d对比,术后20d non-MC-OECs组和MC-OECs组P2X3受体阳性细胞百分比及平均吸光度明显减低,且MC-OECs组要更低(图2、表1)。

图2 术后10d(A1~D1)和20d(A2~D2),原位杂交组织化学检测各组大鼠背根神经节P2X3受体杂交阳性表达结果。标尺=100μm。A、B、C、D:分别表示sham、CCI、non-MC-OECs及MC-OECs。图中箭头表示P2X3受体阳性表达细胞,主要表达于细胞核,细胞质及胞膜少量表达。P2X3受体阳性细胞染色从高到低依次为CCI、non-MC-OECs、MC-OECs及sham。术后20d比术后10d,MC-OECs阳性细胞染色较淡.
Fig 2 The 10th(A1-D1) and 20thdays (A2-D2) after surgery,in situ hybridization histochemistry was used to detect the expression of P2X3 receptor mRNA of rat dorsal root ganglion in each group.Bar=100μm.A,B,C,D representative sham,CCI,Non-MC-OECs and MC-OECs.Arrows in the picture indicated P2X3 receptor mRNA positive expression cells.P2X3 expressed strogly in the nucleus and weakly in cyto plasm and cell membrane.Number of P2X3 receptor positive cells was from hight to low followed by CCI,non-MC-OECs,MC-OECs and sham group.Compared with the 10thdays after surgery,MC-OECs positive cells stained lightly at the 20thdays.

表1 各组大鼠背根神经节 P2X3受体杂交阳性细胞百分比和平均吸光度Tab 1 The positive cells percentage and average absorbance of P2X3 receptor mRNA of the dorsal root ganglion in rats (n=10,
*P<0.05vssham;△P<0.05vsCCI;#P<0.05vsnon-MC-OECs
与sham组对比,其余3组P2X3受体阳性细胞百分比及平均吸光度明显增加(P<0.05);与CCI组对比,non-MC-OECs组和MC-OECs组阳性细胞百分比及平均吸光度明显减低(P<0.05);MC-OECs组与non-MC-OECs组对比P2X3受体的阳性细胞百分比及平均吸光度表达水平则更低(P<0.05)。
3 讨论
3.1 P2X3受体、嗅鞘细胞与疼痛的关系
周围神经损伤能引起机体部分功能障碍,感觉异常及疼痛,而神经损伤后修复能力有限[9]。神经损伤的治疗也成为难点,嗅鞘细胞能修复神经损伤,抑制胶质疤痕及空洞形成,促成轴突的再生,改变损伤微环境,释放多种营养因子[10]。Zhu等[11]切断大鼠坐骨神经15mm,利用壳聚糖导管接种嗅鞘细胞置入坐骨神经损伤区,发现嗅鞘细胞不仅能修复神经损伤而且能减轻神经病理性疼痛,恢复后肢部分运动及感觉功能。很多研究表明,P2X3受体与神经病理性痛有着重要的联系,随着神经损伤时间延长加重,其表达量相应增加[12]。Lin等[13]用血管内皮生长因子抑制剂,减少P2X3受体下调,缓解慢性病理性疼痛。
3.2 微囊化与非微囊化嗅鞘细胞移植减轻神经损伤痛的差异
微囊化能减少移植到宿主体内细胞免受免疫排斥反应,增加细胞存活率,延长移植到宿主体内细胞的存活时间,更好的发挥细胞修复神经损伤的作用[14]。Calafiore R等[15]证明用微囊化处理的细胞,具有较好的免疫隔离效果,生物相容性,减少炎症反应,且在体外培养9周,细胞存活率能达到80%以上。本实验通过微囊化及嗅鞘细胞的特性,建立SD大鼠坐骨神经慢性压迫性周围神经损伤动物模型,利用微囊化嗅鞘细胞与非微囊化嗅鞘细胞移植治疗周围神经损伤,并比较两者对周围神经损伤修复作用的影响。结果发现,相比模型组,非微囊化嗅鞘细胞移植组大鼠机械刺激缩足反射阈值增高,P2X3受体阳性细胞表达水平明显减低,修复部分周围神经损伤,缓解疼痛;而与非微囊化嗅鞘细胞组对比,微囊化嗅鞘细胞组大鼠右下肢活动更加有力,拉其下肢收缩时间较快,机械刺激缩足反射阈值明显增高,P2X3受体阳性细胞百分比及平均吸光度明显减低,更好的降低P2X3受体表达量,减低周围神经损伤,恢复大鼠部分功能,缓解疼痛。本实验结论表明:微囊化嗅鞘细胞移植比非微囊化嗅鞘细胞移植治疗周围神经损伤效果更好,明显降低P2X3受体表达水平,更好的缓解神经病理性疼痛。通过本实验研究能为日后周围神经损伤的治疗提供一些实验数据支持。
3.3 研究不足及展望
本次实验表明微囊化能更好地发挥嗅鞘细胞自身的生物学特性,减低神经损伤相关的嘌呤P2X3受体的表达水平,从而减轻疼痛。但也发现需要日后不断研究待解决的问题,如微囊化嗅鞘细胞最佳移植时间移植后的不良反应对机体有没有较大的影响?2种或者多种细胞一起移植效果是否会优于单种等都需日后不断深入研究探索。本实验可能为日后治疗周围神经损伤提供数据支撑,也希望不久将来逐步的深入完善,为更好的治疗神经损伤及神经病理性疼痛带来希望。
参 考 文 献
[1] L Chen, Liu Y W , K Yue,et al.Differential expression of ATP-gated P2X receptors in DRG between chronic neuropathic pain and visceralgia rat models[J].Purinergic Signal,2016,12(1):79-87.
[2] Wang S,Xu H,Zou L,et al.LncRNA uc.48+ is involved indiabetic neuropathic pain mediated by the P2X3 receptor in the dorsal root ganglia[J].Purinergic Signal,2016,12(1):139-148.
[3] H Peng, L Zou, J Xie,at el.lncRNA NONRATT021972 siRNA decreases diabetic neuropathic pain mediated by the P2X3 receptor in dorsal root ganglia[J].Mol Neurobiol,2017,54(1):511-523.
[4] Heidarizadi S, Abbasi N, Asadollahi K,et al.Effect of olfactory ensheathing cells (OECs) transplantation on functional recovery in acute phase of spinal contused rats[J].Khairollah Asadollahi,2017,4(1):30-36.
[5] Pellitteri R, Cova L, Zaccheo D,et al.Phenotypic modulation and neuroprotective effects of olfactory ensheathing cells:a promising tool for cell therapy[J].Stem Cell Rev Reports,2016,12(2):224-234.
[6] Chen Y,Yu C,Lv G,et al.Rapid large-scale culturing of microencapsulated hepatocytes:a promising approach for cell-based hepatic support[J].Transplant Proc,201446(5):1649-1657.
[7] HeY, Liu C, Xia X,et al.Conformal microcapsules encapsulating microcarrier-L02 cell complexes for treatment of acetaminophen-induced liver injury in rats[J].J Mater Chem B,2017,5:1962-1970.
[8] Yin J, Qiu S, Gao J,et al.FGF-2/PELA/BMP-2 microcapsule scaffold promotes osteogenic differentiation of rat periosteum-derived stem cells in vitro[J].J South Med Univer,2017,37(1):68-74.
[9] Seixas D,Foley P,Palace J,et al.Pain in multiple sclerosis:a systematic review of neuroimaging studies[J].Neuroimage Clin,2014,5(5):322-331.
[10] Khankan R R,Wanner I B,Phelps P E.Olfactory ensheathing cell-neurite alignment enhances neurite outgrowth in scar-like cultures[J].Exp Neurol, 2015,269(1):93-101.
[11] Zhu S, Ge J, Wang Y, et al,A synthetic oxygen carrier-olfactory ensheathing cell composition system for the promotion of sciatic nerve regeneration[J].Biomaterials,2014,35 :1450-1461.
[12] Wang W S,Tu W Z,Cheng R D,et al.Electroacupuncture and A-317491 depress the transmission of pain on primary afferent mediated by the P2X3 receptor in rats with chronic neuropathic pain states[J].J Neurosci Res,2014,92(12):1703-1713.
[13] Lin J,Li G,Den X,et al.VEGF and its receptor-2 involved in neuropathic pain transmission mediated by P2X-/-receptor of primary sensory neurons[J].Brain Res Bull,2010,83(5):284-291.
[14] Zhao H, Yang B, Liu Z,et al.Microencapsulation improves inhibitory effects of transplanted olfactory ensheathing cells on pain after sciatic nerve injury[J].Neural Regen Res,2015,10(8):1332-1337.
[15] Calafiore R,Basta G.Clinical application of microencapsulated islets:actual prospectives on progress and challenges[J].Adv Drug Deliv Rev,2014,67-68,84-92.

