131例神经系统疾病患者血清中抗BP180和抗BP230抗体的检测
王亚如 李洪军 许德志 王建文 周桂芝 杨宝琦
大疱性类天疱疮(Bullous Pemphigoid,BP)是最常见的自身免疫性表皮下大疱病,多见于60岁以上的老年人,其发病率与年龄呈正相关[1,2]。BP180和BP230是BP的两种抗原,已经明确抗BP180抗体具有致病性, NC16a为BP180外功能区的非胶原区,是致病性免疫球蛋白IgG自身抗体结合的主要靶位[3]。流行病学调查研究显示,30%~50%的BP患者伴随神经系统疾病(Neurological Diseases,ND),包括认知障碍、脑卒中、癫痫、帕金森病和多发性硬化症等,表明ND与BP之间存在一定关联[4]。虽然少量研究发现BP确诊后会增加ND的发病风险,但多数观点认为患有ND会增加BP发生的风险[5]。既往研究表明BP与神经退行性疾病之间具有关联性,BP抗原在中枢神经系统中有表达,因此有学者认为BP180和BP230可能为BP和ND的共同抗原[6,7]。为了验证这一假设,本研究在ND患者中检测BP自身抗体,旨在证实ND与BP发病之间的关系。
1 材料与方法
1.1 材料
1.1.1 病例资料 本研究获得山东省皮肤病医院医学伦理委员会的批准。收集ND住院患者以及体检中心体检者生化检查后剩余血清,-80℃冰箱保存备用。病例入选标准:经过相关检查,主治医师及以上职称医师确诊主要诊断为ND;对照入选标准:健康体检者,排除ND、免疫相关性疾病、肿瘤、大疱性皮肤病、湿疹、多形红斑、瘙痒病以及慢性荨麻疹等。
1.1.2 主要试剂 欧蒙医学实验诊断股份公司(EUROIMMUN,德国)提供的抗BP180NC16a、抗BP230抗体IgG酶联免疫吸附法(Enzyme-linked immunosorbent assay, ELISA)检测试剂盒;间接免疫荧光法(indirect immunofluorescence,IIF)抗表皮棘细胞桥粒抗体/抗表皮基底膜抗体检测试剂盒。
1.2 方法
1.2.1 ELISA方法检测抗BP180NC16a、抗BP230抗体 检测依照试剂盒说明书进行,评判依据为欧蒙推荐的正常范围上限(cut-off)20 RU/mL。认为浓度值≥20 RU/mL为阳性;浓度值<20 RU/mL为阴性。
1.2.2 IIF方法检测抗表皮基底膜带抗体 荧光显微镜下观察,如果抗表皮基底膜抗体阳性,则在表皮基底层与结缔组织间出现细线性荧光。
1.3 统计学方法 数据采用SPSS 22软件分析。采用独立样本t检验及卡方检验进行统计学分析。
2 结果
2.1 病例组和对照组基本情况 共收集泰安市中心医院、济南市第五人民医院、山东大学第二医院神经内科和神经外科131例住院ND患者血清,其中男78例,女53例,年龄为19~89岁,平均(61.18±13)岁;样本疾病类型为脑卒中109例(脑梗塞88例,脑出血19例,脑梗塞合并脑出血2例)、脑肿瘤15例、其他ND疾病7例包括癫痫、震颤、脑脓肿等。病程为0~7年,6例为首次发病,3例患者病程1年以下,1例患者病程3年,2例患者病程4年,3例患者病程分别为5年、6年、7年。收集到131例与之相匹配的正常对照血清,其中男78例,女53例,年龄为26~96岁,平均(58.98±12.82)岁,两组间年龄无统计学差异(t=1.383,P=0.168)。
2.2 病例组和对照组抗BP180NC16a和抗BP230抗体阳性率比较 131例ND组中抗BP180NC16a抗体阳性15例,阳性率为11.45%;抗BP230抗体阳性7例,阳性率为5.34%。抗BP180NC16a和抗BP230抗体均为阳性者共2例,1例患者为脑梗死,1例患者为脑梗死并发颅内动脉瘤。
131例对照组中抗BP180NC16a抗体阳性4例,阳性率为3.05%;抗BP230抗体阳性3例,阳性率为2.29%。采用Pearson卡方检验对两组数据分别进行统计学分析,两组间抗BP180NC16a抗体阳性率差异有统计学意义(χ2=6.866,P=0.009),但是两组间抗BP230抗体阳性率差异无统计学意义(χ2=1.66,P=0.20)。见图1。
2.3 ≥60岁病例组和对照组血清抗BP180NC16a、抗BP230抗体的阳性率比较 病例组和对照组中≥60岁者中,抗BP180NC16a抗体在ND组中阳性9例,对照组中阳性1例,阳性率为12.5%(9/72)、1.39%(1/72);抗BP230抗体在ND组中阳性6例,对照组中阳性1例,阳性率分别为8.33%(6/72)、1.39%(1/72)。采用Pearson卡方检验对两组数据分别进行统计学分析,两组间抗BP180NC16a抗体阳性率差异有统计学意义(χ2=6.878,P=0.009),抗BP230抗体阳性率差异无统计学意义(χ2=2.403,P=0.12)。见图2。
2.4 <60岁病例组和对照组血清抗BP180NC16a、抗BP230抗体的阳性率比较 <60岁受试者中,抗BP180NC16a抗体在ND组中阳性6例,对照组中阳性3例,阳性率分别为10.17%(6/59)、5.08%(3/59),采用连续性校正卡方检验,两组之间阳性率差异无统计学差异(χ2=0.481,P=0.49);抗BP230抗体在ND组中阳性1例,对照组中阳性2例,阳性率分别为1.69%(1/59)、3.39%(2/59),采用连续性校正卡方检验,两组之间阳性率差异无统计学差异(χ2=0,P=1)。见图3。
2.5 病例组中≥60岁和<60岁抗BP180NC16a、抗BP230抗体的阳性率比较 把病例组分为≥60岁和<60岁组, ≥60岁组中抗BP180NC16a抗体阳性9例,抗BP230抗体阳性6例,阳性率分别为12.5%(9/72)、8.33%(6/72);<60岁组中抗BP180NC16a抗体阳性6例,抗BP230抗体阳性1例,阳性率分别为10.17%(6/59)、1.69%(1/59)。将两组间进行卡方检验,P值分别为0.68、0.20,均>0.05,差异均无统计学意义。
2.6 IIF检测病例组和对照组血清中的抗基底膜带抗体的情况 ND组和对照组均未在表皮基底层与结缔组织间出现线性荧光,也无表皮细胞间荧光沉积,抗基底膜带抗体均为阴性。
图1 ND组与对照组抗体阳性分布图

图2 ≥60岁ND组与≥60岁对照组抗体阳性分布图
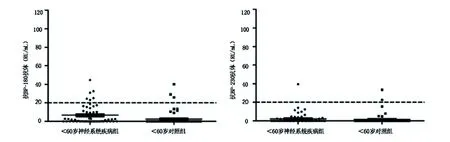
图3 <60岁ND组与<60岁对照组抗体阳性分布图
3 讨论
BP在中欧与北美以每10万居民每年新增0.25~4.28例,且每10年内以2~4倍的速度在增长,典型的皮损表现为明显瘙痒及紧张性大疱[8,9]。BP抗原位于表皮-真皮交界处,基底细胞通过半桥粒固定在基底膜带上建立表皮与真皮之间的连接。从分子水平看,BP的自身抗原为两种半桥粒成分:BP180(BPAg2或XVII胶原)和 BP230(BPAg1),二者均具有生物活性,既表达于皮肤中,也在脑组织中表达[6]。有假设提出BP自身抗原与中枢神经系统疾病相关,Seppänen等人在尸检样品检测中证实,BP180存在于人类脑神经元中,推测神经系统发生退行性变和炎症后BP180可以触发自身免疫启动,导致ND患者中抗BP抗体产生[7,10]。
BP诊断根据典型临床表现、病灶周围活检及直接免疫荧光检查(DIF)示线状IgG和C3在基底膜带沉积。3/4的BP患者在IIF检查中有针对表皮基底膜的循环IgG自身抗体在基底膜带沉积[11]。在过去的几年中, ELISA的高敏感性和特异性试验已用于BP患者抗体的检测,成为临床常规评估的一部分[12]。因此本研究用ELISA及IIF法检测ND患者血清样品是否有抗BP180、抗BP230、抗基底膜带抗体的存在。
BP自身抗原与中枢神经系统相关的假设同样被本研究结果所支持,抗BP180NC16a抗体在ND患者中的阳性率为11.45%,明显高于同年龄段的正常人。但是在本研究中,抗BP230抗体在ND患者与正常人中无明显差异。既往研究发现抗BP180抗体与临床BP的发生相关性更高,因为BP180胞外域NC16a区域识别IgG是BP的发病关键和早期改变,随后是抗BP230抗体的表位扩散[13]。本研究数据也表明,与ND相关的自身免疫反应抗体是抗BP180NC16a抗体,而不是抗BP230抗体。
多数研究都表明BP在老年人中具有较高的发病率[14],抗BP180抗体在非BP人群中的研究发现,抗体的发生率并不因性别或年龄变化而明显增加[15]。本研究中: ≥60岁ND组和<60岁ND组的抗BP180抗体阳性率分别为12.5%和10.17%,P=0.68;表明ND组不同年龄组间抗体水平无差异。但是抗BP180NC16a抗体在≥60岁的ND组与同年龄对照组中存在明显差异(p<0.01),而在<60岁的两组中,ND组抗BP180抗体阳性率虽高于对照组,但统计学无差异,所以我们认为,相对于年龄,ND对抗BP180抗体影响更大,但可能由于样本量较少或其他混合因素(如合并其他老年性疾病或服用药物等),导致其在<60岁的ND两组中不具有统计学差异。年龄与ND和BP的相关性仍然需要进一步研究。
临床常使用IIF作为检测BP抗基底膜带抗体的方法,其敏感性为75%~96%[17,18]。然而,结合临床特点、病理分析和IIF,才能更好的确诊BP。本研究中,使用IIF检测病例组和对照组血清抗基底膜带抗体,结果均为阴性。这一结果同Kokkonen等[19]的研究结果相同,他们报道了18例阿尔兹海默症患者血清中抗BP180抗体阳性但是抗基底膜带抗体结果全部为阴性。
本研究结果表明,ND患者的自身抗体谱与BP患者体内的抗体不一致,或许ND代表一个BP患者发病前的亚群。这些患者可能先有神经免疫反应,后来由于其他因素发展成为皮肤免疫反应。在本研究中ND组和对照组共19例检测者出现阳性ELISA结果,迄今为止没有1例有发展成BP的临床证据,将来是否发展为BP仍需要随访。
总之,本研究发现抗BP180NC16a抗体在神经系统疾病患者中有较高的阳性率,推测神经炎症或神经退行性疾病的发生发展可能导致血脑屏障功能减弱及脑免疫赦免的缺失,使存在于神经组织中的BP180及BP230亚型暴露,经由“分子间表位扩散”,使神经和皮肤的抗原之间发生“免疫交叉”反应,形成针对皮肤的抗原亚型,产生皮肤BP症状[10]。这可能与ND患者合并BP有关,也可解释为何BP患者常出现在神经系统损害之后。
本研究检测ND患者血清中BP抗体的情况,未区分ND疾病种类,也未对阳性患者抗体滴度的动态变化及后续结局进行监测,如有条件,应扩大各组样本后进行各疾病之间的比较统计,并对研究人群(特别是阳性样本)进行前瞻性研究和长期随访,有助于更好的了解BP发生发展过程以及与ND之间的联系。
参考文献
[1] Försti AK, Jokelainen J, Timonen M, et al. Increasing incidence of bullous pemphigoid in Northern Finland: a retrospective database study in Oulu University Hospital[J]. Br J Dermatol,2014,171(5):1223-1226.
[2] Joly P, Baricault S, Sparsa A, et al. Incidence and mortality of bullous pemphigoid in France[J]. J Invest Dermatol, 2012, 132(8): 1998-2004.
[3] Franzke CW, Bruckner P, Bruckner-Tuderman L. Collagenous transmembrane proteins: recent insights into biology and pathology[J]. J Biol Chem,2005,280(6):4005-4008.
[4] Recke A, Oei A, Hübner F, et al. Parkinson disease and multiple sclerosis are not associated with autoantibodies against structural proteins of the dermal-epidermal junction[J]. Br J Dermatol, 2016, 175(2): 407-409.
[5] Brick KE, Weaver CH, Savica R, et al. A population-based study of the association between bullous pemphigoid and neurologic disorders[J]. J Am Acad Dermatol,2014,71(6):1191-1197.
[6] Künzli K, Favre B, Chofflon M, et al. One gene but different proteins and diseases: the complexity of dystonin and bullous pemphigoid antigen 1[J]. Exp Dermatol, 2016, 25(1): 10-16.
[7] Seppänen A. Collagen XVII: a shared antigen in neurodermatological interactions?[J]. Clin Dev Immunol, 2013, 2013: 240570.
[8] Langan SM, Smeeth L, Hubbard R, et al. Bullous pemphigoid and pemphigus vulgaris--incidence and mortality in the UK: population based cohort study[J]. BMJ (Clinical research ed.), 2008, 337: a180.
[9] Bertram F, Bröcker EB, Zillikens D, et al. Prospective analysis of the incidence of autoimmune bullous disorders in Lower Franconia, Germany[J]. J Dtsch Dermatol Ges J Ger,2009,7(5):434-440.
[10] Langan SM, Groves RW, West J. The relationship between neurological disease and bullous pemphigoid: a population-based case-control study[J]. J Invest Dermatol,2011,131(3):631-636.
[11] Di ZG, Della TR, Zambruno G, et al. Bullous pemphigoid: from the clinic to the bench[J]. Clin Dermatol, 2012, 30(1): 3-16.
[12] Tampoia M, Giavarina D, Di GC, et al. Diagnostic accuracy of enzyme-linked immunosorbent assays (ELISA) to detect anti-skin autoantibodies in autoimmune blistering skin diseases: a systematic review and meta-analysis[J]. Autoimmun Rev,2012,12(2):121-126.
[13] Di ZG, Thomauszynski S, Calabresi V, et al. Demonstration of epitope-spreading phenomena in bullous pemphigoid: results of a prospective multicenter study[J]. J Invest Dermatol,2011,131(11):2271-2280.
[14] Bernard P, Vaillant L, Labeille B, et al. Incidence and distribution of subepidermal autoimmune bullous skin diseases in three French regions. Bullous diseases french study group[J]. Arch Dermatol,1995,131(1):48-52.
[15] Wieland CN, Comfere NI, Gibson LE, et al. Anti-bullous pemphigoid 180 and 230 antibodies in a sample of unaffected subjects[J]. Arch Dermatol,2010,146(1):21-25.
[16] Bastujigarin S, Joly P, Picarddahan C, et al. Drugs associated with bullous pemphigoid. A case-control study[J]. Arch Dermatol,1996,132(3):272-276.
[17] Ghohestani R, Kanitakis J, Nicolas JF, et al. Comparative sensitivity of indirect immunofluorescence to immunoblot assay for the detection of circulating antibodies to bullous pemphigoid antigens 1 and 2[J]. Br J Dermatol,1996,135(1):74-79.
[18] Chan YC, Sun YJ, Ng PP, et al. Comparison of immunofluorescence microscopy, immunoblotting and enzyme-linked immunosorbent assay methods in the laboratory diagnosis of bullous pemphigoid[J]. Clin Exp Dermatol,2003,28(6):651-656.
[19] Kokkonen N, Herukka SK, Huilaja L, et al. Increased levels of the bullous pemphigoid BP180 autoantibody are associated with more severe dementia in alzheimer’s disease[J]. J Invest Dermatol,2017,137(1):71-76.

