PET/CT SUVmax在肺孤立性磨玻璃结节诊断中的价值*
骆柘璜,金爱芳,彭瑛,廖凤翔,陈小华
(江西省人民医院,南昌 330006)
随着CT的应用普及,越来越多的肺磨玻璃结节(ground glass opacity nodule,GGN)被发现。 根据GGN的密度,GGN分为纯GGN(pure GGN,pGGN)和混合性 GGN(mixed GGN,mGGN),无论是pGGN还是mGGN,都是非特异性的CT表现[1]。GGN有可能是肺局灶性纤维化、炎症,或不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH), 也可能是肺癌早期[2,3]。PET/CT已广泛应用于肺结节的鉴别诊断[4,5]和肺癌术前评估。但是对表现为GGN的肺癌,PET/CT的价值还存在争议[6]。
2011年国际肺癌研究协会(IASLC),美国胸科学会 (ATS)及欧洲呼吸学会 (ERS)在 《J Thorac Oncol》上公布的了肺腺癌的国际多学科分类标准,根据该标准肺腺癌可分为癌前病变AAH,原位腺癌 (adenocarcinoma in situ,AIS), 微浸润性腺癌(minimally invasive adenocarcinoma,MIA) 和浸润性腺癌。表现为GGN的肺癌大多数为腺癌。在表现为GGN的各类腺癌中以及他们与良性GGN间,PET/CT放射性最大标准化摄取值(maximum standardized uptake values,SUVmax)是否存在差异目前研究还不多。本文对照病理结果,对表现为最大径≤3.0cm孤立性肺GGN的良性病变及不同类型的腺癌SUVmax进行分析,以明确SUVmax是否能鉴别GGN的性质。
1 材料和方法
1.1 临床资料 从2011年1月-2014年12月,共57例确诊GGNs患者纳入本研究,其中55例病理确诊,2例抗炎3个月后完全消失。PET/CT检查后1个月内手术者46例,随访3个月到2年手术者9例;手术55例病理结果:肺部恶性病变44例(AIS 5,MIA 9,IA 30),良性 11 例(AAH 2,结核 2,炎性病变5,局灶性纤维化2例)。
1.2 PET/CT检查 患者禁食6h以上,血糖控制在10mmol/L以下,腕静脉注射18F-FDG后(剂量0.15mCi/kg),避光静卧休息 40-60min,行 PET/CT检查。上床后先行CT扫描(120mA、150kV、层厚3.8mm),扫描范围从颅顶至股骨上1/3;再行PET 3D模式显像(6-8 床位、2min/床位),范围同 CT,图像迭代法重建,并基于CT对图像进行衰减校正;CT及PET校正后的图像传输到GE AW4.6工作站上进行自动融合及相关后处理。PET/CT机型,GE Discovry STE。18F-FDG由本中心合成(GE MiniTrace回旋加速器,Tracer lab FXFN或 Fast lab2放射性药物自动化合成器),放化纯度>95%。1.3统计学分析 全部数据采用统计软件SPSS 17.0 统计分析,患者年龄和 SUVmax 以表示,性别构成百分比表示,分别用t和秩和检验,P<0.05认为差异有统计学意义。
2 结果
2.1 良、恶性GGNs患者的性别、年龄及病变最大径 良性GGNs患者女10例,男3例,恶性GGNs患者女25例,男19例,良、恶性GGNs患者年龄分别为59.2±13.9和60.8±10.7岁,两者性别、年龄差别无明显统计学意义(P>0.05);良、恶性 GGNs最大直径分别为1.50±0.60cm和1.80±0.68cm,两者差异无统计学意义(P>0.05)。
2.2 GGNs分类与病理、临床诊断对应关系(表1)CT上表现为pGGN者15例,表现为mGGN者42例。病理和临诊断:炎性病变7例,结核(TB)2例,局灶性纤维化(FF)2例,AAH 2例,AIS 5例,MIA 9例,IA 30例。
2.3 GGNs分类和SUVmax的关系 15例pGGN者和42例mGGN者,两者SUVmax分别为0.78±0.22(最大值和最小值分别 1.3和0.5)和 1.23±0.52(最大值和最小值3.0和0.5),mGGNs高于pGGNs,两者差异有统计学意义(P<0.01);pGGNs中良性9例(包括 AAH),恶性 pGGNs6例,两者 SUVmax分别为0.90±0.28和0.70±0.12,两者差异无统计学意义(P>0.05);mGGN中良性 6例, 恶性 36例, 两者SUVmax分别为 1.42±0.97 和 1.19±0.42,良性高于恶性,但差异无统计学意义(P>0.05).但若把mGGN分为良性组(A),AIS 与 MIA 组(B),IA 27 例(C),则A、B 和 C 3 组 SUVmax分别为 1.42±0.97,0.84±027和 1.31±0.40,A 组 SUVmax高于 B、C 组,但差异无统计学意义(P>0.05),C组高于B组,两者差异有明显统计学意义(P<0.01)。
2.4 mGGNs(AAH,AIS,MIA,IA)的 SUVmax 与病变实性部分最大径的相关性 良性mGGNs因病例较少,仅6例,还含1例AAH,SUVmax与实性部分最大径未做相关性分析。通过直线回归分析,腺癌(含癌前病变AAH)的SUVmax与mGGNs的实性部分最大径有相关性,相关系数r=0.987(95%置信区间 0.841,1.133),P<0.01。
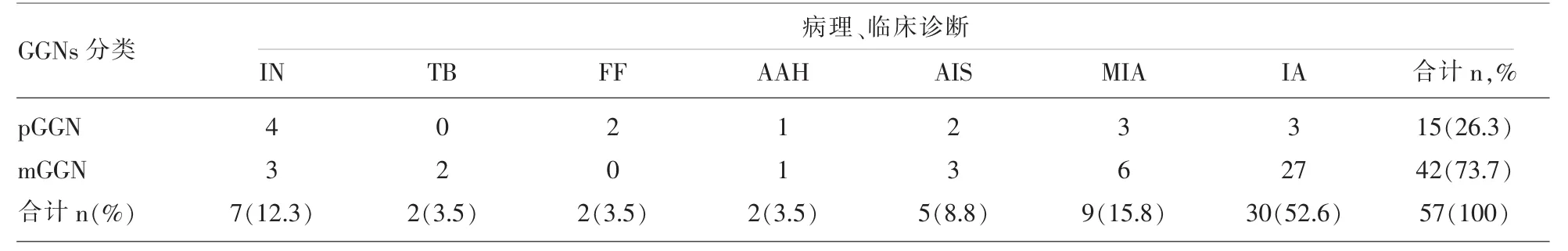
表1 GGNs分类与病理、临床诊断间的关系

表2 pGGNs和mGGNs的SUVmax比较
2.5 区别IA浸润型腺癌SUVmax与AHH,AIS和MIA受试者特征性曲线分析 ROC曲线下面积(AUC)为 0.848(95%置信区间 0.716-0.980),P<0.01,以约登指数最大值确定的SUVmax界值为1.25,敏感度为51.9.%,特异性为100.0%。
3 讨论
GGNs是多种肺部疾病的影像表现,尽管许多学者对肺部GGNs的影像表现作了广泛的研究[1-6],但孤立性GGN的影像定性鉴别依然是影像诊断学的难点。SUV值已广泛应用于肿瘤和功能代谢异常的一项半定量指标[7,8]。PET/CT通常以SUVmax大于2.5作为判别良、恶性病变的界值,但以此对肺部孤立性结节的定性尚存在较大的误判[4],而对肺部GGNs的定性鉴别而言,这一界值完全不合适。本研究收入的孤立性GGNs良性13例,恶性 44 例,仅 2 例(IA 1,TB 1)SUVmax超过 2.5。
肺部孤立性GGN根据CT的密度可分为pGGN和mGGN。无论是pGGN还是mGGN,影像表现都是非特异性的,是多种疾病的共同表现。几乎所有的pGGNs都表现为低放射性摄取,Sim等[9]报告的一组手术的pGGNs,36例术前进行了PET/CT评估,无一例有明显的放射性摄取,本研究中的15例pGGNs的放射性摄取均等同肺本底摄取,良、恶性pGGNs的SUVmax差异也没有明显的统计学意义,这也正是pGGNs Fleischner学会不推荐应用PET/CT检查的原因[10]。pGGNs的SUVmax低于mGGNs,差异有显著统计学意义。
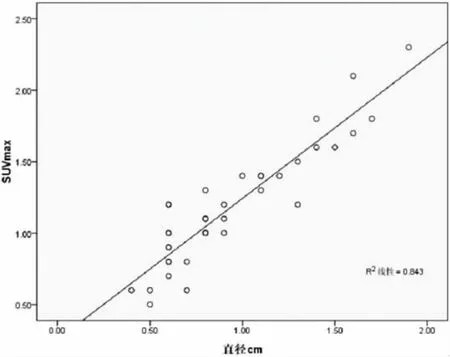
图1 mGGNs腺癌SUVmax与实性部分最大径的相关性散点图和拟合曲线
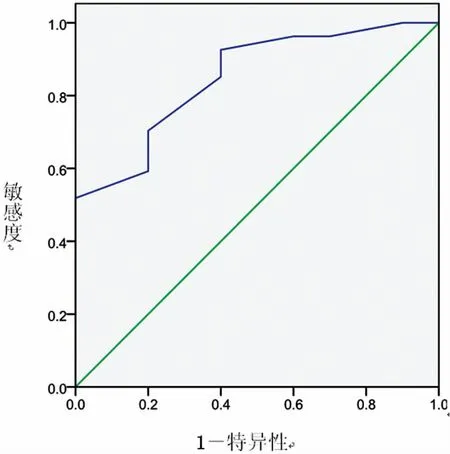
图2 SUVmax区别IA浸润型腺癌与AHH,AIS或MIA ROC曲线
本研究中mGGNs组的良性病变SUVmax平均值高于恶性组;把恶性组分为AIS+MIA组及IA组后,良性组SUVmax平均值同样高于这两组;但差异均无统计学意义。这个结果有待于进一步研究,因为本研究良性mGGNs中,病因不同,病例较少,特别是2例结核,FDG摄取均偏高,分别为2.2和3.0,以前的报道就有结核结节FDG呈高摄取[11],我们也发现活动性实性TB结核结节有些可呈显著的高FDG摄取,因此对不同的病因导致的良性mGGNs进行分别研究,可能会获得更准确的结论。之所以把AIS和MIA放在一组进行比较,是因为就生存而言,大量的研究表明,AIS与MIA两者间的差异临床上没有明显的统计学意义[12]。
在mGGNs中IA组SUVmax平均值高于AIS+MIA组,差异有显著统计学意义。从AAH,AIS,MIA到IA是周围型肺腺癌的不同发展阶段,病理学仅仅能发生细胞和组织形态的改变,而分子影像学则进一步反应了细胞、组织代谢改变的信息,IA代谢活性高于AAH、AIS、MIA,表明IA中的细胞有更活跃的增殖能力;本研究通过对表现为mGGNs的腺癌 (包括AAH)SUVmax进行R0C曲线分析,如以约登指数最大值对应SUVmax值1.25作为判别IA的界值,敏感度特异性分别为51.9%,100.0%,特异性较好,敏感度较低。
Kim等[6]的研究认为,GGNs的直径与SUVmax成正相关,而磨玻璃成份在GGNs中的百分比则与SUVmax成负相关。本研究显示,在腺癌mGGNs中,SUVmax与病变实性部分的最长径成正相关,可能因为mGGNs中实性部分细胞具有更活跃的代谢活性,另外病理上实性部分细胞密度更大也可能是代谢增高的原因。结合上述SUVmax高低有助于区别IA与AAH,AIS或MIA,表现mGGN的腺癌,SUVmax和实性成份的比例有可能作为预测复发与转移的因子,这与以往的报道一致[13]。
参考文献
[1]Lee SM,Park CM,Goo JM,et al.Invasive pulmonary adenocarcinomas versus preinvasive lesions appearing as ground-glass nodules:differentiation by using CT features[J].Radiology,2013,268(1):265-73.
[2]Takashima S,Maruyama Y,Hasegawa M,et al.CT findings and progression ofsmall peripheral lung neoplasms having a replacement growth pattern[J].AJR Am J Roentgenol,2003,180(3):817-26.
[3]Kim Ha Young,Shim Young Mog,Lee Kyung Soo,et al.Persistent pulmonary nodular ground-glass opacity at thin-section CT:histopathologic comparisons[J].Radiology,2007,245(1):267-75.
[4]李文婵,姚稚明,陈聪霞,等.18F-FDG PET/CT综合指标鉴别诊断孤立性肺结节良恶性 [J].中国医学影像技术,2014,30(7):1037-40.
[5]陈虞梅,童林军,施一平,等.孤立性肺结节18FDG PET/CT诊断的数学模型建立 [J].中国医学计算机成像杂志,2012,18:269-272.
[6]Kim TJ,Park CM,Goo JM,et al.Is there a role for FDG PET in the management of lung cancer manifesting predominantly as groundglass opacity?[J].AJR Am J Roentgenol,2012,198(1):83-88.
[7]廖凤翔,吴梨兵,骆柘璜,等.18F-FDG PET/CT对鼻咽癌疗效评估的价值分析[J].江西医药,2015,50(12):1351-1354.
[8]何敏,朱晓钢,汤蕙,等.PET/CT证实阿尔茨海默氏病1例[J].江西医药,2012,47(7):597-598.
[9]Sim HJ,ChoiSH,Chae EJ,etal.Surgicalmanagementof pulmonary adenocarcinoma presenting as a pure ground-glass nodule[J].Eur J Cardiothorac Surg,2014,46(4):632-636.
[10]Naidich DP,Bankier AA,Schaefer-Prokop CM,et al.Recommendations for the Management of Subsolid Pulmonary Nodules Detected at CT:A Statement from the Fleischner Society[J].Radiology,2013,266:304-317.
[11]Behera M,Owonikoko TK,Gal AA,et al.Lung Adenocarcinoma Staging Using the 2011 IASLC/ATS/ERS Classification:A Pooled Analysis of Adenocarcinoma In Situ and Minimally Invasive Adenocar-cinoma[J].Clinic Lung Cancer,17(5):e57-e64.
[12]张正福,李兰涛,王海燕,等.HRCT与PET/CT相结合对孤立性肺癌结节和结核球的鉴别诊断价值[J].临床放射学杂志,2013,32(12):1727-9.
[13]Uehara Hirofumi,Tsutani Yasuhiro,Okumura Sakae,et al.Prognostic role of positron emission tomography and highresolution computed tomography in clinicalstage IA lung adenocarcinoma[J].Ann Thorac Surg,2013,96(6):1958-65.

