肝脏和脾脏VTQ值对慢性乙型肝炎患者肝纤维化的诊断效能研究
胡小娟,刘锦萍,吕志红
慢性乙型肝炎患者肝内病毒不断复制引发的免疫反应可致肝细胞不断受损,肝脏的自我修复功能会引起肝脏结缔组织增生,导致肝纤维化[1,2]。若肝纤维化未得到有效的抑制,则会发展至不可逆的肝硬化[3],严重时将出现多器官功能衰竭和死亡[4,5]。常规超声技术具有较大的局限性,受气体影响较大,声触诊组织量化技术(VTQ)可对病变组织进行定量分析,弥补常规超声技术的不足。本文旨在探讨肝脏和脾脏VTQ对慢性乙型肝炎患者肝纤维化的诊断效果。
1 资料与方法
1.1 临床资料 2014年5月~2016年5月于我院接受治疗的慢性乙型肝炎患者194例,男性125例,女性69例;年龄17~65岁,平均年龄为(41.7±12.4)岁。诊断符合慢性乙型肝炎防治指南的标准,排除恶性肿瘤、合并有其他非嗜肝病毒或嗜肝病毒感染者,排除妊娠或长期大量饮酒者。所有患者签署知情同意书,本研究经我院医学伦理委员会批准。
1.2 肝组织穿刺活检 选用16G自动活检枪在超声引导下行肝组织穿刺活检,将取得的肝组织置于10%福尔马林溶液中固定,石蜡包埋、切片,常规行苏木精-伊红和网织纤维染色,在光学显微镜下观察。依据Scheuer评分系统[6]对肝纤维化程度进行分期。
1.3 VTQ值检测 使用配有超声弹性成像的德国西门子ACUSON S2000彩色多普勒超声诊断仪,采用4C1探头,频率为4 MHz。患者采取仰卧位,右臂上举,取样框内无气体或血管干扰。选用肝脏和脾脏内回声较粗的部位作为感兴趣区,其面积为1.0×0.5 cm。将探头放置于上述感兴趣区内,嘱患者屏气,按下update键,在患者的一次屏气时测量3次VTQ值,每例患者共探测3次,取平均值。
1.4 统计学处理 应用SPSS 13.0统计学软件,计量资料以±s表示,采用t检验,计数资料采用卡方检验,以P<0.05为差异有统计学意义。通过构建ROC曲线获得不同VTQ值诊断肝纤维化的曲线下面积(area under the ROC curve,AUC)及其诊断效能。
2 结果
2.1 不同肝纤维化分期患者肝脏和脾脏VTQ水平比较 随着肝纤维化分期加重,肝脏和脾脏VTQ水平逐渐升高(P<0.05,表1)。
2.2 肝脏和脾脏VTQ诊断不同肝纤维化分期的效能比较将肝纤维化>S2期定义为显著肝纤维化,发现检测肝脏VTQ诊断显著肝纤维化的效能较高,显著优于脾脏VTQ检测(P<0.05),但研究提示检测脾脏VTQ水平,也具有一定的诊断价值。
表1 不同肝纤维化分期患者脾脏和肝脏VTQ水平(±s)比较

表1 不同肝纤维化分期患者脾脏和肝脏VTQ水平(±s)比较
与 0 期比,①P<0.05;与 1 期比,②P<0.05;与 2 期比,③P<0.05;与3期比,④P<0.05
?
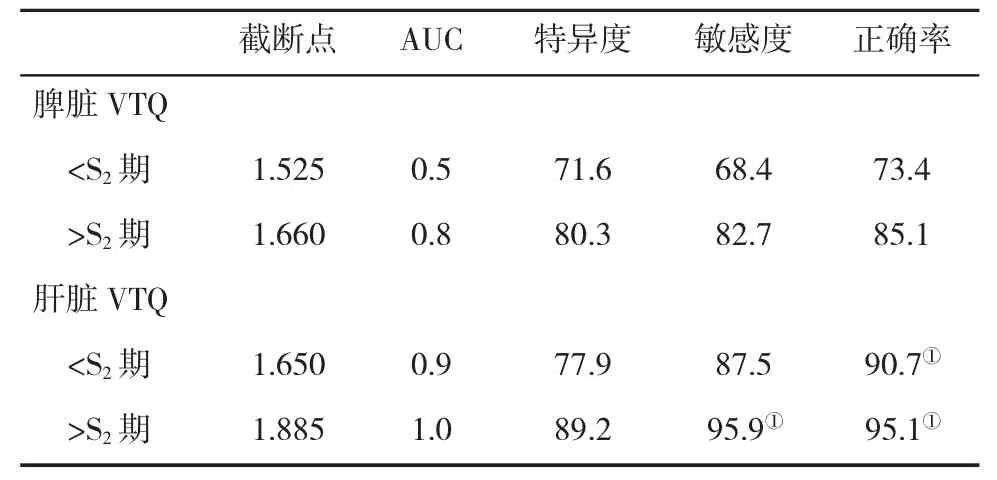
表2 肝脏与脾脏VTQ诊断不同肝纤维化分期的效能(%)比较
3 讨论
乙型肝炎病毒感染能够对肝脏进行长期、反复的免疫损伤,肝脏自身虽具有一定的修复功能以修复损伤,但在修复过程中肝脏纤维组织会增生、沉积,导致慢性乙型肝炎患者肝脏逐渐纤维化[7]。在肝纤维化得不到及时、有效的遏制,纤维化逐渐发展,最终会导致肝硬化。肝硬化可引起门静脉高压,引起一系列并发症,严重者甚至会出现器官功能衰竭、肝癌和死亡。肝纤维化是可逆的,而肝硬化是不可逆的[8,9]。因此,寻找一种技术能够及时检测出患者肝纤维化及其分期,避免肝硬化的发生具有十分重要的意义。目前,肝组织穿刺活检能够诊断患者肝纤维化分期,但其具有有创性,可能会造成腹腔内出血、脏器损伤、疼痛等,其可重复性更差。检测患者肝脏和脾脏VTQ值可以避免上述不便。本文旨在探讨肝脏和脾脏VTQ值对慢性乙型肝炎患者肝纤维化的诊断效能。
有研究显示[10,11],脾脏VTQ值能够检测出食管静脉曲张及门静脉高压,因为检测脾脏VTQ值对慢性乙型肝炎患者肝纤维化也有一定的诊断意义。本研究显示,不同肝纤维化分期患者VTQ值不同,并随肝纤维化分期的增高而增大。将肝纤维化>S2期定义为显著肝纤维化,发现检测肝脏VTQ诊断显著肝纤维化的效能较高,显著优于脾脏VTQ检测(P<0.05),但研究提示检测脾脏VTQ水平,也具有一定的诊断价值,意味着在特殊情况下,可以通过检测脾脏VTQ而对肝纤维化作出判断。慢性乙型肝炎患者肝脏发生纤维化时,血液循环受到破坏,肝脏门静脉内血液回流受到阻碍,使得脾静脉内血液回流也受到阻碍[12,13],由此导致患者脾髓淤血、组织增生,使脾脏肿大,最终使脾脏的组织弹性发生改变,脾脏VTQ值能反映脾脏的组织弹性情况。本研究未设立健康志愿者进行脾脏VTQ水平检测,因此,存在一定的缺陷,将来需再增加健康志愿者进行研究。
综上所述,检测脾脏VTQ值能够反映慢性乙型肝炎患者肝纤维化情况,在特殊情况下进行脾脏VTQ水平检测,对于肝纤维化诊断和防治肝硬化具有十分重要的意义。
【参考文献】
[1]Qingwei Z,Mitsuo T.Plasma amino acid profiles applied for diagnosis of advanced liver fibrosis in patients with chronic hepatitis C infection.Hepatol Res,2005,34(3):170-177.
[2]Paul C,Victor L.Evaluating the accuracy and increasing the reliable diagnosis rate of blood tests for liver fibrosis in chronic hepatitis C.Liver Int,2008,28(10):1352-1362.
[3]Farci P,Wollenberg K,Diaz G,et al.Profibrogenic chemokines and viral evolution predict rapid progression of hepatitis C to cirrhosis. Proc Natl Acad Sci U S A,2012,109 (36):14562-14567.
[4]MamiK,MitsuoS.Realtimeelastographyfornoninvasive diagnosis of liver fibrosis.J Hepatobiliarypancreat Surg,2009,16(4):463-467.
[5]Rauscher I,Eiber M,Ganter C,et al.Evaluation of T1ρ as a potential MR biomarker for liver cirrhosis:Comparison of healthy control subjects and patients with liver cirrhosis.Eur J Radiol,2014,83(6):900-904.
[6]沈文,林森浩,丁红,等.声触诊组织量化技术无创评价肝纤维化的临床研究.中华临床医师杂志(电子版),2012,6(3):593-596.
[7]杨玥,张振华,李旭,等.核苷(酸)类似物单药和联合治疗慢性慢性乙型肝炎疗效分析.实用肝脏病杂志,2012,15(2):169-171.
[8]Glińska-Suchocka K,Ortowska A.Suitability of using serum hialuronic acid concentrations in the diagnosis of canine liver fibrosis.Polish J Veter Sci,2015,18(4):873-878.
[9]Sheron N,Moore M,Ansett S,et al.Developing a'traffic light'test with potential for rational early diagnosis of liver fibrosis and cirrhosisin thecommunity.BrJGen Pract,2012,62(602):e616-624.
[10]Giada S.Serum biomarkers for the non-invasive diagnosis of liver fibrosis:the importance of being validated.Clin Chem Lab Med,2012,50(4):595-597.
[11]Lu Y,Liu J.Peroxiredoxin 2:a potential biomarker for early diagnosis of Hepatitis B Virus related liver fibrosis identified by proteomic analysis ofthe plasma.BMC Gastroenterol,2010,10(1):67-73.
[12]陆伦根.肝纤维化基础和临床研究热点问题.实用肝脏病杂志,2016,19(1):1-3.
[13]徐晓鸾,孟繁坤,孙丽娟,等.肝脏瞬时弹性成像和门静脉血流动力学指标检测对慢性慢性乙型肝炎患者肝纤维化的诊断意义.实用肝脏病杂志,2016,19(4):432-435.

