蛇床子素抑制佛波酯诱导RBL-2H3大鼠嗜碱性粒细胞脱颗粒
张秋秋,雷铁池
(武汉大学人民医院,湖北 武汉 430060)
临床观察发现用含有中药蛇床子(Fructus cnidii)的内服或外用制剂治疗过敏性皮肤病有效[1]。近年来也有实验研究显示这一伞形科植物可能因含有大量的香豆素类化合物蛇床子素(Osthole,7-甲氧基-8-异戊烯基-香豆素)发挥止痒和抗过敏活性[2-3],但确切的分子机制仍不清楚。本研究用组织化学和透射电镜技术观察了蛇床子素对佛波脂(Phorbol-12-myristate-13-acetate,PMA)诱导大鼠嗜碱性白血病RBL-2H3细胞脱颗粒的影响,进一步探讨其抗过敏机制。
1 材料与方法
1.1 材料 蛇床子素购自中国科学院北京药物所;RBL-2H3细胞、甲苯胺蓝染料购自武汉市百奥斯公司;CCK-8试剂盒购自南京恩晶生物科技有限公司;DMEM高糖培养基购自Gibco公司;胎牛血清(FBS)、青-链霉素购自碧云天生物技术研究所;PMA(货号:P8139)、4-硝基苯基-N-乙酰-β-D-氨基葡萄糖苷(PNAG,货号:N9376)、Triton裂解液均购自美国Sigma公司;其他试剂均为市售化学分析纯。
1.2 方法
1.2.1 细胞培养 用含10%FBS的DMEM培养基,于37℃,5%CO2,饱和湿度培养箱中对RBL-2H3细胞进行传代培养。当细胞长满约80%培养瓶底面积时可进行传代,传代比例为1∶3,2~3 d传代1次。
1.2.2 CCK-8法检测细胞存活率 取指数生长期细胞,每孔接种约104个细胞,于37℃,5%CO2培养24 h,待细胞贴壁后弃去培养液。用新鲜配制含有不同浓度 PMA(0.125、0.25、0.5、1、2 μmol/L)和蛇床子素(1、10、50、100、200、400 μmol/L)培养基换液。置细胞培养板于培养箱内继续培养24 h。同时设定空白对照。最后,每孔加入CCK-8溶液10 μL,继续培养2~4 h,在酶标仪450 nm处测定吸光值。细胞存活率(%)=(加药细胞吸光值/对照细胞吸光值)×100%。
1.2.3 甲苯胺蓝染色法测定脱颗粒率 将细胞接种至预置有盖玻片的6孔培养板制备细胞爬片。过夜,待细胞贴壁后弃去培养液,用新鲜配制含有PMA和蛇床子素培养基换液,继续培养1 h。弃上清,盖玻片用台氏液(135 mmol/L NaCl,5 mmol/L KCl,5.6 mmol/L 葡 萄 糖 ,1.8 mmol/L CaCl2,1 mmol/L MgCl2,20 mmol/L HEPES,0.1%BSA)2~3 次。每孔加入500 μL甲苯胺蓝染液,染色3 min,PBS洗3遍。待玻片干燥后,用中性树胶封片,于Olympus正置显微镜油镜下观察细胞内颗粒并拍照。100个细胞中胞质脱颗粒细胞数被作为脱颗粒率。
1.2.4 β-氨基己糖苷酶(β-hexosaminidase)活性测定 收集药物处理细胞制备新鲜细胞裂解物。于96孔板每孔加含1 mmol/L PNAG酶底物的枸橼酸缓冲液(pH=4.5)50 βL,并与细胞裂解物 50 βL 混匀,37℃孵育1.5 h。加入碱溶液终止反应。由于该酶随着细胞脱颗粒被释放,且能使底物PNAG分解产生黄色的p-硝基酚,酶活性与脱颗粒程度呈正相关。用多功能酶标仪(美国Perkin Elmer公司)检测405 nm吸光值。用以下公式计算β-氨基己糖苷酶释放率:β-氨基己糖苷酶释放率(%)=上清液的吸光值/(上清液的吸光值+细胞裂解液的吸光值)×100%。
1.2.5 透射电镜技术观察细胞脱颗粒 取对数期生长的RBL-2H3细胞接种于25 cm2培养瓶,培养24 h,待细胞贴壁且长满瓶底后弃去培养液。设阴性对照组(等体积的台式液)、阳性对照组(0.5 μmol/L PMA)和实验组(50 μmol/L 蛇床子素+PMA),37℃共孵育1 h,弃上清,台式液洗2~3遍,用柔软细胞划子轻轻刮起细胞呈细胞悬液,置于1.5 mL尖头EP管中,1 000转/min离心5 min。2.5%戊二醛溶液固定细胞,环氧树脂包埋制备超薄切片,经枸橼酸铅及醋酸双氧铀电子染色后,用Tecnai G2 S-Twin F20透射电镜显微镜(美国FEI公司)观察细胞超微结构变化并数码相机摄片。
1.3 统计学方法 用SPSS21.0统计软件进行分析,数据以均值±标准差(±s)表示。多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 PMA诱导RBL-2H3细胞脱颗粒 CCK-8结果显示用小于1 μmol/L PMA处理培养细胞对细胞存活率无明显影响,见表1。随后,笔者观察了0.5 μmol/L PMA对细胞脱颗粒诱导。直接油镜下观察细胞形态和甲苯胺蓝染色发现未处理组RBL-2H3细胞呈梭形,0.5 μmol/L PMA可导致细胞明显变圆;胞质内嗜碱性染色(蓝色)的颗粒物PMA处理组较对照组明显减少,见图1。透射电镜证实未处理组胞质内充满电子致密的圆形粗大的颗粒;经PMA处理后,圆形颗粒减少或消失,且能在细胞膜表面观察到较多囊泡被胞吐,见图1,提示PMA能有效诱导RBL-2H3细胞脱颗粒。
2.2 蛇床子素抑制PMA诱导RBL-2H3细胞脱颗粒 CCK-8结果表明 1~50 μmol/L蛇床子素对RBL-2H3 细胞存活率没有影响,100~400 μmol/L 蛇床子素呈现一定的细胞毒性。在无细胞毒性的蛇床子素 3 个浓度(1,10,50 μmol/L) 联合 0.5 μmol/L PMA处理细胞,测定了RBL-2H3细胞的脱颗粒率和β-氨基己糖苷酶释放率。结果显示蛇床子素能剂量依赖地抑制脱颗粒,见表1。甲苯胺蓝染色后观察到阳性对照组部分细胞呈空泡状,细胞质淡染,细胞周围可见大量被释放的蓝紫色颗粒;经蛇床子素处理后,RBL-2H3细胞形态逐渐清晰、完整,细胞内可见大量蓝紫色颗粒。电镜下观察到阴性对照细胞形态完整,细胞质内可见大量致密颗粒和一些稍扩张的内质网,PMA刺激后可见细胞质内颗粒明显减少及大量空泡状结构,经蛇床子素处理后细胞形态无明显改变,大部分颗粒尚且存在,见图2。结果与β-氨基己糖苷酶释放率结果一致,提示蛇床子素能剂量依赖地抑制PMA诱导RBL-2H3细胞脱颗粒。
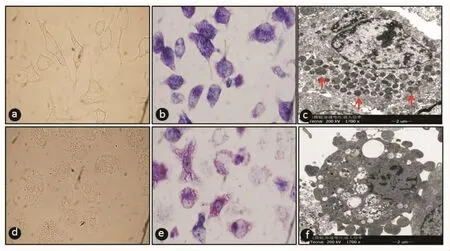
图1 PMA诱导RBL-2H3细胞脱颗粒
表1 蛇床子素与PMA单独或联合处理RBL-2H3细胞对细胞存活率、脱颗粒率和β-氨基己糖苷酶释放率的影响 (%,±s)
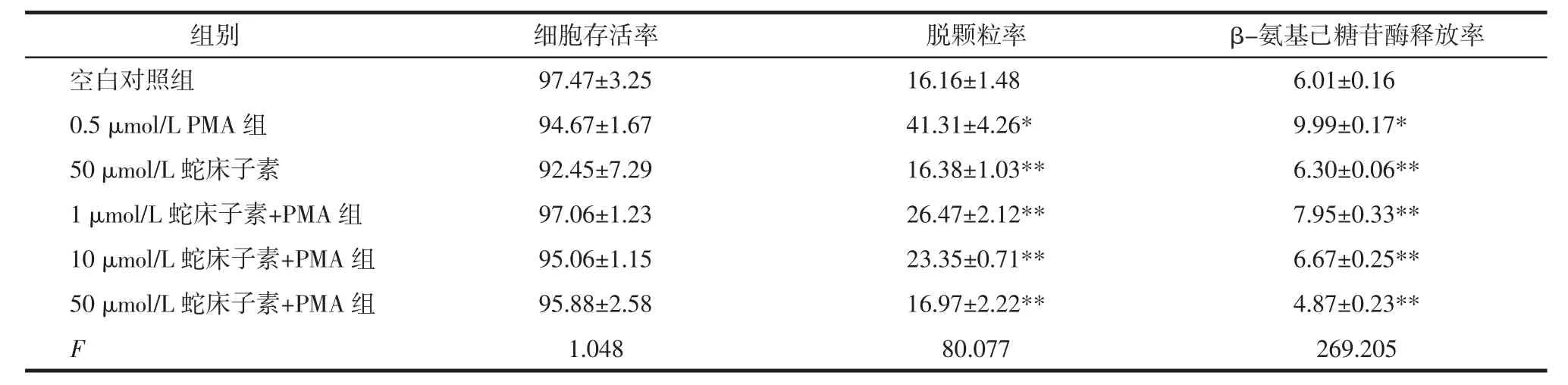
表1 蛇床子素与PMA单独或联合处理RBL-2H3细胞对细胞存活率、脱颗粒率和β-氨基己糖苷酶释放率的影响 (%,±s)
注:与空白对照组比较,*P<0.01;与0.5 uM PMA组比较,**P<0.01。
组别 细胞存活率 脱颗粒率 β-氨基己糖苷酶释放率空白对照组 97.47±3.25 16.16±1.48 6.01±0.16 0.5 μmol/L PMA 组 94.67±1.67 41.31±4.26* 9.99±0.17*50 μmol/L 蛇床子素 92.45±7.29 16.38±1.03** 6.30±0.06**1 μmol/L 蛇床子素+PMA 组 97.06±1.23 26.47±2.12** 7.95±0.33**10 μmol/L 蛇床子素+PMA 组 95.06±1.15 23.35±0.71** 6.67±0.25**50 μmol/L 蛇床子素+PMA 组 95.88±2.58 16.97±2.22** 4.87±0.23**F 1.048 80.077 269.205
3 讨论
肥大细胞是分布于人体皮肤和黏膜下结缔组织内的一种固有免疫细胞,而嗜碱性粒细胞则分布在外周血液经化学趋化被招募至变态反应部位。这两种细胞的表面均表达高亲和力FcεRⅠ受体和胞质中含有嗜碱性颗粒,被认为是参与Ⅰ型超敏反应的重要效应细胞[4]。然而,直接从人皮肤或黏膜组织中分离肥大细胞十分困难。来自大鼠嗜碱性白血病细胞(Rat basophilic leukemia cell)RBL-2H3细胞株仍保留许多肥大细胞的生物学特征且能体外传代培养,已被广泛用作研究肥大细胞脱颗粒的替代细胞模型[5]。用二硝基苯酚交联牛血清白蛋白(DNPBSA)作为抗原,与预先结合在肥大细胞表面的抗DNP-IgE(anti-DNP IgE)单克隆抗体结合是经IgE-介导刺激肥大细胞脱颗粒的经典方法[6]。也有学者用化合物48/80(Compound 48/80)直接刺激非IgE-介导的肥大细胞活化[7]。本研究结果显示蛋白激酶C(PKC)激动剂PMA,可直接刺激RBL-2H3细胞脱颗粒;0.5 μmol/L PMA处理组与空白对照组相比,β-氨基己糖苷酶释放率差异有统计学意义(P<0.01)。PKC信号通路活化,导致肌球蛋白轻链磷酸化,继而肌球蛋白/肌动蛋白复合体解聚,加速胞质内颗粒囊泡运动;后者的质膜与细胞膜发生融合使颗粒内组胺等生物活性介质被释放,即脱颗粒(Degranulation)[8]。
本研究笔者还着重观察了蛇床子素对PMA诱导RBL-2H3细胞脱颗粒的影响。将无细胞毒性的3个浓度蛇床子素(1,10,50 μmol/L)与 0.5 μmol/L PMA联合处理细胞,结果显示蛇床子素能剂量依赖地抑制脱颗粒率和β-氨基己糖苷酶释放率。透射电镜结果也证实蛇床子素能明显阻抑PMA诱导的颗粒囊泡释放。蛇床子素是从中药蛇床子、独活等提取的一种香豆素类化合物。已有研究报道蛇床子素能抑制组胺-和非组胺-依赖性瘙痒,推测其作用机制可能是部分抑制了组胺介导的肥大细胞脱颗粒[2]。在过敏原未知的情况下,用蛇床子素直接抑制活化的肥大细胞脱颗粒有望成为治疗过敏性皮肤病的一种新手段。
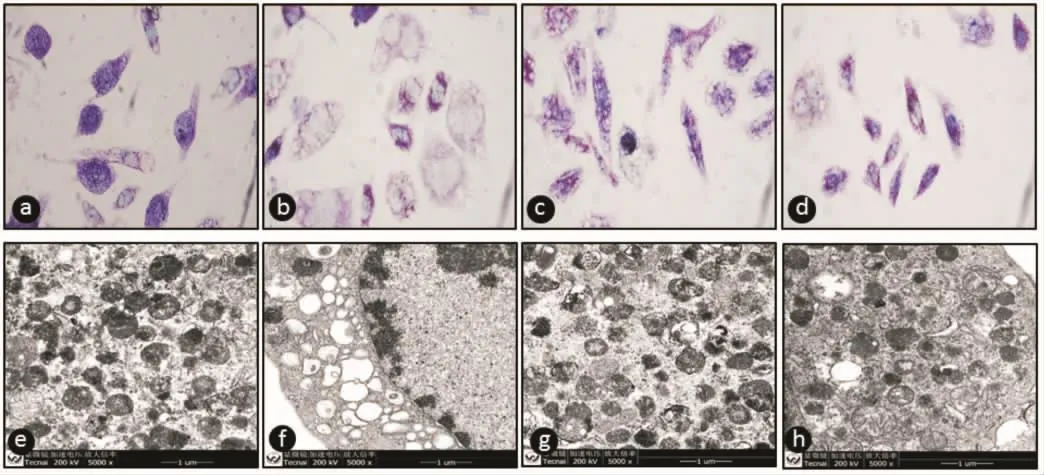
图2 蛇床子素抑制PMA诱导细胞脱颗粒
参考文献:
[1] 王博,强雁鸿,张凤霞.中药抗过敏作用研究的现状与前景[J] .中华医学研究杂志,2007,7(12):1118-1119.
[2] Yang NN,Shi H,Yu G,et al.Osthole inhibits histamine-dependent itch via modulating TRPV1 activity[J] .Sci Rep,2016,6:25 657.
[3] You L,Feng S,An R,et al.Osthole:a promising lead compound for drug discovery from a traditional Chinese medicine(TCM)[J] .Nat Prod Commun,2009,4:297-302.
[4] MacGlashan D Jr.FceRI density and spontaneous secretion from human basophils[J] .PLoS One,2017,12:e0 179 734.
[5] Passante E,Ehrhardt C,Sheridan H,et al.RBL-2H3 cells are an imprecise model for mast cell mediator release[J] .Inflamm Res,2009,58:611-618.
[6] Deng Z,Zink T,Chen HY,et al.Impact of actin rearrangement and degranulation on the membrane structure of primary mast cells:a combined atomic force and laser scanning confocal microscopy investigation[J] .Biophys J,2009,96:1629-1639.
[7] Tang J,Liu J,Wu W.Studies on the degranulation of RBL-2H3 cells induced by Traditional Chinese Medicine injections[J] .Chin Med,2012,3:200-208.
[8] Manabe Y,Hirata T,Sugawara T.Suppressive effects of carotenoids on the antigen-induced degranulation in RBL-2H3 rat basophilic leukemia cells[J] .J Oleo Sci,2014,63:291-294.

