双氢青蒿素单独和联合甲氨蝶呤在皮肤T细胞淋巴瘤细胞系的抗肿瘤作用
张芊,王艺萌,姜蔚蔚,谷晓广,张春雷
(北京大学第三医院,北京100191)
皮肤T细胞淋巴瘤(Cutaneous T cell lymphoma,CTCL)是一种原发于皮肤的非霍奇金淋巴瘤,其特征性表现是恶性单克隆性T淋巴细胞在皮肤的浸润[1]。CTCL约占所有原发于皮肤淋巴瘤的75%~80%。大约2/3的CTCL是蕈样肉芽肿(Mycosis fungoides,MF) 或 Sézary 综合征(Sézary syndrome,SS),以MF最为常见[1]。目前CTCL治疗手段包括局部和系统性治疗,比如光疗、甲氨蝶呤(Methotrexate,MTX)等,但尚无治愈的方法,仍需要探索新型的疗效好、作用持久、不良反应少的治疗方法。青蒿素是从菊科植物黄花蒿(Artemisia annua L.)提取的,我国屠呦呦教授发现的抗疟疾药物,她因此获得了2015年诺贝尔生理学奖。双氢青蒿素(Dihydroartemisinin,DHA)是青蒿素最重要的活性衍生物,最初用于抗疟疾治疗,不良反应小,后来研究证实其对多种肿瘤具有治疗作用,可能通过氧化应激反应、DNA损伤和修复、诱导细胞凋亡等方式选择性地抑制肿瘤细胞[2-4]。MTX是具有细胞毒性的叶酸拮抗剂,常用于CTCL治疗[5]。本研究将通过观察DHA和MTX对CTCL细胞系HH细胞的增殖和凋亡的影响,检测细胞凋亡相关蛋白表达,探讨DHA联合MTX治疗CTCL的分子机制。
1 资料与方法
1.1 主要资料及试剂 HH细胞系(ATCC号CRL-2105),RPMI1640 培养基(美国 Gibco®公司,货号22400-089),胎牛血清(美国Gibco®公司,10099-141),DHA(美国 Sigma-Aldrich®公司,批号 D7439),MTX(美国辉瑞®公司,批号R46884),MTS细胞增殖检测试剂盒(美国Promega®公司,G3580),FITCAnnexin V凋亡检测试剂盒(美国CA®公司),7-AAD试剂盒(美国BD®公司,559925),兔抗人Noxa单克隆抗体(美国Abcam®公司),兔抗人Caspase 3单克隆抗体、兔抗人Bax单克隆抗体、兔抗人p53单克隆抗体、兔抗人γ-H2AX单克隆抗体、兔抗人ATM单克隆抗体、鼠抗人β-Actin单克隆抗体(美国Cell Signaling Technology®公司),细胞培养箱(美国Thermo®公司)。
1.2 细胞培养 HH细胞在含有10%胎牛血清和1%青链霉素的RPMI1640培养基中,置于37℃5%CO2培养箱中培养传代,取不同浓度的对数期细胞进行后续实验。
1.3 MTS法测定细胞的存活率 取对数期HH细胞,细胞计数以2×104/mL的浓度在6孔板中接种2 mL,通过倍比稀释分别在实验组加入2.5、5.0、10.0、20.0 μmol/L DHA,5.0 μmol/L MTX,5.0 μmol/L DHA联合5.0 μmol/L MTX(联合组),对照组加入二甲基亚砜(Dimethyl sulfoxide,DMSO)后孵育箱培养。在 24、48、72 h 时混匀细胞,从各组取 100 μL 细胞混悬液至96孔板,每个浓度做3个复孔,每孔加入20 μL预先配置的MTS溶液,在37℃孵箱中孵育2 h,用分光光度仪测定490 nm处吸光值(A值),重复测定3次。与对照组比较,计算细胞活力,细胞增殖百分比=[(A值处理组-A值培养基)/(A值对照组-A 值培养基)] × 100%。
1.4 流式细胞仪检测细胞凋亡及细胞周期 取对数生长期的HH细胞以2×104/mL接种于6孔板,每孔3 mL,通过倍比稀释分别在实验组加入2.5、5.0、10 μmol/L DHA,5.0 μmol/L MTX,5.0 μmol/L DHA联合5.0 μmol/L MTX(联合组),对照组加入DMSO,每孔 1 μL,培养 24 h 或 48 h。
细胞周期的检测:每组收集计数2×105个细胞,离心后在0.3 mL PBS缓冲液中重悬,向细胞中逐滴加入0.7 mL冰无水乙醇固定细胞,加入时不断震荡,置于-20℃下18 h。细胞悬液200转/min离心5 min去除固定液,冰PBS缓冲液洗涤2次,沉淀用300μL PBS缓冲液重悬,加入10 μL 7-AAD溶液,避光室温染色15 min,过滤后用流式细胞仪PE/7-AAD通道分析,计算G0/G1期、S期和G2/M期细胞所占比例。重复测定3次,取平均值。
细胞凋亡的检测:每组收集计数105个细胞,以冷PBS缓冲液洗涤2次,用细胞结合缓冲液以106个/mL的浓度重悬细胞,每管100 μL的细胞悬液加入FITC偶联的Annexin V溶液5 μL和7-AAD溶液5 μL,混匀后避光染色15 min。每管加入300 μL结合缓冲液,1 h内用流式细胞仪检测,采用FlowJo V10软件分析,计算FITC阳性细胞百分比。重复测定3次,取平均值。
1.5 Western印迹法检测细胞凋亡及细胞周期相关蛋白的表达 取 5.0 μmol/L DHA组、5.0 μmol/L MTX 组、5.0 μmol/L DHA 联合 5.0 μmol/L MTX 组(联合组)及对照组培养48 h的HH细胞106个,离心弃上清液,用PBS洗涤细胞2次,加入蛋白裂解液置于冰上,每隔5 min漩涡振荡仪混匀3次,4℃18 000转/min离心10 min。收集上清液,用BCA法蛋白质定量试剂盒对待测蛋白进行蛋白定量。将蛋白电泳上样缓冲液加入到总蛋白溶液中,充分混匀,水浴锅100℃煮沸变性5 min。在SDS-PAGE凝胶每孔分别加入30 μg总蛋白或2 μL预染色蛋白质分子量标准标志,开始电泳时90V恒压20~30min,待蛋白样品进入分离胶后增加至130 V恒压40~60 min,电泳至溴酚蓝到达分离胶底部。300 mA 90 min将电泳条带电转印到PVDF膜上,5%脱脂奶粉封闭1 h,分别加入一抗,1∶800稀释兔抗人Caspase 3单克隆抗体、1∶800 稀释兔抗人 Bax单克隆抗体、1∶1 000 稀释兔抗人Noxa单克隆抗体、1∶1 000稀释兔抗人p53单克隆抗体、1∶1 000稀释兔抗人ATM单克隆抗体、1∶1 000稀释兔抗人γ-H2AX单克隆抗体、1∶1 000稀释鼠抗人β-Actin单克隆抗体,4℃过夜。封闭洗涤缓冲液(TBST)洗涤3次,加入IRDyeTM 800CW染料标记的山羊抗兔二抗、或山羊抗鼠二抗,室温孵育1 h,TBST洗涤3次,双红外激光扫描成像系统进行荧光显色,分析。
1.6 统计学分析 采用SPSS 21.0软件,计量资料以±s表示,增殖实验数据采用重复测量方差分析,流式细胞仪细胞周期实验数据采用单因素方差分析。流式细胞凋亡实验数据通过两因素方差分析探讨时间和浓度对凋亡比例的影响。若时间和浓度的交互作用有统计学意义,采用SPSS中一般线性模型模块的UNIANOVA和EMMEANS子句实现单独效应分析[6]。即固定时间,比较不同浓度对凋亡比例的影响;固定浓度,比较不同时间对凋亡比例的影响。组间比较采用LSD检验进行两两比较。双侧P<0.05为差异有统计学意义。
2 结果
2.1 DHA和MTX对HH细胞体外增殖的影响 与对照组相比,2.5、5.0、10.0、20.0 μmol/L DHA 组、5.0 μmol/L MTX组、联合组细胞增殖百分比有不同程度降低。重复测量方差分析显示,DHA组间细胞增殖百分比随时间变化存在趋势(F=716.967,P<0.001,见图1A),且各组间细胞增殖抑制百分比随着 DHA 浓度增加也存在趋势(F=17.622,P<0.05),差异有统计学意义,见图1A。5.0 μmol/L DHA组、5.0 μmol/L MTX组和联合组细胞增殖百分比抑制随时间变化存在趋势(F=1236.930,P<0.001),见图1B,联合组抑制作用最明显。各组数据进行两两比较,LSD检验显示,24、48、72 h各组间细胞增殖百分比差异有统计学意义(P<0.05)。24、48、72 h联合组细胞增殖百分比低于5.0 μmol/L DHA组和5.0 μmol/L MTX 组,差异有统计学意义(P<0.01)。这些结果表明,DHA在体外能显著抑制HH细胞增殖,且DHA联合MTX对HH细胞增殖的抑制作用明显强于这两者单独应用。
2.2 DHA和MTX对HH细胞周期的影响 HH细胞经过不同浓度 DHA(2.5、5.0、10.0 μmol/L)、DMSO或甲氨蝶呤处理48 h后,G0/G1期、G2/M期细胞比例差异有统计学意义(F=8.015,P<0.05;F=32.245,P<0.001);S期细胞比例差异无统计学意义(F=1.526,P=0.258),见表1。与对照组相比,各浓度DHA组、MTX组和联合组G0/G1期细胞比例明显上升、G2/M期细胞比例明显下降(P<0.05)。但不同浓度DHA组间细胞周期两两比较,差异无统计学意义(P>0.05)。联合组与单独应用DHA组(5.0 μmol/L)或MTX(5.0 μmol/L)组分别比较细胞周期,差异无统计学意义(P>0.05)。
表1 DHA作用HH细胞48 h后对细胞周期的影响 (%,±s)

表1 DHA作用HH细胞48 h后对细胞周期的影响 (%,±s)
组别 G0/G1期 S期 G2/M期2.5 μmol/L DHA 60.50± 4.58 38.02± 4.90 1.48±1.01 5.0 μmol/L DHA 59.64± 9.83 39.34±10.43 1.03±1.34 10.0 μmol/L DHA 54.12± 8.84 44.79± 9.55 1.09±1.94 5.0 μmol/L MTX 61.68± 4.97 38.32± 4.97 0.00±0.00联合组 65.98±12.47 34.02±12.47 0.00±0.00对照组 35.76± 8.32 50.56±10.96 13.88±3.65 F 8.015 1.526 32.245 P<0.05 0.258 <0.001
2.3 DHA和MTX对HH细胞凋亡的影响 2.5、5.0、10.0 μmol/L DHA 组,5.0 μmol/L MTX 组,联合组和对照组HH细胞经过24 h或48 h处理后,时间和浓度的交互作用差异有统计学意义(P<0.05),凋亡细胞比例呈浓度依赖并随时间延长而升高,联合用药效果强于单药。随着处理时间延长,药物组细胞凋亡百分比增加(P<0.05)。药物组处理HH细胞24 h 后,随着 DHA 浓度升高(2.5、5.0、10.0 μmol/L),HH细胞凋亡百分比从11.96%(2.5 μmol/L DHA)增加到22.35%(10.0 μmol/L DHA),凋亡细胞百分比呈浓度依赖,差异有统计学意义(F=6.866,P<0.05);见图2,处理48 h后,上述凋亡百分比从21.89%增加到42.70%,也存在浓度依赖(F=50.506,P<0.001)。单独应用5.0 μmol/L DHA 或5.0 μmol/L MTX 处理HH细胞24 h,凋亡细胞百分比分别为15.86%和15.56%,而两者联合时凋亡百分比增加至21.14%,各组差异有统计学意义(F=3.513,P<0.05);当处理48 h后,单独应用DHA或MTX凋亡细胞百分比为31.60%和30.53%,而联合组为46.76%,各组差异有统计学意义(F=41.713,P<0.001)。处理24 h或48 h后DHA各浓度组细胞凋亡百分比进行两两比较,除 24 h 2.5 μmol/L 和 5.0 μmol/L DHA 组以外,其余各组差异有统计学意义(P<0.05)。处理48 h后,联合组分别与单药DHA或MTX组两两比较,联合组凋亡细胞比例均高于两单药组,且差异有统计学意义(P<0.05),但24 h时上述差异无统计学意义。
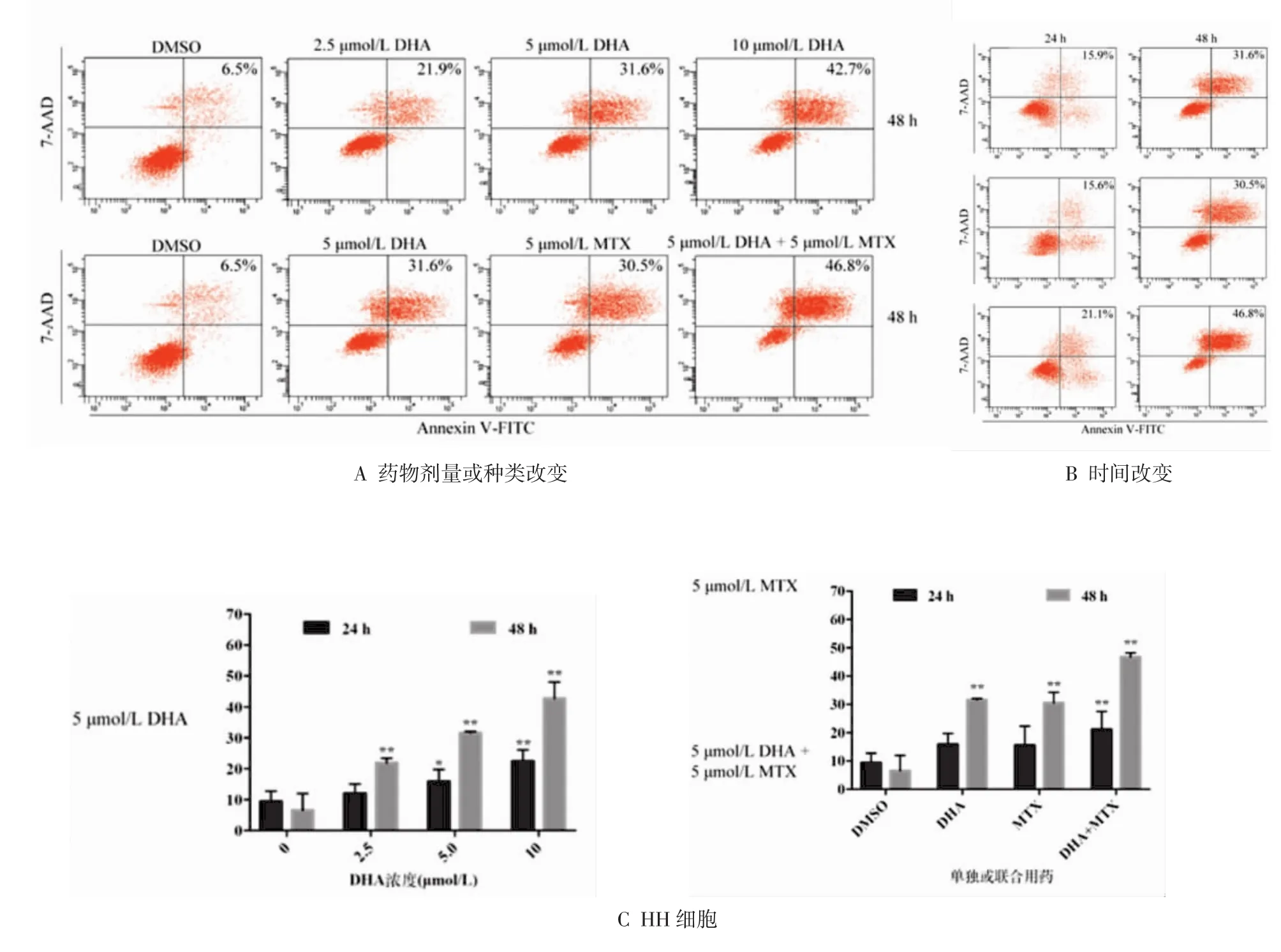
图2 流式细胞仪检测DHA和MTX对HH细胞凋亡的影响
2.4 DHA和MTX对HH细胞凋亡和DNA损伤相关蛋白表达的影响 与对照组相比,各实验组γ-H2AX、ATM、p53、Bax、Noxa、Caspase 3 活化片段蛋白条带灰度增强,内参对照是β-Actin。和单药组相比,联合用药组 γ-H2AX、ATM、p53、Bax、Noxa、Caspase 3活化片段的蛋白表达明显增加,而且联合组增加程度强于单药组,见图3。
3 讨论
CTCL是一种原发于皮肤的恶性淋巴瘤,探索具有良好应用前景的CTCL治疗方式至关重要的是发现新型有效、不良反应少的药物。如前所述,青蒿素是一种含有内过氧化基团的倍半萜内酯化合物,屠呦呦教授阐明青蒿素对抗疟原虫感染有效。疟疾治疗全球标准是含青蒿素与其衍生物的联合疗法,帮助挽救了数百万人的生命。DHA是青蒿素活性代谢产物,不良反应少,耐受性好,临床应用广泛。近年来很多研究显示DHA对不同来源的肿瘤具有很强的治疗作用[2-4]。但是很少有研究探讨DHA对于CTCL的作用,而且DHA抗肿瘤的具体机制仍未被发现。针对这个问题,本研究首次发现DHA对CTCL细胞系HH细胞具有抗肿瘤作用。DHA作用CTCL细胞后,细胞增殖明显下降,并呈浓度依赖和时间依赖。CTCL细胞增殖受抑制,可能是肿瘤细胞停止生长(细胞周期阻滞)或死亡。笔者观察发现DHA作用CTCL细胞后,凋亡细胞比例增加,凋亡相关蛋白Caspase 3活化片段表达上升,并且当DHA与MTX联合时作用增强。虽然DHA能使CTCL细胞G0/G1期细胞比例上升、G2/M期下降,但不存在浓度依赖;并且S期细胞比例下降差异无统计学意义。DHA对CTCL的抗肿瘤作用可能是通过诱导细胞凋亡产生,联合应用MTX能增强上述效果。

图3DHA和MTX对HH细胞凋亡和DNA损伤相关蛋白的影响
目前认为DHA治疗肿瘤的作用机制可能是:DHA的内过氧化基团裂解,随后产生以碳为中心的自由基,激活后使细胞蛋白质烷基化,还能产生ROS(Reactive oxygen species)等超氧化物[7];氧化应激、DNA损伤以及蛋白质烷基化使细胞正常功能不能维持,导致细胞周期停滞或死亡[2,8]。除此之外,DHA还能抑制血管生成[9]以及阻止肿瘤转移和侵袭[3,10]。青蒿素及其衍生物作用于60种肿瘤细胞系后,研究发现某些DNA损伤应答和修复基因mRNA表达与其lgIC50值相关[11],研究者推测这可能是因为青蒿素及其衍生物造成了DNA损伤,后有研究证实青蒿琥酯(青蒿素的一种活性衍生物)能够剂量依赖性诱导DNA断裂[12]。γ-H2AX是一种DNA相关组蛋白,DNA双链断裂(Double stranded breaks,DSBs)诱导其表达,是 DSBs的标志[13]。DSBs发生后细胞启动DNA损伤应答,主要通过激活DNA依赖性蛋白激酶和ATM(Ataxia telangiectasia-mutated)等[14]。ATM激活后启动DNA修复,如果修复失败,没能切除的DSBs使ATM直接或间接地活化p53,增强p53下游促凋亡基因转录,诱导细胞凋亡[15-16]。p53转录调节的促凋亡基因包括FasR、Bax、Puma、Noxa、Apaf-1和PIDD,都是DNA损伤应答下游编码蛋白[16]。促凋亡蛋白Bax和仅含BH3区域蛋白(BH3-only proteins)Noxa均属Bcl-2家族,参与调控线粒体凋亡通路,继而激活Caspase 9,级联反应激活Caspase 3,执行细胞凋亡[17-18]。在本研究中,DHA、MTX或两者联合作用于HH细胞后,细胞增殖受抑制,细胞凋亡比例上升,DSBs标志γ-H2AX、DNA修复相关基因ATM、p53及下游促凋亡基因Bax、Noxa、Caspase 3活化片段蛋白量增加,提示DHA和MTX作用HH细胞系后,可能通过DNA损伤、诱导凋亡来抑制细胞增殖。
MTX是一种叶酸拮抗剂、还能抑制DNA甲基化,可用于多种CTCL治疗,比如MF、SS、原发皮肤CD30阳性淋巴增殖性疾病和间变性大细胞淋巴瘤,特别是进展期MF、SS和大细胞变MF[19-20]。当叶酸拮抗剂与其他治疗方法结合使用时,能产生协同效果,Bozic等[21]分析计算出联合治疗要优于单药治疗。对于MF或SS患者,MTX低剂量单药应用有效率在33%,与贝沙罗汀联合有效率在66%,与干扰素α联用有效率在74%[22]。在本研究中,与单用DHA相比,DHA联合MTX对HH细胞有更明显的增殖抑制、凋亡诱导作用,并且凋亡相关基因p53、Noxa、Bax、Caspase 3 和 DNA 损伤相关基因 γ-H2AX、ATM蛋白的表达增加也强于DHA或MTX单药,提示DHA联合MTX能明显提高对CTCL细胞系HH细胞的生长抑制。
参考文献:
[1] Wilcox RA.Cutaneous T-cell lymphoma:2016 update on diagnosis,risk-stratification,and management[J] .Am J Hematol,2016,91:151-165.
[2] Que Z,Wang P,Hu Y,et al.Dihydroartemisin inhibits glioma invasiveness via a ROS to P53 to β-catenin signaling[J] .Pharmacol Res,2017,119:72-88.
[3] Cabello CM,Lamore SD,Bair WR,et al.The redox antimalarial dihydroartemisinin targets human metastatic melanoma cells but not primary melanocytes with induction of NOXA-dependent apoptosis[J] .Invest New Drugs,2012,30:1289-1301.
[4] Zhang S,Shi L,Ma H,et al.Dihydroartemisinin induces apoptosis in human gastric cancer cell line BGC-823 through activation of JNK1/2 and p38 MAPK signaling pathways[J] .J Recept Signal Transduct Res,2017,37:174-180.
[5] Zackheim HS,Kashani-Sabet M,Mcmillan A.Low-dose methotrexate to treat mycosis fungoides:a retrospective study in 69 patients[J] .J Am Acad Dermatol,2003,49:873-878.
[6] 李悦,朱凯,章志红.SPSS实现析因设计资料单独效应分析的四种方法及比较[J] .中国卫生统计,2011,28(3):324-325,329.
[7] Mercer AE,Copple IM,Maggs JL,et al.The role of heme and the mitochondrion in the chemical and molecular mechanisms of mammalian cell death induced by the artemisinin antimalarials[J] .J Biol Chem,2011,286:987-996.
[8] Lin R,Zhang Z,Chen L,et al.Dihydroartemisinin(DHA)induces ferroptosis and causes cell cycle arrest in head and neck carcinoma cells[J] .Cancer Lett,2016,381:165-175.
[9] Shen R,Li J,Ye D,et al.Combination of onconase and dihydroartemisinin synergistically suppresses growth and angiogenesis of non-small-cell lung carcinoma and malignant mesothelioma[J] .Acta Biochim Biophys Sin(Shanghai),2016,48:894-901.
[10] Zhang F,Ma Q,Xu Z,et al.Dihydroartemisinin inhibits TCTP-dependent metastasis in gallbladder cancer[J] .J Exp Clin Cancer Res,2017,36:68.
[11] Efferth T,Oesch F.Oxidative stress response of tumor cells:microarray-based comparison between artemisinins and anthracyclines[J] .Biochem Pharmacol,2004,68:3-10.
[12] Li PC,Lam E,Roos WP,et al.Artesunate derived from traditional Chinese medicine induces DNA damage and repair[J] .Cancer Res,2008,68:4347-4351.
[13] Geric M,Gajski G,Garaj-Vrhovac V.γ-H2AX as a biomarker for DNA double-strand breaks in ecotoxicology[J] .Ecotoxicol Environ Saf,2014,105:13-21.
[14] Sirbu BM,Cortez D.DNA damage response:three levels of DNA repair regulation[J] .Cold Spring Harb Perspect Biol,2013,5:a12 724.
[15] Shibata A,Jeggo PA.DNA double-strand break repair in a cellular context[J] .Clin Oncol,2014,26:243-249.
[16] Roos WP,Kaina B.DNA damage-induced cell death:from specific DNA lesions to the DNA damage response and apoptosis[J] .Cancer Lett,2013,332:237-248.
[17] Adams JM,Cory S.The Bcl-2 apoptotic switch in cancer development and therapy[J] .Oncogene,2007,26:1324-1337.
[18] Fletcher JI,Huang DC.Controlling the cell death mediators Bax and Bak:puzzles and conundrums[J] .Cell Cycle,2008,7:39-44.
[19] Trautinger F,Eder J,Assaf C,et al.European Organisation for Research and Treatment of Cancer consensus recommendations for the treatment of mycosis fungoides/Sézary syndrome-Update 2017[J] .Eur J Cancer,2017,77:57-74.
[20] Wood GS,Wu J.Methotrexate and Pralatrexate[J] .Dermatol Clin,2015,33:747-755.
[21] Bozic I,Reiter JG,Allen B,et al.Evolutionary dynamics of cancer in response to targeted combination therapy[J] .Elife,2013,2:e00 747.
[22] Virmani P,Hwang SH,Hastings JG,et al.Systemic therapy for cutaneous T-cell lymphoma:who,when,what,and why[J] .Expert Rev Hematol,2017,10:111-121.

