棉花内生细菌HB3S-20对棉花黄萎病的生防效果评估及其鉴定
金利容,万 鹏,黄 薇
(湖北省农业科学院 植保土肥研究所/湖北省农作物重大病虫草害可持续控制重点实验室,湖北 武汉 430064)
黄萎病是棉花生产上的一种重要病害,为大丽轮枝菌(VerticilliumdahliaeKleb.) 引起的土传病害,能导致棉花严重减产甚至植株死亡,已成为棉花生产的主要限制因子之一[1]。生物防治由于其对环境的友好性被认为是一种颇具应用前景的方法,利用微生物对棉花黄萎病进行防治,能在改善作物生长和产量的同时确保自然环境的安全性,具有可持续发展的战略意义。
利用生防细菌防治棉花黄萎病,研究较为深入的主要有芽孢杆菌(Bacillusspp.)和假单胞杆菌(Pseudomonasspp.)。其中,芽孢杆菌包括枯草芽孢杆菌(Bacillussubtilis)[2-3]和蜂房芽孢杆菌(Paenibacillusalvei)[4-5]。Lu等[6]和李社增等[7]报道,枯草芽孢杆菌NCD-2菌株对棉花黄萎病防效显著,田间防效在70%以上。关于假单胞杆菌对黄萎病的生防效果和生防机制的研究报道也较多[8-10]。目前,国内研究较多并已经规模化生产的一个例子是枯草芽孢杆菌制剂,其生物防治的作用机制主要是通过产生杆菌肽等多种抗菌物质来抑制病原菌[11]。但是总体而言,应用在生产上的生防制剂还是较少,因此,有必要发掘对棉花黄萎病防治更加有效和丰富的菌种资源,为棉花黄萎病的生物防治提供材料,并为将来生物源农药的开发奠定基础。
植物内生菌是自然界中非常丰富且庞大的菌种资源库,是指那些生活史特定阶段或全部阶段寄生在健康植物组织内的微生物,且在长期的发展历程中已经与植物建立起了一种彼此协助、互惠共利的相互关系,是植物微生态系统不可缺少的天然组成成分。植物内生菌具有丰富的利用价值,很多内生菌对植物具有促生和防病作用,利用植物内生菌作为生防菌来控制植物病原菌具有巨大潜力[12],是植物保护的一个重要发展方向。
在前期研究中,从棉花组织分离出大量的内生细菌,经初筛,得到1株对棉花黄萎病抑制效果较好的生防细菌HB3S-20。本试验进一步对该菌的温室与大田防治效果进行研究,并对该菌进行了室内抑菌活性测定以及菌株鉴定,探究其作为棉花黄萎病生防菌株的潜力。
1 材料和方法
1.1 供试菌株和棉花品种
内生细菌HB3S-20是从棉花茎部分离并通过温室试验初筛获得的1株内生细菌,于-80 ℃保存。落叶型大丽轮枝菌菌株V991b由本实验室-80 ℃保存。棉花品种为常规棉感病品种冀棉11。
1.2 菌株HB3S-20对棉花黄萎病的温室生防效果测定
将脱绒的冀棉11的种子用无菌水浸泡12 h,种入营养基质(从中国农业科学院棉花研究所购买的无土育苗基质,与河砂以1∶1等体积混合)中,待棉苗长出1~2片真叶,将整株棉苗轻轻从营养基质中移出,待接种用。将大丽轮枝菌菌株V991b活化后,接入到查氏培养基,25 ℃、150 r/min摇菌培养7 d,用4层纱布过滤获得孢子液,调整浓度至1×107个/mL。对菌株HB3S-20进行活化,挑单菌落于装有5 mL NB培养基的大试管中培养过夜,然后将1 mL的菌液加入到含50 mL NB培养基的250 mL锥形瓶中扩大培养,28 ℃、150 r/min摇菌培养3 d,将摇培后的菌液6 000 r/min离心10 min,去掉上清,将菌体沉淀用无菌水溶解,调整浓度至1×108个/mL,即为HB3S-20菌液。
将大丽轮枝菌孢子液与HB3S-20菌液等体积混合接种棉苗的根部即浸根处理20 min,以用大丽轮枝菌孢子液加等体积无菌水接种棉苗根部为阳性对照,以无菌水接种棉苗根部为阴性对照,均设置3个重复,每个重复15株棉苗。然后将棉苗移栽到一次性塑料钵(直径为10 cm)中,每个钵中3株,温室温度保持在25~30 ℃,并隔天浇一次水,保持合适的湿度。
接种后15 d开始调查,每5 d调查一次,即接种后15、20、25、30 d分别调查发病情况,按5级标准记载发病严重度[13]。0级:健株,无症状;1级:1~2片子叶发病或者1片真叶轻微发病;2级:1片真叶严重发病;3级:2片以上真叶发病或脱落,仅剩心叶;4级:植株生长点死亡或全株枯死。根据调查数据,用以下公式计算病情指数和防治效果。
病情指数=(0×n0+1×n1+2×n2+3×n3+4×n4)/(N×4)×100
防治效果=(CKDI-HtDI)/CKDI×100%
公式中,n0、n1、n2、n3、n4分别表示不同病级的病株数,N表示统计的总株数,CKDI表示接种后30 d阳性对照的病情指数,HtDI表示接种后30 d菌株HB3S-20处理后的病情指数。
1.3 菌株HB3S-20对棉花黄萎病的田间生防效果评估
大田防治试验于2015年进行,地点设在湖北潜江的一块农户用地。此田块属于棉花连作地,棉花黄萎病常年发病严重。棉花品种为鄂棉24。4月中旬进行营养钵育苗,4月底移栽,移栽时处理组用HB3S-20菌液(浓度为1×108个/mL)对苗床进行灌根处理,用量约10 mL/株。对照组用自来水对苗床进行灌根处理。处理组和对照组均设3个小区,每个小区大约有90株棉花,各重复小区进行随机排列。待发病高峰期调查棉花发病情况。田间棉花黄萎病严重度分级标准为:0级—棉株健康,无病叶,生长正常;1级—棉株1/4以下的叶片显症状;2级—棉株1/4以上、1/2以下的叶片显症状;3级—棉株1/2以上、3/4以下的叶片显症状;4级—棉株3/4以上的叶片显症状,或叶片全部脱落,棉株枯死。根据调查数据计算发病率、病情指数和防治效果。
1.4 菌株HB3S-20的形态鉴定和分子鉴定
活化菌株HB3S-20,将菌株HB3S-20菌液在NA培养基上划线形成单菌落,观察并记录其形态特征,用移液枪吸取少量菌液均匀涂布在玻片上,在油镜下观察菌株HB3S-20的细胞形态。挑取活化的菌株HB3S-20单菌落接入装有5 mL NB培养基的大试管中,150 r/min、28 ℃摇菌培养3 d,用细菌DNA提取试剂盒(TIANamp Bacteria DNA Kit)提取菌株DNA并检测其浓度和纯度。以细菌DNA为模板,利用16S rDNA通用引物27F/1492R(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增[14]。PCR反应条件如下:95 ℃预变性3 min;94 ℃变性30 s,53 ℃退火45 s,72 ℃延伸1.5 min,35个循环;72 ℃延伸10 min。通过凝胶电泳检测PCR扩增结果(大小约为1 400 bp)。将PCR扩增产物送北京奥科生物公司纯化和测序,之后与GenBank数据库进行Blast比对。从GenBank数据库中下载相关菌株的16S rDNA序列,用 Mega 5.1 软件进行序列分析,采用邻接法(Neighbor-joining, NJ 法)进行系统发育树的构建和同源性比较,并将所测 16S rDNA序列提交GenBank注册。
1.5 菌株HB3S-20对大丽轮枝菌菌丝生长的影响测定
采用平板对峙法测定。大丽轮枝菌V991b 在PDA平板上活化3 d后,在其菌落边缘区域用打孔器(直径6 mm)打孔制成菌片,转接在新的PDA平板中央,25 ℃下培养4 d后(大丽轮枝菌生长缓慢),在距V991b 菌株边缘15 mm处的4个角点加20 μL的HB3S-20菌液,设空白对照(在4个角点加无菌水),每个处理3个重复。 25 ℃对峙培养7 d,测量7 d内V991b的菌落生长直径,即用继续培养7 d后V991b的菌落直径减去之前培养4 d的菌落直径,并按照下列公式计算抑菌率。
抑菌率=(对照V991b 7 d内的菌落生长直径-处理V991b 7 d内的菌落生长直径)/对照V991b 7 d内的菌落生长直径×100%。
1.6 菌株HB3S-20产生嗜铁素的定性检测
按照Schwyn等[15]的方法,配制CAS(铬天青S)固体检测培养基。将菌株HB3S-20接种在CAS固体培养基上,以大肠杆菌(E.coli)作为对照,置于28 ℃培养3~5 d后,观察菌落周围的颜色变化。
1.7 菌株HB3S-20对棉花发芽率和棉株生长的影响测定
以感病品种冀棉11为供试品种,将种子置于HB3S-20菌液(浓度为1×108个/mL)中浸泡14 h后,种入营养基质中,以无菌水浸泡的冀棉11种子作为对照。处理和对照分别准备150粒脱绒种子。3 d后计算其出苗率,20 d后测定15株棉苗的根长、株高以及鲜质量。
1.8 数据处理
试验数据用 Microsoft Excel处理,采用IBM SPSS Statistics 22.0软件进行方差分析(ANOVA)。
2 结果与分析
2.1 菌株HB3S-20对棉花黄萎病的温室生防效果
在温室条件下对菌株HB3S-20的生防效果进行评价,结果表明,温室条件下菌株HB3S-20对棉花黄萎病具有较好的防控效果,菌株HB3S-20与黄萎病菌V991b孢子液混合接种后30 d 3次重复试验的平均病情指数分别为28.33、28.57和30.00,而仅接种黄萎病菌孢子液30 d的平均病情指数分别为70.83、73.33和90.00,HB3S-20对棉花黄萎病表现出较为稳定的防效,平均防效为62.57%(表1)。无菌水接种的处理未发病。

表1 HB3S-20对棉花黄萎病的温室防效
注:同列数据后不同小写字母表示在0.05水平上差异显著,下同。
2.2 菌株HB3S-20对棉花黄萎病的大田生防效果
通过采用移栽时灌根处理的方式进行菌株HB3S-20对棉花黄萎病的田间防治试验,结果表明,菌液灌根处理能够减轻棉花黄萎病的发生,对照的病株率和病情指数分别为22.18%和8.36,而移栽时菌液灌根处理的病株率和病情指数分别为11.28%和3.79,防效为54.67%(表2)。

表2 HB3S-20对棉花黄萎病的大田防效
2.3 菌株HB3S-20的鉴定结果
菌株HB3S-20的菌落形态为圆形,淡黄色,不透明。革兰氏染色表明,菌株HB3S-20为革兰氏阴性菌,在油镜下观察其细胞形态为卵圆形(图1A、B)。菌株HB3S-20生长的最适温度为25~30 ℃,41 ℃不生长。以菌株HB3S-20的DNA为模板,以16S rDNA通用引物27F/1492R为引物,扩增出菌株HB3S-20的16S rDNA部分序列(图2),对PCR产物进行纯化和测序后,获得该菌株16S rDNA序列的长度为1 400 bp,GenBank注册号为 MF073238。并与假单胞菌属的其他种及其相近种的16S rDNA序列进行多重序列比对,构建系统发育树,结果表明,此菌株的16S rDNA序列与假单胞菌属的其他种及其相近种之间具有高度同源性,其中与恶臭假单胞菌(Pseudomonasputida)的同源性最高,达99%,在系统发育树中处于同一分支,进化上的遗传距离最近(图3)。推测菌株HB3S-20为恶臭假单胞菌。

A:菌株HB3S-20的菌落形态;B:菌株HB3S-20的细胞形态(100×);C:大丽轮枝菌V991b的单独培养;D:菌株HB3S-20与大丽轮枝菌V991b的对峙培养图1 菌株HB3S-20的形态特征及其对大丽轮枝菌V991b生长的抑制作用

图2 菌株HB3S-20 16S rDNA扩增片段的电泳检测

图3 基于16S rDNA序列构建的菌株HB3S-20系统发育树
2.4 菌株 HB3S-20对大丽轮枝菌V991b生长的抑制作用
在PDA培养基上,菌株HB3S-20和大丽轮枝菌V991b对峙培养时,能够形成明显的抑菌带(图1C、D),表明菌株HB3S-20对大丽轮枝菌的生长具有拮抗作用,其抑菌率为47.30%(表3)。
2.5 菌株HB3S-20产生嗜铁素的定性检测结果
定性测定嗜铁素所用的培养基是CAS培养基。CAS培养基中含有 CAS、十六烷基三甲基溴化铵(HDTMA)以及Fe3+的三元复合物而呈蓝色。当更强的螯合剂将Fe3+从该复合物中移出,颜色会由蓝色转为橘黄色[16]。菌株HB3S-20在CAS培养基上长势良好,培养3 d后能够观察到菌落周围产生明显的橘黄色透明晕圈(图4),因此,推测菌株HB3S-20在生长过程中能够分泌出螯合Fe3+的嗜铁素物质。

表3 对峙培养中菌株HB3S-20对V991b菌丝生长的抑制效果

图4 菌株HB3S-20在CAS上产生的橘黄色透明晕圈
2.6 菌株HB3S-20对棉花发芽率和棉株生长指标的影响
试验结果表明,菌株HB3S-20对棉花的出苗率和植株生长不仅没有负面作用,还具有一定的促生作用。用HB3S-20菌液浸泡棉花种子14 h后出苗率为74.67%,对照组无菌水处理种子后出苗率为75.50%,说明HB3S-20菌液浸种处理对出苗率的影响很小。菌液处理组棉株生长20 d后根长与对照组相比没有显著差异,但株高和鲜质量显著高于对照组(P<0.05)(表4)。
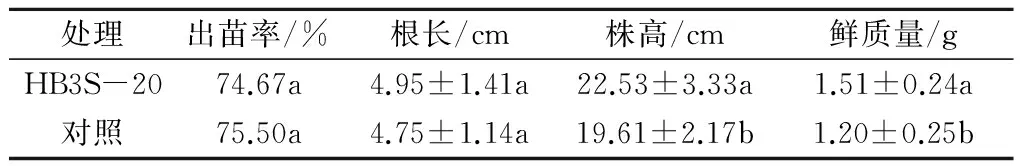
表4 菌株HB3S-20处理棉花种子后的生长指标
3 结论与讨论
本研究通过温室试验初筛获得了1株对棉花黄萎病有防治效果的细菌菌株HB3S-20,多次温室试验的结果表明,其表现出较为稳定的生防效果,平均防效为62.57%。大田试验也表明,该菌株能够减轻棉花黄萎病的发生,防效为54.67%。菌株HB3S-20形态鉴定的结果表明,其菌落形态为淡黄色,不透明,细胞形态为卵圆状,属于革兰氏阴性菌。用细菌通用引物扩增菌株16S rDNA的部分序列并进行测序和比对分析,推测菌株HB3S-20为恶臭假单胞菌(Pseudomonasputida)。
近些年,假单胞菌被认为是一种防治土传病害的潜在生防菌,具有较为广阔的应用前景[17]。假单胞菌的种类较多,有铜绿假单胞菌、荧光假单胞菌、恶臭假单胞菌和绿针假单胞菌等,其中报道较多的是荧光假单胞菌[18]。假单胞菌防治植物病害的主要机制有以下3个方面[19]:首先是竞争作用,很多假单胞菌具有极强的根定殖能力,能够与病原菌形成营养或空间上的竞争关系;其次是拮抗作用,假单胞菌能够产生不同种类的拮抗物质,如吩嗪类物质、间苯三酚、氰化氢等抗生物质;另外,某些假单胞菌对植物体具有诱导抗性,能够诱导植物体产生抗病性。
对峙培养试验结果表明,菌株HB3S-20对大丽轮枝菌的生长具有较好的抑制作用。进一步的研究表明,菌株HB3S-20能够产生嗜铁素物质。嗜铁素是指由微生物在低铁条件下合成的能特异螯合Fe3+的一类小分子质量的螯合因子。很多假单胞菌能够产生嗜铁素[20],其在植物病害生物防治中的作用已有深入研究。生防菌产生的嗜铁素主要是通过对Fe3+的竞争影响病原微生物的生长,嗜铁素能够络合环境周围Fe3+,使病原菌得不到足够的Fe3+营养而不能正常生长繁殖,从而减轻病原菌对植物体的危害,达到控制植物病害的目的[21]。
假单胞菌是活跃在植物根际的一大类植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR),能够通过产生植物激素、ACC脱氨酶、抗生素、嗜铁素等物质调节植物的微生态环境[22-23],从而对宿主植物起到防病促生的作用。植物根际促生菌能够竞争性地定殖在植物的根部,促进植物的生长和减轻病害的发生。本研究测定了菌株HB3S-20对棉花的促生能力,结果表明,其对棉花的出苗率和根长无显著影响,但可以显著提高棉株的株高和鲜质量,说明菌株HB3S-20对棉株具有一定的促生作用。
总体而言,菌株HB3S-20对棉花黄萎病具有较好的生防活性,对大丽轮枝菌具有拮抗作用,能够产生螯合Fe3+的嗜铁素类物质,并且对棉株具有一定的促生作用。因此,菌株HB3S-20在防治棉花黄萎病方面有较大的应用潜力,是一种潜在的生防菌。接下来将继续研究菌株HB3S-20防治棉花黄萎病的作用机制,为该生防菌的应用提供理论依据。
参考文献:
[1] 杨璨,孙全,王微娜,等.海岛棉单萜合酶基因克隆及其受黄萎病诱导的表达分析[J].南方农业学报,2016,47(5):604-610.
[2] Tjamos E C,Tsitsigiannis D I,Tjamos S E,etal.Selection and screening of endorhizosphere bacteria fromsolarizedsoils as biocontrol agents againstVerticilliumdahliaeof solanaceous hosts[J].European Journal of Plant Pathology,2004,110:35- 44.
[3] Berg G,Fritze A,Roskot N,etal.Evaluation of potential biocontrol rhizobacteria from different host plants ofVerticilliumdahliaeKleb[J].Journal of Applied Microbiology,2001,91:963-971.
[4] Antonopoulos D F,Tjamos S E,Antoniou P P,etal.Effect ofPaenibacillusalvei,strain K165,on the germination ofVerticilliumdahliaemicrosclerotia in planta[J].Biological Control,2008,46:166-170.
[5] Li S Q,Zhang N,Zhan Z H,etal.AntagonistBacillussubtilisHJ5 controlsVerticilliumwilt of cotton by root colonization and biofilm formation[J].Biology and Fertility of Soils,2013,49:295-303.
[6] Lu X Y,Li S Z,Ma P,etal.Isolation and partial purification of an extracellular metabolite from aBacillussubtilisstrain NCD-2 active againstVerticilliumdahliae[J].Shandong Science,2005,18(3):22-25.
[7] 李社增,马平,刘杏忠,等.利用拮抗细菌防治棉花黄萎病[J].华中农业大学学报,2010,20(5):410- 414.
[8] Mercado-Blanco J,Rodriguez-Jurado D A,Jimenez-Diaz R M,etal.Suppression ofVerticilliumwilt in olive planting stocks by root-associated fluorescentPseudomonasspp.[J] .Biological Control,2004,30:474-486.
[9] Debode J,Maeyer K D,Perneel M,etal.Biosurfactants are involved in the biological control ofVerticilliummicrosclerotia byPseudomonasspp.[J].Journal of Applied Microbiology,2007,103:1184-1196.
[10] Erdogan O,Benlioglu K.Biological control ofVerticilliumwilt on cotton by the use of fluorescentPseudomonasspp.under field conditions[J].Biological Control,2010,53:39-45.
[11] 马平.棉花黄萎病生物防治研究进展[J].河北农业科学,2003,7(3):38-44.
[12] 夏正俊,顾本康,吴蔼民.植物内生及根际土壤细菌诱导棉花对大丽轮枝菌抗性的研究[J].中国生物防治,1996,12(1):7-10.
[13] 石磊岩,王波,文学.棉花黄萎病菌落叶型菌系研究[J].棉花学报,1993(1):89-92.
[14] Morenol C,Romerol J,Espejo R T.Polymorphism in repeated 16S rRNA genes is a common property of type strains and environmental isolates of the genusVibrio[J].Microbiology,2002,148:1233-1239.
[15] Schwyn B,Neilands J B.Universal chemical assay for the determination of siderophores [J].Analytical Biochemistry,1987,160:47-56.
[16] 梁建根,吴吉安,竺利红,等.杭州地区黄瓜猝倒病菌产嗜铁素拮抗菌的筛选与评价[J].中国农学通报,2006,22(11):318-322.
[17] Sanei S.Suppression ofVerticilliumwilt of olive byPseudomonasfluorescens[J].American Journal of Experimental Agriculture,2011,1(4):294-305.
[18] Prieto P,Navarro-Raya C,Valverde-Corredor A,etal.Colonization process of olive tissues byVerticilliumdahliaeand its in planta interaction with the biocontrol root endophytePseudomonasfluorescensPICF7[J].Microbial Biotechnology,2009,2:499-511.
[19] Haas D,Defago G.Biological control of soil-borne pathogens by fluorescent pseudomonads [J].Nature Reviews Microbiology,2005,3(4):307-319.
[20] Duijff B J,Meijer J W,Bakker P A H M,etal.Siderophore-mediated competition for iron and induced resistance in the suppression of fusarium wilt of carnation by fluorescentPseudomonasspp.[J].Netherlands Journal of Plant Pathology,1993,99(5/6):277-289.
[21] 梁建根,施跃峰,竺利红,等.恶臭假单胞菌株HZ-2产嗜铁素的发酵条件研究[J].浙江农业学报,2008,20(4):266-269.
[22] Nakata K,Harada N,Sumitomo K,etal.Enhancement of plant stem growth by flocculation of the antibiotic-producing bacterium,PseudomonasfluorescensS272,on the roots[J].Bioscience Biotechnology & Biochemistry,2000,64(3):459-465.
[23] Kloepper J W,Leong J,Teintze M,etal.Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria[J].Nature,1980,286(2):885-886.

