美洲鲥雄性生殖细胞冷冻保存及移植
吴栩灵 洪孝友 李凯彬 朱新平 徐红艳
(1. 中国水产科学研究院珠江水产研究所, 农业部热带亚热带水产资源利用与养殖重点实验室, 广州 510380;2. 上海海洋大学水产与生命学院, 上海 201306)
生殖细胞是生物体中携带物种遗传信息并能传递到子代的一类细胞。其中, 原始生殖细胞(Primordial germ cells, PGCs)、精原干细胞(Spermatogonial stem cells, SSCs)等都具有一定的细胞全能性, 既能增殖, 也可进一步分化而产生配子。因此, 一直以来关于生殖细胞的培养、基因编辑及移植等技术的研究发展应用备受国内外学者的关注,而且生殖细胞相关的操作技术在鼠(Mus musculus)、鸡(Gallus domesticus)及某些模式生物中得到了充足的发展与应用[1,2]。然而, 生殖细胞的培养及移植等技术研究在经济鱼类中的发展应用, 还需要大量的探索; 另一方面, 经济鱼类, 特别是一些大型名贵鱼类的组织材料来源严重稀缺, 阻碍了这些物种生殖细胞相关研究工作的开展。由此可见, 高效的生殖细胞冻存技术, 是进一步开展水产动物生殖细胞工程育种研究的细胞资源保障和技术基础, 同时也是建立物种资源库最直接有效的方法。
目前, 在鱼类、鸟类及哺乳动物中都有不少关于生殖细胞冻存的研究[3—5]。国外学者对虹鳟(Oncorhynchus mykiss)[6,7]、西伯利亚鲟(Acipenser baerii)[8]、细鳞鲑(Brachymystax lenok)[9]等鱼类生殖细胞的冻存进行了相关研究。国内研究人员主要进行了鱼类精子的冷冻保存研究, 如花鲈(Lateolabrax maculatus)[10]、黄姑鱼(Nibea albiflora)[11]、大黄鱼(Pseudosciaena crocea)[12]等鱼类精子的冷冻保存; 也有学者对达氏鲟(Acipenser dabryanus)的精巢细胞[13]和草鱼(Ctenopharyngodon idellus)性腺细胞[14]进行了冷冻保存分析, 并取得了一定的研究进展。迄今为止, 关于细胞冻存的研究主要是对分离细胞或培养细胞进行的冷冻保存分析。而最近,Lee等[6]首次将虹鳟的整个精巢组织进行了冷冻保存, 发现冻存的A型精原干细胞(Type A spermatogonia, ASGs)在冻存728d后仍能具有细胞活力。而且有学者将西伯利亚鲟早期生殖细胞冻存复苏后移植到西德鲟(Acipenser ruthenus)体内, 在移植后90d发现受体中的供体细胞成功增殖, 证明长时间冻存的生殖细胞仍具有分裂增殖活性, 可用于细胞移植研究[8]。总之, 生殖细胞冻存技术无论在物种资源保护, 还是在生物遗传育种研究中均具有非凡的意义。特别是在野生资源的采集过程中, 获得的样品非常随机, 性成熟或性未成熟个体都有可能,如果能研发一种操作简单且能同时保存精原干细胞和精子的冷冻保存技术, 将对野生物种资源的保护更具实践意义。
美洲鲥(American shad,Alosa sapidissima), 隶属于鲱形总目(Clupeomorpha)、鲱形目(Clupeiformes)、鲱科(Clupeidae)、鲥亚科(Alosinae)、西鲱属(Alosa)。美洲鲥是溯河产卵洄游性鱼类的典型代表, 原本分布于加拿大的圣劳伦斯海湾(Gulf of St. Lawrence)到的美国佛罗里达州的约翰河(St.Johns River)一带的河流和海洋, 其后被各地广泛引种[15,16]。在21世纪初期, 美洲鲥引种到中国, 随后其人工繁殖得到迅速发展[17]。美洲鲥与中国鲥鱼(Macrura reevesiiRichardson)同属鲥亚科, 两者除了外形相似, 在营养组成和口感风味上也接近, 因此美洲鲥成为中国鲥鱼的良好替代养殖对象。自美洲鲥引入我国以来, 不少学者进行了相关研究,包括生物学特征[18]、早期发育[19]、人工繁殖[20]、养殖[21]及应激反应[22]等, 但研究工作仅限于组织学、形态学和生理学水平, 而分子细胞水平的生殖生理学研究还非常欠缺。更重要的是, 美洲鲥是溯河产卵洄游性鱼类的典型代表之一, 其采取一年一次产卵繁殖或一年多次产卵繁殖等多种生殖繁育策略, 为解析生殖细胞在鱼类洄游过程中的发育、分化及成熟等提供了独特的研究模型。
因此, 本研究主要进行了美洲鲥雄性生殖细胞的冷冻保存研究。对美洲鲥精巢组织或分离细胞进行了长时间的冷冻保存, 然后快速解冻复苏并统计各期生殖细胞的存活率; 同时, 将冻存复苏后的美洲鲥生殖细胞进行了异种移植分析: 组织块冻存复苏后, 分离得到的细胞经荧光标记后移植到斑马鱼(Danio rerio)仔鱼中, 以进一步检验冻存生殖细胞的活性。本研究结果为美洲鲥及其他洄游性鱼类的生殖细胞培养和应用研究提供了前期基础, 为将来进行鱼类种质资源的保护研究奠定了技术基础。
1 材料与方法
1.1 实验材料
实验用的美洲鲥均采自深圳市东方海科技有限公司的美洲鲥养殖场。于2016年7月取2龄美洲鲥雄鱼4条, 体重580.0—628.0 g。从泄殖腔剪开美洲鲥腹部, 采集精巢组织, 用磷酸盐缓冲液(Phosphate buffered solution, PBS)稍微清洗, 然后放入含有10%胎牛血清(Fetal bovine serum, FBS)的PBS中,将样品带回实验室后进行后续处理。细胞移植的受体为转基因斑马鱼Tg(nano3:yfp)(未发表数据),其PGCs尽管用黄色荧光蛋白标记, 但仍可用绿色荧光波长观察, 因此本研究用绿色荧光观察拍照,PGCs标记信号呈绿色。斑马鱼在正常条件下饲养,产卵后收集胚胎孵化, 孵化出苗后第1天(1 dph,days post hatching)即用作细胞移植受体。实验所用试剂有PI碘化丙啶(Life), Hoechst33342(MP Biomedicals), 细胞筛(BD-Falcon), 胎牛血清和DMEM购自Gibco公司, 二甲基亚砜DMSO、PKH26试剂盒购自Sigma公司, 胶原酶I及胰酶均购自Worthington公司。其余试剂均为国产分析纯。
1.2 实验方法
分离细胞冻存将所取精巢组织剪碎后, 用1 mg/mL胶原酶I, 28℃水浴消化约30min, 加0.25%胰酶继续消化约30min。加入1/10体积牛血清终止消化反应, 用细胞筛过滤并收集细胞, 然后用冻存液重悬细胞并冻存管分装, 慢速降温至–80℃保存1—2d, 然后将样品转移到液氮中进行长期保存。
组织块冻存所取精巢组织剪碎至1 mm3左右, 离心去上清, 冻存液重悬组织, 冻存管分装及冻存(方法同上)。
样品复苏样品冻存250d后, 从液氮中取出并迅速转移到37℃中水浴进行解冻复苏。细胞或组织冻存样品离心后用PBS清洗2遍, 用DMEM重悬备用。冻存复苏的组织块用胰酶/胶原酶消化解离成单个细胞, PBS清洗1遍, 用DMEM重悬细胞备用。
细胞存活率检测将待检测的细胞悬液与等体积的2×染液混合, 使其终浓度为: 5 μg/mL Hoechst33342, 2 μg/mL PI, 室温下避光染色10min;PBS清洗两次; 取100—200 μL样品, 转移到8孔腔室盖玻片, 共聚焦显微镜下观察并拍照, 按照染色结果统计细胞存活率, 每个样品重复3次计数, 实验重复至少3遍。
精子存活率检测取适量待测细胞悬液并稀释到合适浓度, 用蔡司倒置显微镜(Zeiss, Axio Observer Z1)观察、拍摄精子活性并统计精子存活率。另外取少量细胞悬液, 用乙醇处理使精子死亡作为对照, 以消除拍摄精子活动时, 因任何外界因素引起样品震动而导致的误差。
细胞移植将组织块冻存样品所得细胞悬液用PKH26染色, 牛血清终止染色, PBS清洗两遍备用。观察分析受体斑马鱼的内源PGCs和植入供体细胞的发育及分布。移植后斑马鱼仔鱼在正常条件下饲养, 在细胞移植后3h、3d和5d, 通过荧光显微镜观察植入细胞在受体内的存活及整合情况。同时设未移植斑马鱼仔鱼为空白对照组, 同样条件饲养及观察。用尼康荧光体视镜(Nikon,SMZ1270)及奥林巴斯CCD(Olympus, DP73)进行观察和拍照。
2 结果
2.1 两种冻存方法下的细胞存活率
Hoechst33342与PI共染, 正常细胞核能够染上Hoechst33342而呈蓝色。同时, 由于PI不能进入细胞膜完整的正常细胞中, 所以活细胞表现对PI拒染,而坏死细胞核可被PI染色[23]。因此, 活细胞染色结果为蓝色+浅红色或无(Hoechst33342+/PI–), 死细胞为蓝色+亮红色(Hoechst33342+/PI+)。在样品染色后, 在荧光显微镜下观察, 按照核体积的大小及形态, 将细胞粗略分为精原干细胞、精母细胞、精细胞及其他细胞三种规格(图 1)。初步统计发现, 分离细胞冻存复苏后的细胞悬液中, 精原干细胞、精母细胞、精细胞及其他细胞所占比例分别为11.57%、7.55%和80.88%; 而组织块冻存复苏后细胞中, 几种细胞的含量为10.16%、9.65%和80.19%, 两者的细胞构成比例无明显区别。荧光观察拍照后统计各种细胞的存活率(表 1)。在本实验条件下, 分离细胞冻存方法所得的细胞中, 精原干细胞存活率为(34.94±4.36)%、精母细胞存活率为(39.41±4.94)%、精细胞及其他细胞的存活率为(41.00±8.93)%; 在组织块冻存方法所得的细胞中, 精原干细胞存活率为(53.53±12.87)%、精母细胞存活率为(52.84±10.92)%、精细胞及其他细胞的存活率为(48.67±11.13)%。对所得结果进行T检验, 结果显示两种冻存方法处理的精原干细胞存活率存在极显著性差异(P<0.01), 精母细胞存活率存在显著性差异(P<0.05), 而精细胞及其他细胞存活率在2种方法中无显著性差异(表 1)。综上所述, 组织块法冻存复苏获得的精原干细胞和精母细胞的存活率均高于分离细胞冻存法, 尤其是精原干细胞的存活率, 组织块法的显著高于分离细胞的; 而对于精子细胞及其他细胞的存活率, 2种冻存方法的效果相近。因此, 在本实验条件下, 美洲鲥雄性生殖细胞在酶消化法分离细胞前, 将组织块直接冻存的效果比细胞分离后冻存的好, 特别是组织块法冻存复苏的精原干细胞和精母细胞的存活率更高。
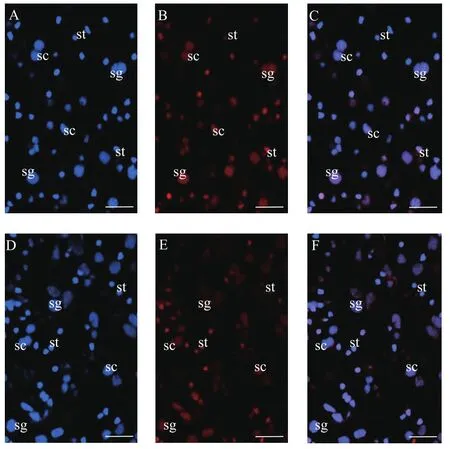
图 1 美洲鲥雄性生殖细胞的核染色Fig. 1 The nuclear staining of male germ cells in American shad
2.2 两种冻存方法下的精子存活率
镜检 2种冻存方法所得的细胞悬液中, 均有大量游动的精子。在显微镜下因光线而呈现不同颜色; 而酒精处理后精子均死亡无游动, 大量精子粘结成团, 沉降到同一平面而颜色基本相同。在解冻复苏后, 分离细胞冻存法所得精子存活率为(87.12±2.56)%, 组织块冻存法所得精子存活率为(93.83±0.62)% (表 1)。对2种方法所得结果进行T检验, 结果显示2种冻存方法处理的精子存活率存在极显著性差异(P<0.01)。因此, 在本实验条件下,美洲鲥精子在酶消化法分离细胞前, 将组织块直接冻存的效果比细胞分离后冻存的好, 精子存活率更高。同时证明, 本实验条件下的冻存液及降温方法可用于美洲鲥精子冻存。
2.3 组织块冻存处理后细胞移植情况
将组织块冻存处理后的细胞复苏后用PKH26染色, 可使细胞在荧光显微镜下呈红色, 而黄色荧光标记的斑马鱼受体内源生殖细胞在绿色荧光下呈绿色信号, 可与供体细胞区分开来(图 2)。移植3h后观察, 供体细胞被注射到斑马鱼受体的生殖嵴附近, 共移植斑马鱼苗34条, 空白对照30条, 移植后观察结果如表 2所示。移植后第3天观察, 斑马鱼受体累计死亡数为19条(55.88%), 存活的15条受体(44.12%)能在显微镜下观察到供体细胞, 且定位在受体生殖嵴, 与受体内源生殖细胞分布在同一区域;有个别受体中的供体细胞迁移到腹部或尾部, 证明所移植的细胞有一定迁移能力。而空白对照组存活数为24条(80.00%)。移植后第5天观察, 斑马鱼受体累计死亡数为21条(61.76%), 存活13条(38.24%),此时3条受体能观察到供体细胞和受体内源生殖细胞定位于同一区域, 且有些供体细胞迁移到腹部或尾部; 4条受体能观察到供体细胞分布在腹部和尾部, 而未分布在受体内源生殖细胞的区域; 6条受体中未能观察到供体细胞, 与空白对照组的观察结果一致。而空白对照组存活数为23条(76.67%), 此时发现斑马鱼有自发红色荧光, 但仍能与供体细胞的红色荧光区分开来。移植实验证明, 此实验条件下将美洲鲥成熟精巢剪碎后进行组织块直接冻存,解冻复苏后所得雄性生殖细胞仍可以用于异种移植。
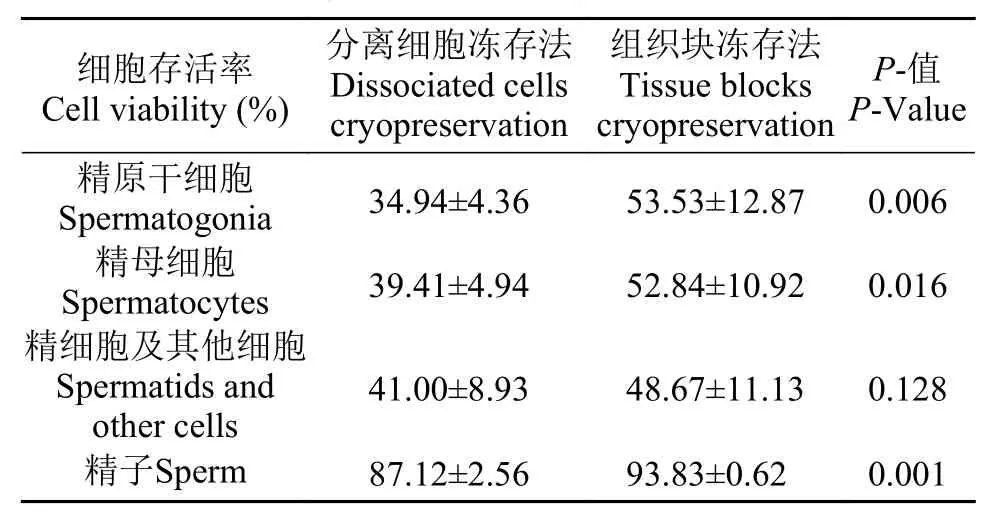
表 1 美洲鲥生殖细胞存活率Tab. 1 The germ cells viability of American shad
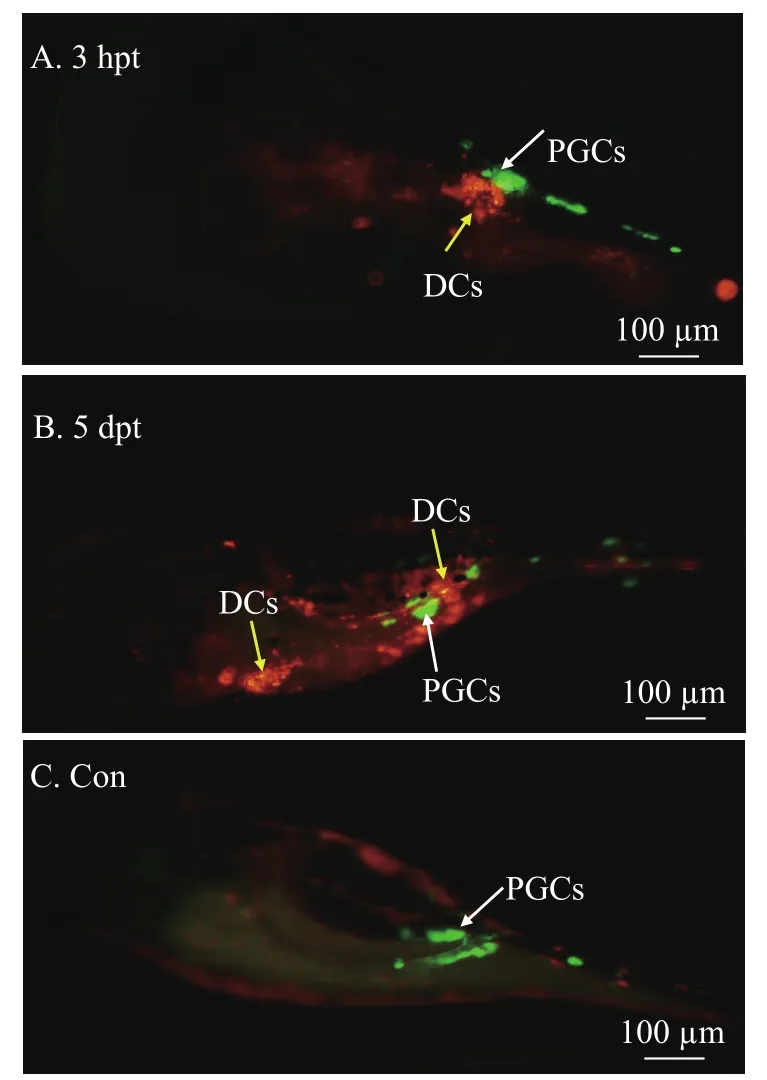
图 2 美洲鲥雄性生殖细胞移植到斑马鱼仔鱼Fig. 2 American shad male germ cells transplanted into zebrafish larvae

表 2 美洲鲥雄性生殖细胞移植情况Tab. 2 Transplantation of American shad male germ cells
3 讨论
3.1 不同冻存方法对精巢细胞存活率的影响
生殖细胞在冷冻保存复苏后的存活率受多种因素影响, 包括样品处理、冻存液的选择、冻存温度、冻存时间、降温及复苏速率等。常见的细胞冻存方法都是将分离或培养的游离细胞进行冻存及复苏, 再用于其他实验研究。而在本研究中, 除了将分离细胞进行冻存, 还进行了精巢组织块的直接冷冻保存, 以探索有效保存美洲鲥精巢细胞的方法。更重要的是, 本研究中采用的冻存方法能同时保存各期生殖细胞, 优于只能进行单一细胞保存的传统方法, 即精子保存[24]或精原干细胞保存[25]。在此, 比较分析了2种方法的冻存效果, 结果表明组织块冻存法, 冻存复苏获得的精原干细胞和精母细胞的存活率更高, 而精细胞及其他细胞存活率无显著性差异。与此类似, 其他研究组报道的西伯利亚鲟性腺组织和性腺细胞2种冻存方法的比较研究, 表明组织冻存复苏后分离获得的细胞中, 包含的死细胞较少[8]。在斑马鱼PGCs冻存研究中, Higaki等[3]比较了不同预处理液和玻璃化冻存保护剂的冷冻效果, 最适冷冻条件下斑马鱼PGCs的存活率可达81%, 而且复苏后的PGCs仍能进一步分化而产生功能性配子, 证明了冻存的生殖细胞可用于细胞移植研究。另外, 在细胞生物学研究中, 一般采用台盼蓝染色法进行细胞活性的检测分析[7]。但有研究发现台盼蓝染色法不适合于某些细胞的活力测定, 如朱冬发等[26]在检测三疣梭子蟹(Portunus trituberculatus)精子的活力时采用台盼蓝染色无法清晰辨别死、活精子; Stoll等[27]测定人肺微血管内皮细胞(Human pulmonal endothelial cell, HPMEC)在冻存后复苏的细胞存活率, 认为台盼蓝染色会使结果偏高。而有研究表明Hoechst33342/PI双染可简单快捷地区分正常细胞、凋亡细胞和坏死细胞, 且特异性高, 简单易行[23]。因此, 本研究采用Hoechst33342与PI共染细胞核的方法来检测生殖细胞存活率。美洲鲥细胞经Hoechst33342和PI染色后, 各期生殖细胞核均清晰可见, 大小分明, 且Hoechst33342使全部细胞染色而PI能明显将死活细胞区分开来(图1), 证明细胞核Hoechst33342/PI双染法适合于进行冻存复苏的美洲鲥生殖细胞存活率的检测。
3.2 不同冻存方法对精子存活率的影响
精子冻存也是常见的种质资源保存方法, 此前已有研究者进行了美洲鲥精子冻存的研究分析。例如, 王明华等[24]用鱼用任氏液和甲醇配成冻存液,精液稀释后采用三步法降温并于液氮中冻存, 60d后复苏发现精子存活率达80%, 同时冻存液的甲醇比例、冷冻前平衡时间及精液稀释比均对保存效果有不同程度的影响。与传统的精液冻存方法不同的是, 本研究通过直接冻存成鱼精巢组织以进行精子的冷冻保存, 冻存步骤简单易行, 重要的是本冻存方法所得精子存活率达93.83%, 且样品冻存时间长达~250d, 冻存精子的存活率仍远高于已有的报道结果[24]。此结果的获得, 可能是因为样品处理方法、冻存液成分和降温程序等优化所致, 但具体原因仍需进一步研究分析来验证。研究所用DMSO为常见的冻存保护剂, 在黄姑鱼[11]、大黄鱼[12]和黑鲷(Sparus macrocephalus)[28]的精子冻存实验中, 均发现DMSO浓度为10%时冻存精子的质量最好, 其中黄姑鱼精子激活率达85.25%, 黑鲷冻精激活率达92.91%, 特别是10% DMSO的条件下, 大黄鱼冻精复苏后其活力、DNA损伤和线粒体及细胞膜结构保持完整性的精子比例, 与鲜精相比无明显差异。因此, 本研究中冻存液DMSO浓度为10%, 但进行美洲鲥生殖细胞冻存的最佳浓度还需另行验证。
3.3 冷冻保存精巢细胞的应用潜能
冻存复苏的细胞可进一步用于细胞培养、基因编辑及细胞移植等研究中, 因此, 有效的细胞冻存方法是物种资源保存研究中的重要技术。在鱼类中, 已有研究报道, 将冻存复苏的早期生殖细胞成功移植到异种不育受体中, 使受体产生供体细胞来源的功能性配子[8]。在研究中, 发现组织块冻存法, 获得的精原干细胞存活率更高, 更适合于进行生殖细胞的种间移植。细胞植入受体5d后仍能在斑马鱼受体内检测到供体细胞, 证明冻存复苏的细胞依旧具有增殖及发育活性, 而且具有一定的迁移整合到受体性原基的能力。与此类似, Lee等[6]将虹鳟精巢组织进行了冻存, 解冻后将A型精原干细胞移植到同种三倍体鱼中也能获得供体来源的配子。
综上所述, 本文进行了美洲鲥精巢细胞的冷冻保存、复苏、活性检测等技术的研究, 发现组织块冻存方法所得到的细胞存活率更高, 尤其是早期生殖细胞的成活率比较高, 更适合于进一步进行细胞移植研究。此外, 组织块冻存法由于样品前期处理简便, 更适合于野外资源的采集与保护。但美洲鲥生殖细胞的最适冻存条件及移植效果等需要更进一步的长期观察及研究才能确定。本研究结果为将来开展水产动物生殖细胞工程育种及物种种质资源保护等研究奠定了技术基础。
参考文献:
[1] Xu H Y, Li M Y, Gui J F,et al. Fish germ cells [J].Science China Life Sciences, 2010, 53(4): 435—446
[2] Yi M S, Hong N, Li Z D,et al. Medaka fish stem cells and their applications [J].Science China Life Sciences,2010, 53(4): 426—434
[3] Higaki S, Kawakami Y, Eto Y,et al. Cryopreservation of zebrafish (Danio rerio) primordial germ cells by vitrefication of yolk-intact and yolk-depleted embryos using various cryoprotectant solutions [J].Cryobiology, 2013,67(3): 374—382
[4] Tonus C, Connan D, Waroux O,et al. Cryopreservation of chicken primordial germ cells by vitrification and slow-freezing: a comparative study [J].Theriogenology,2017, 88: 197—206
[5] Fujiwara K, Kamoshita M, Kato T,et al. Generation of rats from vitrified oocytes with surrounding cumulus cells via in vitro fertilization with cryopreserved sperm [J].Animal Science Journal, 2017, 88(1): 180—184
[6] Lee S, Iwasaki Y, Shikina S,et al. Generation of functional eggs and sperm from cryopreserved whole testes[J].PNAS, 2013, 110(5): 1640—1645
[7] Lee S, Katayama N, Yoshizaki G. Generation of juvenile rainbow trout derived from cryopreserved whole ovaries by intraperitoneal transplantation of ovarian germ cells[J].Biochemical and Biophysical Research Communications, 2016, 478(3): 1478—1483
[8] Pšenička M, Saito T, Rodina M,et al. Cryopreservation of early stage Siberian sturgeonAcipenser baeriigerm cells, comparison of whole tissue and dissociated cells [J].Cryobiology, 2016, 72(2): 119—122
[9] Lee S, Yoshizaki G. Successful cryopreservation of spermatogonia in critically endangered Manchurian trout(Brachymystax lenok) [J].Cryobiology, 2016, 72(2):165—168
[10] Shi Y X, Cheng S, Zhu J Q,et al. Sperm cryopreservation and enzyme activity detection inLateolabrax maculatus[J].Acta Hydrobiologica Sinica, 2015, 39(6):1241—1247 [史应学, 程顺, 竺俊全, 等. 中国花鲈精子的超低温冷冻保存及酶活性检测. 水生生物学报, 2015,39(6): 1241—1247]
[11] Jin C H, Yan J Q, Zhu J Q,et al. Sperm cryopreservation and the cytoarchitecture damage detection inNibea albiflora[J].Journal of Fisheries of China, 2011, 35(6):846—853 [金春华, 闫家强, 竺俊全, 等. 黄姑鱼精子的超低温冻存及细胞结构损伤的检测. 水产学报, 2011,35(6): 846—853]
[12] Jiang J H, Yan J Q, Zhu J Q,et al. Sperm cryopreservation and the cytoarchitecture damage detection ofPseudosciaena crocea[J].Journal of Agricultural Biotechnology, 2011, 19(4): 725—733 [姜建湖, 闫家强, 竺俊全, 等. 大黄鱼精子的超低温冻存及细胞结构损伤的检测. 农业生物技术学报, 2011, 19(4): 725—733]
[13] Xie X, Li P, Xi M D,et al. Digestion, isolation and cryopreservation of testicular cells from Dabry sturgeon(Acipenser dabryanus) [J].Freshwater Fisheries, 2016,46(5): 19—24 [颉璇, 厉萍, 席萌丹, 等. 达氏鲟精巢细胞消化分离和超低温冷冻保存. 淡水渔业, 2016, 46(5):19—24]
[14] Zhu X, Chi Y, Wang H,et al. Comparison of cryopreserved effect between epithelioma papulosum cyprinid ofCyprinus carpioand grass carp ovary cell lines [J].Chinese Journal of Biologicals, 2010, 23(4): 381 [朱霞,迟源, 王好, 等. 鲤鱼上皮瘤细胞和草鱼性腺细胞冻存效果的比较. 中国生物制品学杂志, 2010, 23(4): 381]
[15] Elzey S P, Rogers K A, Trull K J. Comparison of 4 aging structures in the American shad (Alosa sapidissima) [J].Fishery Bulletin- National Oceanic and Atmospheric Administration, 2015, 113(1): 47—54
[16] Tang G P, Huang A Q, Wei Q W. The resource fluctuations and restoration of American shad (Alosa sapidissima) [J].Journal of Hydroecology, 2010, 3(1):130—134 [唐国盘, 黄安群, 危起伟. 美洲鲥的资源变动及修复. 水生态学杂志, 2010, 3(1): 130—134]
[17] Gao X Q, Liu Z F, Guan C T,et al. Developmental changes in digestive enzyme activity in American shad,Alosa sapidissima, during early ontogeny [J].Fish Physiology & Biochemistry, 2017, 43(2): 397—409
[18] Du H, Wei Q W. Biology characteristics and resources status of America shad [J].Freshwater Fisheries, 2004,34(1): 62—64 [杜浩, 危起伟. 美洲鲥的生物学特征及资源状况. 淡水渔业, 2004, 34(1): 62—64]
[19] Hong X Y, Zhu X P, Chen K C,et al. Study on the development of the embryo and larva of American shad,Alosa sapidissima[J].Acta Hydrobiologica Sinica, 2011, 35(1):153—162 [洪孝友, 朱新平, 陈昆慈, 等. 美洲鲥胚胎及仔稚鱼的发育. 水生生物学报, 2011, 35(1): 153—162]
[20] Xu G C, Zhang C X, Zheng J L,et al. Artificial propagation and embryonic development of American shad,Alosa sapidissima[J].Marine Sciences, 2012, 36(7): 89—96[徐钢春, 张呈祥, 郑金良,等. 美洲鲥的人工繁殖及胚胎发育的研究. 海洋科学, 2012, 36(7): 89—96]
[21] Hong X Y, Chen K C, Li K B,et al. Experiment of cage culture in reservoir of American shad,Alosa sapidissima[J].Journal of Aquaculture, 2014, 35(2): 8—9 [洪孝友,陈昆慈, 李凯彬, 等. 水库网箱美洲鲥养殖试验. 水产养殖, 2014, 35(2): 8—9]
[22] Zhang Y, Xu G C, Du F K,et al. Effects of acute handling stress on serum biochemical parameters andHSP70 gene expression inAlosa sapidissima broodstocks[J].Journal of Shanghai Ocean University, 2016, 25(5):652—658 [张勇, 徐钢春, 杜富宽, 等. 急性操作胁迫对美洲鲥亲鱼血清生化指标及HSP70基因表达的影响. 上海海洋大学学报, 2016, 25(5): 652—658]
[23] Yang X F, He C E, Tang R H,et al. A comparative study on the measurement of neuronal cell apoptosis by Hoechst33342/PI double staining and TUNEL assay [J].Carcinogenesis Teratogenesis & Mutagenesis, 2014,26(3): 180—184 [杨细飞, 贺春娥, 汤瑞华, 等.Hoechst33342/PI双染法和TUNEL染色技术检测神经细胞凋亡的对比研究. 癌变 畸变 突变, 2014, 26(3):180—184]
[24] Wang M H, Chen Y M, Ding S Y,et al. Studies on sperm cryopreservation technology of American shad,Alosa sapidissima[J].Jiangsu Agricultural Sciences, 2015,43(7): 250—251 [王明华, 陈友明, 丁淑燕, 等. 美洲鲥鱼精子超低温冷冻保存技术初探. 江苏农业科学, 2015,43(7): 250—251]
[25] Linhartová Z, Rodina M, Guralp H,et al. Isolation and cryopreservation of early stages of germ cells of tench(Tinca tinca) [J].Czech Journal of Animal Science, 2014,59(8): 381—390
[26] Zhu D F, Zhou S. Viability assessment of spermatozoa in the swimming crabPortunus trituberculatus[J].Journal of Fisheries of China, 2008, 32(5): 765—771 [朱冬发, 周帅. 三疣梭子蟹精子活力的评价方法. 水产学报, 2008,32(5): 765—771]
[27] Stoll C, Hofmann N, Bernemann I,et al. Systematic optimisation of parameters for cryopreservation of human pulmonal endothelial cells (HPMEC): Difference in cell survival rates analyzed by recultivation vs. trypanblue staining [J].Cryobiology, 2008, 57(3): 337—338
[28] Ye T, Zhu J Q, Yang W X,et al. Sperm cryopreservation inSparus macrocephalusand DNA damage detection with SCGE [J].Zoological Research, 2009, 30(2):151—157 [叶霆, 竺俊全, 杨万喜, 等. 黑鲷精子的超低温冻存及DNA损伤的SCGE检测. 动物学研究, 2009,30(2): 151—157]

