利用CRISPR /CAS9技术构建QKI敲除GC1-spg细胞株及其生物学功能检测
钟顺顺,李 凯,杨 阳,缪时英,王琳芳,宋 伟
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 医学分子生物学国家重点实验室,北京 100005)
近年来,CRISPR/Cas9技术应用于细胞、动物和植物等方面的研究,对生命科学的研究有重要意义,它相比于传统的基因编辑——锌指核酸酶(zinc-finger nucleases,ZFN)和转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALEN),更加精准和高效[1]。
QKI(quaking, QKI)是一类RNA结合蛋白质,可通过选择性剪切可转录产生QKI5、QKI6和QKI7 3种转录本,都具有同源的KH结构域[2]。目前,QKI的研究主要集中在神经、 心血管系统等研究领域[3- 5]。在生殖领域,QKI突变的雄性小鼠不育,其睾丸组织切片中几乎没有精子的存在,附睾组织中仅有精子头部和尾部畸形的无运动能力的精子[6],表明QKI在精子发生中也有重要作用。
目前关于QKI在精子发生中的功能与机制的研究较少,本研究利用CRISPR/Cas9技术成功构建了GC1-spg细胞系的QKI基因中与RNA结合的KH结构(K Homology domain, KH)的敲除细胞株,并从细胞增殖、分化等方面初步探索QKI在精子发生中的可能功能,为深入揭示QKI蛋白在精子发生中的功能和机制奠定基础。
1 材料与方法
1.1 材料
小鼠精原细胞系GCI-spg(本课题组保存);真核表达质粒px330-U6-Chimeric_BB-CBh-hSpCas9(本实验室保存);转染所用试剂Lipofectamine(Invitrogen公司);胎牛血清(Gibco-BRL公司);DMEM培养基(Hyclone公司);gRNA序列(擎科生物科技有限公司合成);anti-QKI抗体(Millipore公司);anti-Tubulin抗体和嘌呤霉素(Sigma-Aldrich公司);辣根过氧化物酶标记的抗小鼠;兔IgG(北京中杉金桥生物技术有限公司);Cell Counting Kit- 8(同仁化学研究所);Transcriptor First Strand cDNA Synthetsis Kit(Roche公司);TransStart Tip Green qPCR Super Mix(Transgen Biotech公司)。
1.2 方法
1.2.1 敲除靶点的设计及QKI的测序引物设计:利用麻省理工学院的CRISPR Design:http://crispr.mit.edu/设计QKIDNA区域的一对oligoDNAs,根据得分高低选择合适的一对引导RNA序列。同时,在QKI敲除区域的上下游选择合适的位置设计测序引物,用于后续的PCR鉴定和测序检测。
1.2.2 质粒和重组体的构建:将合成的两条oligo DNAs按照上游下游各100 pmol的比例进行100 ℃反应10 min,后自然降温退火至室温,形成双链DNA,与PX330质粒用T4连接酶连接,进而转化DH5α感受态细胞,筛选出阳性克隆,进行测序确认后,提取质粒备用。
1.2.3 细胞转染及单克隆的筛选:根据GC1-spg细胞的特征,选择Lipofectamine做转染试剂,按照其说明书提供的方法进行转染细胞,待质粒表达36 h后,用加入3 mg/L嘌呤霉素,待阴性对照中细胞完全死亡,停止加药,待细胞长到适当数量,进行单克隆分选,挑选有效单克隆细胞,扩大培养至可用来DNA测序和Western blot验证。
1.2.4 Western blot检测蛋白的表达:将构建成功的PX330重组表达质粒转化GC1-spg细胞,培养48 h后,收取细胞,用1×SDS裂解液(50 μL 1 mol/L Tris-HCl pH 6.8, 125 μL 80%甘油, 10% SDS, 625 μL H2O)裂解细胞样品,致使细胞呈黏稠透明液体,100 ℃变性10 min,后用BCA法进行蛋白定量。SDS-PAGE电泳,分离蛋白,用320 mA进行恒流转膜,后用相应的各抗体进行检测。
1.2.5 CCK8测量增殖曲线:在96孔板中种植一定数量(1 000个)细胞,12 h后待细胞完全贴壁后,加入10% CCK8检测液和90% DMEM完全培养基的混合液。将细胞置于培养箱孵育75 min后,检测450和630 nm处吸光度值,检测细胞增殖情况。
1.2.6 q-PCR对mRNA水平的检测:利用 Trizol法提取细胞中的总RNA,后用Transcriptor First Strand cDNA Synthetsis Kit进行反转录,再进行荧光定量PCR检测c-kit、Stra8、Lhx8、Hspa2、Zfp42和Mtl5的相对表达量。
1.3 统计学分析

2 结果
2.1 构建GC1-spg的QKI敲除细胞株
2.1.1 靶点设计示意图:QKI基因敲除靶点位置(图1),敲除靶点序列长度为20 bp,1#靶点和2#靶点分别位于KH的+67到+86处和+13到+32处(1#靶点序列为:5′-GGATGTAAAATAATGGTCCG-3′,2#靶点序列为:5′-GGGAGAATCCTTGGACCTAG-3′)
2.1.2 Western blot与测序验证敲除细胞株:获得1#靶点单细胞株3株,2#靶点单细胞株3株,Western blot检测结果(图2A),其中1#06测序结果(图2B)得到GTCCGAG碱基缺失突变体,测序峰图结果(图2C)表明突变细胞株是在该区域因碱基缺失造成移码突变。后续功能检测实验均选择1#06进行实验。
2.2 QKI对GC1-spg细胞增殖与分化的影响
2.2.1 QKI蛋白对于细胞增殖的影响:测定QKI敲除成功的细胞株增殖曲线结果(图3),实验组Cas-QKI细胞增殖明显慢于对照组(P<0.05)。

图1 QKI基因敲除靶点Fig 1 Diagram of QKI gene target site
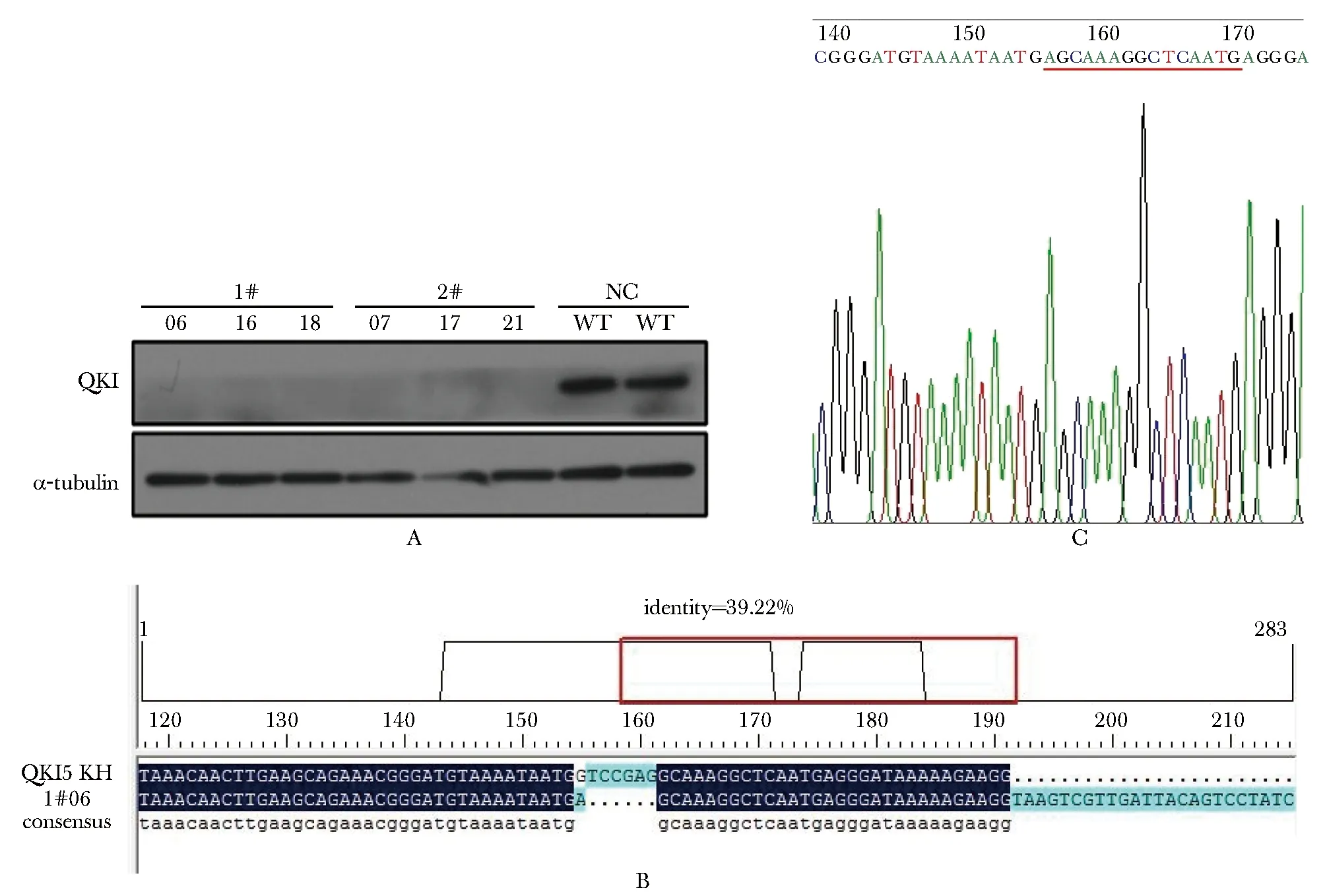
A.cells were collected for Western blot; B,C.cells were collected for PCR, and B.sequence PCR product compared with wild type, C.sequencing peak map, the red line marked the mutation
图2敲除细胞株的鉴定
Fig2Identificationoftheknock-outcellstrain
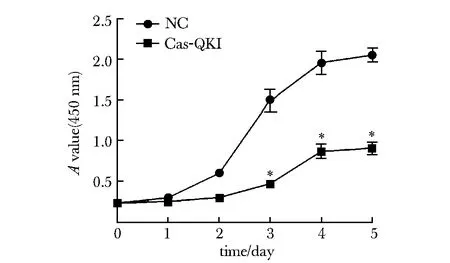
*P<0.05 compared with control group图3 CCK8检测QKI对细胞增殖的影响Fig 3 CCK8 method was used to detect the proliferation of QKI-knocking out cells
2.2.2 QKI蛋白对于细胞分化的影响:检测减数分裂相关分子标志基因的表达水平,发现实验组c-kit、Mtl5的表达量相较于对照组有显著降低(P<0.01),Hspa2表达量也低于对照组(P<0.05)(图4)。
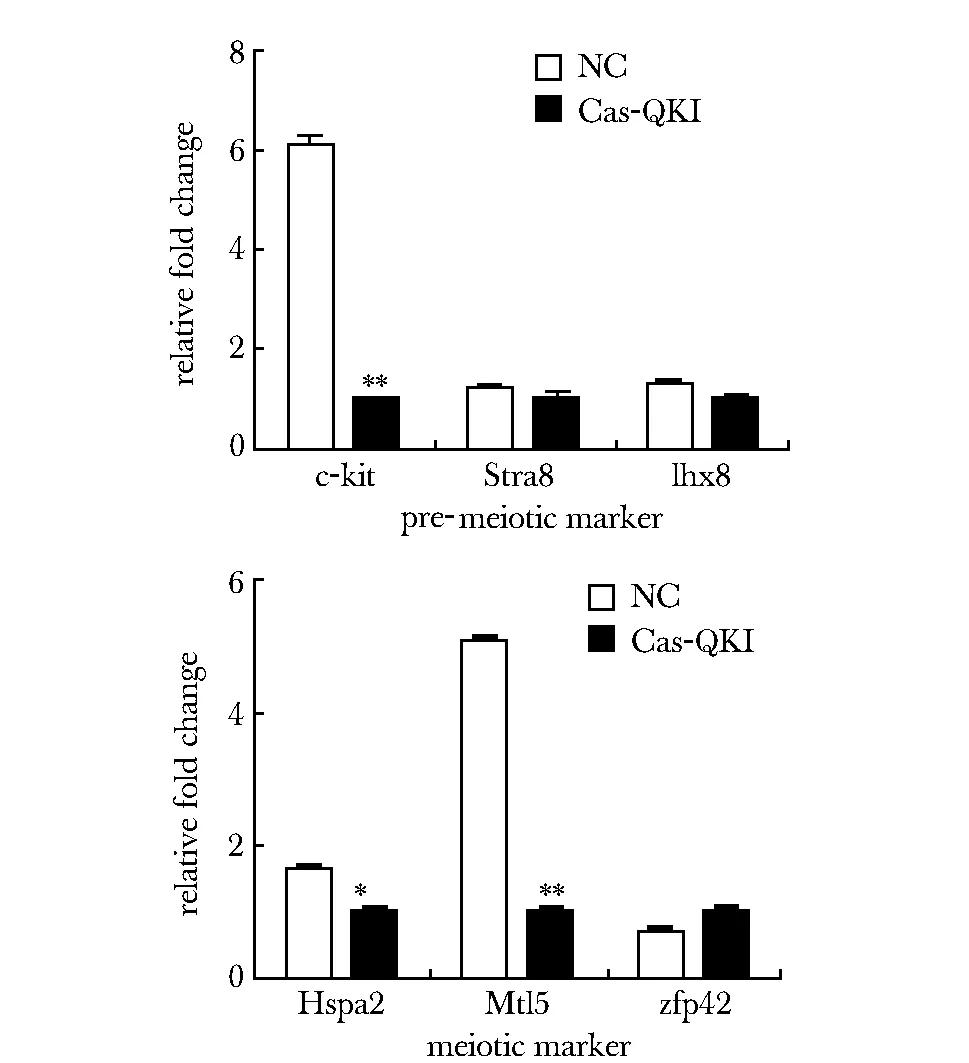
*P<0.05, **P<0.01 compared with control group图4 QKI蛋白对细胞进入减数分裂的影响Fig 4 Effect of QKI protein on cells’ meiosis
3 讨论
在体外机制的研究中,常用RNA干扰(RNA interference, RNAi)进行基因沉默,影响蛋白质表达,但是由于siRNA的持续作用时间较短,一般传代2~3代就会失效,而且受细胞的转染效率和状态影响大,靶点的敲低效率也不稳定,同时对于一些周期比较长的实验不适用,所以本研究选择利用CRISPR/Cas9构建稳定细胞株,可以解决RNAi的技术弊端。
由于QKI有3个转录本,就其序列进行分析,其3个转录本高度同源,仅在3′端氨基酸序列与个数不同,其QUA结构域具有介导信号传导的作用;KH可以与RNA结合,通过与RNA结合参与生物学过程。本研究利用CRISPR/Cas9技术对GC1-spg细胞的QKI进行KH结构域定点敲除,共筛出6株单细胞(1#靶点3株,2# 靶点3株)。CRISPR/Cas9技术虽然持续周期较长(2个月左右),但是其敲除效率高,构建出的细胞株可以稳定缺失QKI,构建成功的细胞株不会因为传代次数增多而恢复,所以可以为体外功能与机制研究提供合适的细胞模型。
目前QKI在精子发生中的功能与机制的研究较少,本研究利用上述构建的QKI敲除细胞模型,初步观察了该基因对生精细胞的增殖和分化的影响。
由上述实验结果得出QKI可以影响细胞增殖;在检测c-kit、Stra8和Lhx8这些减数分裂早期关键分子[7- 8]与 Hspa2、Zfp42和Mtl5 等减数分裂后期的关键分子[9- 10]时,c- kit、Mtl5和Hspa2的表达量变化都提示了QKI蛋白在精子发生过程中具有重要作用;这些将为深入揭示QKI蛋白在精子发生中的功能奠定了良好基础。
但是精子发生是一个特殊的分化过程,涉及生物学过程很多,而目前生精细胞在体外的培养和继续减数分裂难度大,本研究中选择的GC1-spg也仅是永生化的精原细胞株,不能全面代表精子发生的整个过程,所以要真正阐释QKI蛋白在精子发生中的功能表型与详细机制,还需进一步结合体内的功能研究。
参考文献:
[1] Sander JD, Joung JK. CRISPR-Cas systems for editing, regulating and targeting genomes[J]. Nat Biotechnol, 2014, 32: 347- 355.
[2] Teplova M, Hafner M, Teplov D,etal. Structure-function studies of STAR family Quaking proteins bound to theirinvivoRNA target sites[J]. Genes Dev, 2013, 27: 928- 940.
[3] Busse TM, Roth JJ, Wilmoth D,etal. Copy number alterations determined by single nucleotide polymorphism array testing in the clinical laboratory are indicative of gene fusions in pediatric cancer patients[J]. Genes Chromosomes Cancer, 2017, 56: 730- 749.
[4] Hayakawa-Yano Y, Suyama S, Nogami M,etal. An RNA-binding protein, Qki5, regulates embryonic neural stem cells through pre-mRNA processing in cell adhesion signaling[J]. Genes Dev, 2017, 31: 1910- 1925.
[5] Ramkissoon SH, Bandopadhayay P, Hwang J,etal. Clinical targeted exome-based sequencing in combination with genome-wide copy number profiling: precision medicine analysis of 203 pediatric brain tumors[J]. Neuro Oncol, 2017, 19: 986- 996.
[6] Yanagimachi R, Wakayama T, Kishikawa H,etal. Production of fertile offspring from genetically infertile male mice[J]. Proc Natl Acad Sci U S A, 2004, 101: 1691- 1695.
[7] Feng CW, Bowles J, Koopman P. Control of mammalian germ cell entry into meiosis[J]. Mol Cell Endocrinol, 2014, 382: 488- 497.
[8] Mithraprabhu S, Loveland KL. Control of KIT signalling in male germ cells: what can we learn from other systems?[J]. Reproduction, 2009, 138: 743- 757.
[9] Govin J, Caron C, Escoffier E,etal. Post-meiotic shifts in HSPA2/HSP70.2 chaperone activity during mouse spermatogenesis[J]. J Biol Chem, 2006, 281: 37888- 37892.
[10] Sugihara T, Wadhwa R, Kaul SC,etal. A novel testis-specific metallothionein-like protein, tesmin, is an early marker of male germ cell differentiation[J]. Genomics, 1999, 57: 130- 136.

