miRNA-146b-3p在早期非小细胞肺癌中的诊断价值
沙 杰, 范理宏
(1. 南京医科大学,南京 211166; 2. 同济大学附属第十人民医院呼吸科,上海 200072)
肺癌是全球范围内致死率最高的恶性肿瘤,每年造成120万人的死亡,其中非小细胞肺癌占到了80%~85%。而在我国,肺癌已成为男性恶性肿瘤发病率首位,女性的第二位。其总体5年存活率低至15%。若能在早期被及时诊断与干预的话,其5年存活率能显著提高至61%~90%[1-2]。但不幸的是,多数患者由于缺乏有效的早期诊断,约75%的患者在肿瘤晚期出现症状时才得到相应治疗,早已错过了最佳治疗时期。所以如何在肺癌早期对患者作出及时的诊断成为重中之重。
临床工作中的重点难点是对于肺部结节良恶性鉴别,单一通过影像学表现易出现假阴性结果,延误患者最佳治疗时机。现阶段病理活检是肺癌诊断的金标准,例如影像引导下的肺穿刺和支气管镜活检,但这类有创检查对患者存在潜在的风险。现有的肿瘤标志物灵敏度及特异性都无法达到临床要求。所以一种更理想的检查方法有待被发现,它应具有无创、高灵敏度、高特异性、简单方便等特性。Micro RNAs(miRNAs)是一类长度为20~24个核苷酸的非编码小分子RNA,与肿瘤的发生、转移和耐药等密切相关。多项研究已证实miRNAs具有肿瘤抑制或促进的作用[3-5]。研究发现血清/血浆中存有miRNAs,称为循环miRNAs。循环miRNAs能以Ago2-miRNA蛋白复合物的形式稳定存在于血浆中而逃避RNase降解。故通过对比肿瘤患者与健康人循环血中的miRNAs表达谱,对不同肿瘤中miRNAs的特异性表达谱进行鉴定,将有助于肿瘤的早期诊断[6]。本课题组前期研究[7]通过对非小细胞肺癌病例与健康人病例的血清miRNAs表达谱分析,筛选出了具有诊断价值的miRNAs。本次研究基于以上结果,进一步检测118例早期非小细胞肺癌、42例肺部良性结节、48例健康人的6种(miR-15b-5p、miR-17-5p、miR-19a-3p、miR-20a-5p、miR-92a-3p、miR-146b-3p)循环血miRNAs表达水平,并分析其相关诊断价值。
1 资料与方法
1.1 资料收集
本研究获得同济大学附属第十人民医院伦理委员会批准。所有入组病例血样与临床资料均收集于同济大学附属第十人民医院2015年10月至2016年4月间。肺结节病例采集于胸外科及呼吸科所有拟行手术或活检且影像学最大直径≤30mm的肺结节患者,共计250例,于术前1~2周采集血样,待确定其病理诊断后筛选入组。最终非小细胞肺癌入组118例,良性结节入组42例。非小细胞肺癌组中腺癌110例,鳞癌8例,见图1。入组标准包括: (1) 病理诊断;(2) 结节直径≤30mm;(3) 入组分期为T1N0M0(第8版肺癌分期);(4) 无其他肿瘤史;(5) 未进行放化疗;(6) 肺内无活动性炎症。良性结节组包括25例肉芽肿性结节、11例错构瘤等。健康人血样收集于体检人群,共48例经确诊均无肺内活动性炎症或任何相关肿瘤疾病。样本在性别、年龄、吸烟史方面差异无统计学意义,见表1。样本于晨间空腹采集5ml全血,4℃,离心半径5.8cm,3000r/min,离心15min,提取血清-80℃冰箱保存。
1.2 方法
本次研究使用miRNeasy Serum/Plasma kit (QIAGEN, 德国)RNA提取试剂盒,按照使用手册从200μL血清中提取14μL总RNA,并使用NanoDrop 2000微量分光光度计测定其浓度与纯度。miRNAs反转录试剂盒(灏勤生物)反转录得到20μL cDNA,其反应体系包括dNTP 4μL,反转录缓冲液4μL,特定缓冲液4μL,茎环引物1μL,总RNA 5μL,加RNase-Free水补足至20μL。使用Eppendorf MCpro设定反转录程序为42℃孵育40min,70℃孵育15min。下步使用miRNAs荧光定量检测试剂盒(灏勤生物)进行RT-PCR。其反应体系包括缓冲液10μL,探针和引物预混液1μL,cDNA 1μL,加RNase-Free水补足至20μL。使用ABI 7900实时荧光定量PCR按照95℃ 30s、95℃ 5s、60℃ 30s、45个循环进行扩增。
1.3 统计学处理
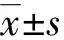
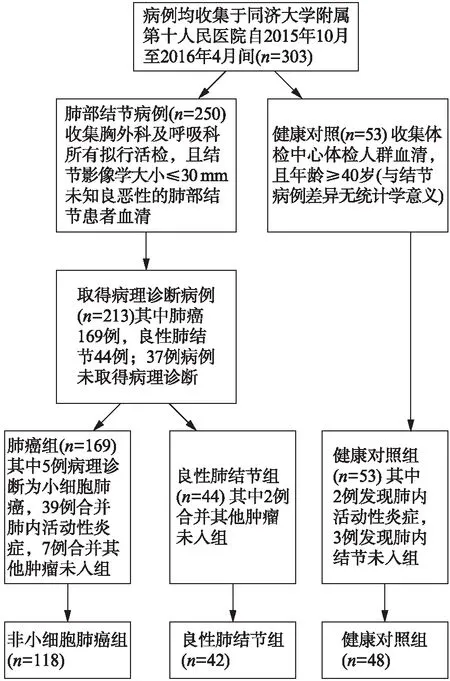
图1 研究对象入组流程图Fig.1 Flow chart of research objects

项目非小细胞肺癌良性结节P值健康人P值n1184248性别0 800 47 男502219 女682029年龄/岁57 08±12 1953 31±11 350 0659 21±9 190 22 ≥60531320 <60652928吸烟史0 300 41 是25713 否933535组织分型 腺癌110 鳞癌8 肉芽肿25 错构瘤11 其他6
2 结 果
2.1 miRNAs表达
结果显示5种miRNAs(miR-15b-5p、miR-17-5p、miR-19a-3p、miR-92a-3p、miR-146b-3p)在非小细胞肺癌与良性结节中有表达差异,同时5种miRNAs(miR-15b-5p、miR-17-5p、miR-19a-3p、miR-20a-5p、miR-146b-3p)在非小细胞肺癌与健康人中表达差异有统计学意义,见表2。
2.2 Logistic回归
将上述具有差异表达的miRNAs进行单因素Logistic回归分析,结果表明在非小细胞肺癌与良性结节组中: miR-17-5p、miR-19a-3p、miR-146b-3p具有显著的预测性;同时在非小细胞肺癌与健康人组中: miR-15b-5p、miR-17-5p、miR-19a-3p、miR-20a-5p、miR-146b-3p具有显著预测性,见表3。
进一步将肺癌与良性结节组通过多因素Logistic回归分析计算,得出年龄与miR-146b-3p为相关独立危险因素,Logistic回归公式为Logit(P)=1.16×年龄+1.76×miR-146b-3p;同理得出肺癌与健康人组中miR-19a-3p与miR-146b-3p为相关独立危险因素,Logistic回归公式为Logit(P)=3.39×miR-19a-3p+5.57×miR-146b-3p,见表4。
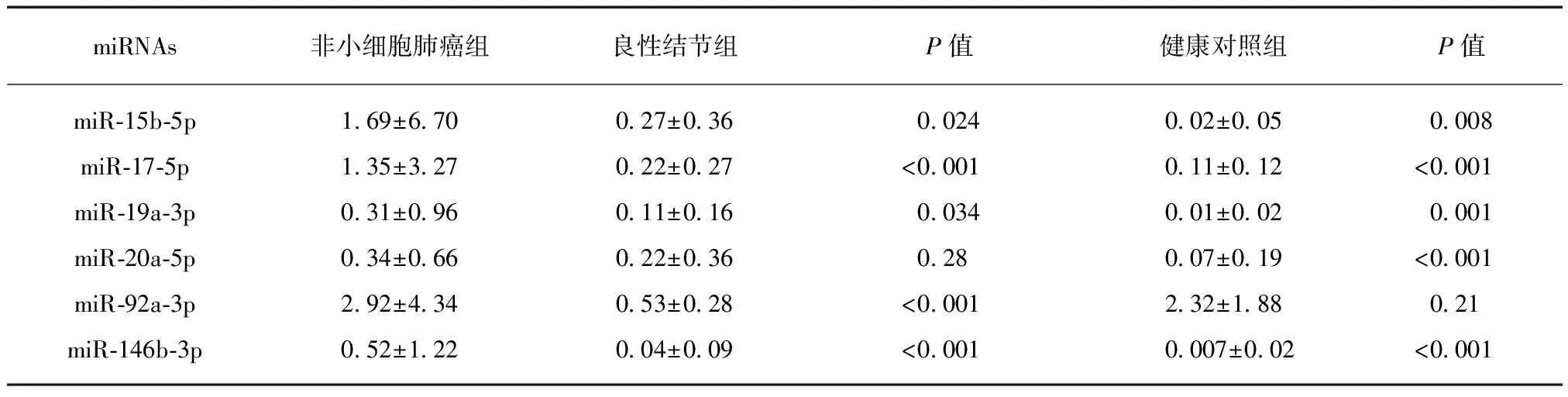
表2 6种miRNAs相对表达量

表3 单因素Logistic回归
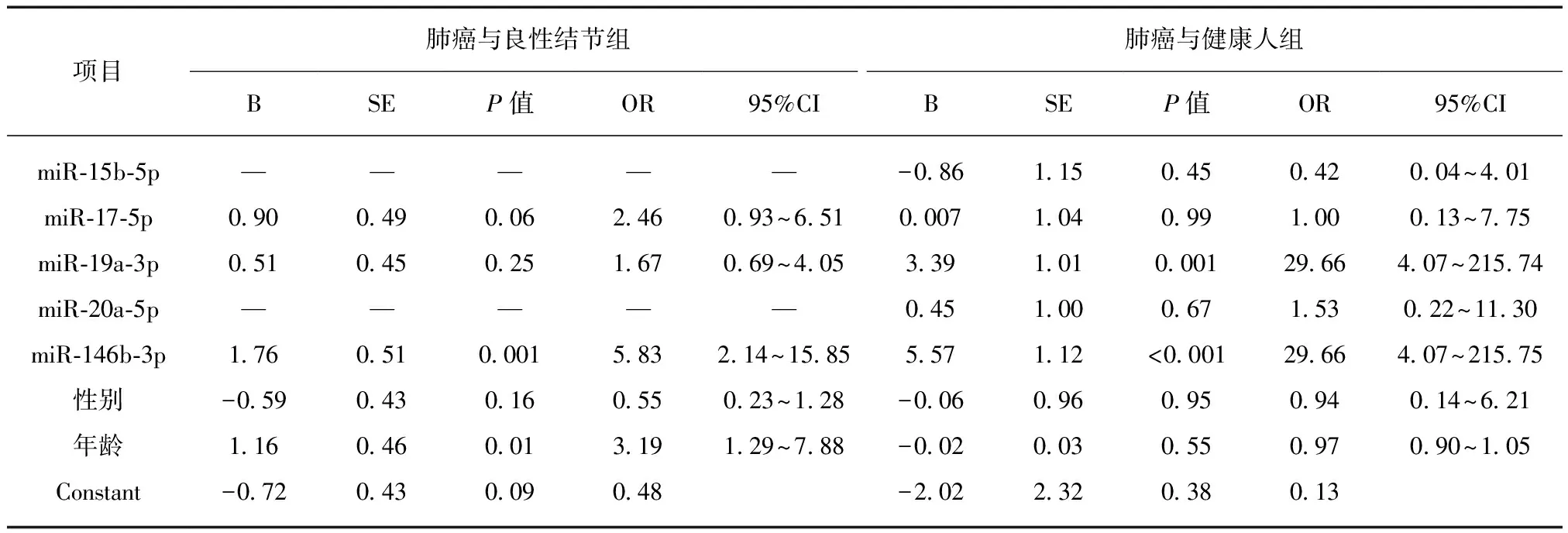
表4 多因素Logistic回归
2.3 ROC曲线
肺癌与良性结节组中: miR-146b-3p的曲线下面积(AUC)为0.77,当取临界值0.01时,灵敏度为75%,特异性为71%。MiR-Panel的曲线下面积为0.81,当取临界值0.85时,灵敏度为65%,特异性为89%,见图3。同时收集并分析肺癌与良性肺结节病例临床常用的肿瘤标志物(AFP、CEA、NSE、SCC、CA153、CA211、CA50、CA199)曲线下面积,其大小自0.41至0.59不等,明显低于前二者,并不具备明显的早期临床诊断价值;
肺癌与健康人组中: miR-146b-3p的曲线下面积(AUC)为0.93,当取临界值0.72时,灵敏度为89%,特异性为84%。miR-19a-3p的曲线下面积(AUC)为0.93,当取临界值0.76时,灵敏度为84%,特异性为92%。MiR-Panel的曲线下面积更是达到0.98,当取临界值0.90时,灵敏度为94%,特异性为95%见图2。
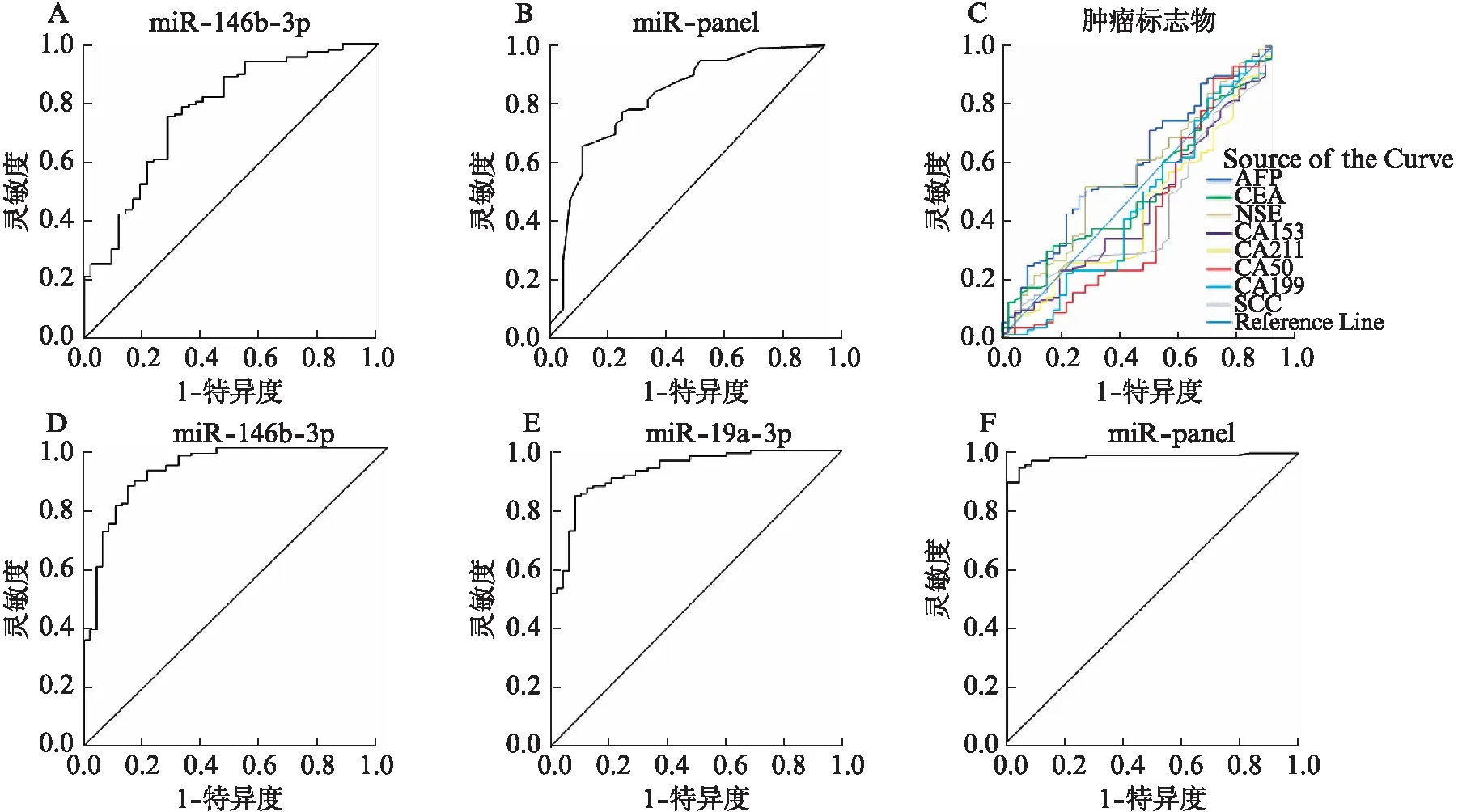
图2 MiRNAs ROC曲线Tab.2 ROC curve of miRNAsA: 肺癌与良性结节组miR-146b-3p ROC曲线;B: 肺癌与良性结节组miR-Panel ROC曲线;C: 肺癌与良性结节组肿瘤标志物ROC曲线;D: 肺癌与健康人组miR-146b-3p ROC曲线;E: 肺癌与健康人组miR-19a-3p ROC曲线;F: 肺癌与健康人组miR-Panel ROC曲线
3 讨 论
随着低剂量螺旋CT(low-dose computed tomog-raphy, LDCT)的普及与发展,肺部结节的检出率也随之提高。这类结节大体可分为恶性与良性两类。良性病变中感染性肉芽肿占多数、错构瘤,还包括血管性、淋巴性病变等。恶性结节主要包括腺癌、鳞癌、转移瘤。尽管多数结节最后经病理诊断为良性,但仍有部分结节性质可疑,仅通过影像学分析难以诊断,必须进行有创活检,这无疑增加了患者的医疗成本与心理负担。所以急需一种无创的检查方法与影像学检查进行补充。早有报道表明miRNAs与肿瘤的发生、转移和耐药等密切相关,且miRNAs取材方便,可连续监测,有望成为一种理想的潜在血清肿瘤标志物。
MiR-146家族包括miR-146a和miR-146b,分别位于人第5号和第10号染色体,其序列高度保守且与成熟序列仅有2个碱基之差,在生命活动中承担了众多作用。miR-146家族是第1个被发现具有调节免疫的miRNA,研究证实在固有免疫TLR(Toll-like receptors)通路中miR-146担任负向调节作用,即当miR-146过表达时,其两个重要靶基因IRAK1和TRAF6表达均下调。miR-146的抑癌作用与下调信号通路中NF-κB的表达有关。而在肺癌方面,Sweta等[8]研究发现,与健康对照组相比,miR-146b-3p在肺腺癌患者血清中呈显著过表达,但目前尚缺乏miR-146b-3p对于肺癌发生发展的相关机制研究。已有多项报道[9-13]表明,非小细胞肺癌与健康人中的循环血miRNAs具有表达差异。Boeri等[14]的报道中表明miRNAs作为肺癌早期诊断的临床价值。此外,Chen等[15]通过对比400例非小细胞肺癌与220例健康对照组的miRNAs表达,发现10种miRNAs表达差异具有统计学意义。陈昊等[16]通过对206例非小细胞肺癌与135例健康人的外周循环血miRNAs表达量分析发现miRNA,可作为非小细胞肺癌非侵入性诊断标志物。但现研究缺少对于肺部良性结节的报道。良性结节的发生发展导致了肺内微环境的改变,同时也致使miRNAs发生异常表达。所以通过分析比较非小细胞肺癌与良性结节的miRNAs表达谱,即可对两者进行鉴别诊断。
通过对早期非小细胞肺癌、肺部良性结节患者与健康人群外周循环血6种miRNAs表达进行检测对比,本研究发现miR-146b-3p在非小细胞肺癌患者外周循环血中呈过表达,显著高于肺部良性结节与健康人群。与本课题组前期实验相同: miR-15b-5p、miR-17-5p、miR-19a-3p、miR-20a-5p在非小细胞肺癌与健康人中呈差异表达。Logistic回归分析表明在肺癌与良性结节组中,年龄与miR-146b-3p为相关独立危险因素,肺癌与健康人组中miR-19a-3p与miR-146b-3p为相关独立危险因素,且有较高的特异性(95%)和灵敏度(94%),相较于当前临床常用的肿瘤标志物,具有更强的早期鉴别诊断能力。
综上所述,本次研究结果表明血清miR-146b-3p在非小细胞肺癌、肺部良性结节患者与健康人群的早期鉴别诊断中具有一定的价值和潜力,可作为一种新的血清肿瘤标志物,很好的弥补了影像学检查在早期肺部结节良恶性判定上的劣势。通过进一步的基础机制研究和大规模临床验证,有望能提高早期肺部结节良恶性鉴别的准确性。
【参考文献】
[1] SIEGEL R, NAISHADHAM D, JEMAL A[J].Cancer statistics, 2013. CA Cancer J Clin, 2013,63(1): 11-30.
[2] DESANTIS C, NAISHADHAM D, JEMAL A. Cancer statistics for African Americans, 2013[J]. CA Cancer J Clin, 2013,63(3): 151-166.
[3] JENNIFER F BARGER, S PATRICK NANA-SINKAM. MicroRNA as tools and therapeutics in lung cancer[J]. Respir Med, 2015,109(7): 803-812.
[4] SHEN J, LIAO J, GUARNERA M A, et al. Analysis of microRNAs in sputum to improve computed tomography forlung cancer diagnosis[J]. J Thorac Oncol, 2014,9(1): 33-40.
[5] RUSEK A M, ABBA M, ELJASZEWICZ A, et al. MicroRNA modulators of epigenetic regulation, the tumor microenvironment and the immune system in lung cancer[J]. Mol Cancer, 2015,14: 34.
[6] BIANCHI F. Lung cancer early detection: the role of circulating microRNA[J]. EBio Medicine, 2015,2: 1278-1279.
[7] LIHONG F, HUIWEI Q, JUNLIANG T, et al. Identification of serum miRNAs by nano-quantum dots microarray as diagnostic biomarkers for early detection of non-small cell lung cancer[J]. Tumor Biol, 2015,37(6): 1-8.
[8] SWETA R, KATHY G, JOHN C, et al. Globle analysis of serum microRNAs as potential biomarkers for lung adenocarcinoma[J]. Cancer Biol Ther, 2013,14(12): 1104-1112.
[9] DING X, YANG Y, SUN Y, et al. MicroRNA-585 acts as a tumor suppressor in non-small-cell lung cancer by targeting hSMG-1[J]. Clin Transl Oncol, 2017,19(5): 546-552.
[10] WU L, HU B, ZHAO B, et al. Circulating microRNA-422a is associated with lymphatic metastasis in lung cancer[J]. Oncotarget, 2017,8(26): 42173-42188.
[11] COCHETTI G, POLI G, GUELFI G, et al. Different levels of serum microRNAs in prostate cancer and benign prostatic hyperplasia: evaluation of potential diagnostic and prognostic role[J]. Onco Targets Ther, 2016,9: 7545-7553.
[12] JANIAK M, PASKAL W, RAK B, et al. TIMP4 expression is regulated by miR-200b-3p in prostate cancer cells[J]. APMIS, 2017,125(2): 101-105.
[13] 邱雯莉,周红光.hsa-miR-34b过表达慢病毒载体的构建、转染和表达.兰州大学学报(医学版), 2016,42(3): 6-11.
[14] BOERI M, VERRI C, CONTE D, et al. Microrna signatures in tissues and plasma predict development and prognosis of computed tomography detected lung cancer[J]. Proc Natl Acad Sci USA, 2011,108(9): 3713-3718.
[15] CHEN X, HU Z, WANG W, et al. Identification of ten serum micrornas from a genome-wide serum microrna expression profile as novel noninvasive biomarkers for nonsmall cell lung cancer diagnosis[J]. Int J Cancer, 2012,130(7): 1620-1628.
[16] 陈昊,范理宏.血清miRNA生物标志物对NSCLC的诊断价值[J].同济大学学报(医学版),2016,37(4): 51-54

