IL-21及其受体在银屑病患者外周血和皮损组织中的表达及意义
范华宇, 龚 瑜, 于 倩, 史玉玲
(同济大学附属第十人民医院皮肤科,上海 200072)
银屑病(psoriasis)是免疫介导的多基因遗传性皮肤病,环境因素在诱导银屑病发病中起着重要的作用。CD4+T细胞在免疫系统中起主要的作用,在银屑病的发病机制中也是关键因素,细胞因子和免疫细胞相互用导致角质形成细胞增生,表皮增厚,是银屑病的主要发病机制[1]。IL-21是一种四螺旋束细胞因子,属于IL-2细胞因子家族,主要由激活的CD4+T细胞、Th17细胞和NKT细胞分泌[2-3]。白细胞介素-21受体(interleukin-21 receptor, IL-21R)在很多免疫细胞和非免疫细胞表面均有表达,IL-21通过IL-21R和常见的细胞因子受体γc链发挥信号作用[4]。研究结果表明,IL-21及IL-21R和银屑病发病密切相关,本研究旨在研究IL-21及IL-21R在银屑病发病中的作用。
1 资料与方法
1.1 一般资料
1.1.1 血液标本 58例寻常型银屑病患者外周血标本取自同济大学附属第十人民医院皮肤科门诊和病房,所有病例均符合银屑病的诊断标准。纳入标准: 银屑病面积和严重程度指数(psoriasis area and serverity index, PASI)≥10以及皮损面积>10%中、重度银屑病的患者;所有患者入组前1个月内未接受过系统治疗,2周内未外用银屑病治疗药物。排除标准: 有严重感染和免疫抑制的患者;合并有肝、肾及其他严重疾病的患者;妊娠及哺乳期妇女。健康对照组20例,均为健康成人献血员。所有患者和健康对照者均签署知情同意书。血液标本用来提取PBMCs细胞进行相关实验。
1.1.2 组织标本 选取其中25例银屑病患者进行皮肤组织病理检查,15例正常对照组的皮肤来自整形外科手术腰背部正常皮肤。组织标本用来抽提RNA和蛋白进行实验。
1.2 主要试剂
流式相关抗体均来自eBioscience公司;总RNA提取液RNAisoTMPlus、反转录试剂盒PrimeScriptTMRT reagent Kit、SYBR Green荧光定量PCR试剂盒SYBR Premix Ex Taq均购自宝生物工程(大连)有限公司;IL-21 ELISA试剂盒购自美国RD公司;淋巴细胞分离液、RPMI 1640培养液、胎牛血清均来自奥地利PAA Laboratories GmbH公司;PMA和伊屋诺霉素购自美国Sigma-Aldrich公司;兔多克隆IL-21抗体购自美国Novus Biologicals公司;兔多克隆IL-21受体抗体购自英国Abcam公司。
1.3 方法
1.3.1 PBMC的分离 用EDTA抗凝管采集研究对象5mL血液,用Ficoll-Hypaque密度梯度离心法获得PBMC。将PBMC平均分装2个1.5mL的EP管,一部分用于抽提RNA,另一部分用于IL-21R和细胞培养刺激5h后IL-21等细胞因子的检测。
1.3.2 PBMC中IL-21、IL-21R的流式检测 用含10%胎牛血清的1640细胞培养液将PBMC重悬,计数,将PBMC的浓度调整到2×106/mL,总体积为500μL。用96孔U型培养板作细胞培养,将500μL细胞悬液加入2孔中,每孔PBMC为1×106,其中一孔加入50ng/mL PMA,500ng/mL伊屋诺霉素和2.5μL Brefeldin,37℃培养箱中培养,5h后进行免疫荧光抗体的标记;室温避光表面染色CD4-FITC 15min;1mL PBS洗涤1次,每管加入100μL固定液室温避光30min;1mL穿膜液洗涤2次,每管加入100μL穿膜液和IL-21-Alexa Fluor®647,同型对照管加入Isotype Control-Alexa Fluor®647,震荡混匀,避光室温20min;1mL穿膜液洗涤细胞后用300μL流式染色缓冲液重悬细胞,上流式细胞仪检测,使用CELLQuest软件收获细胞并检测。
1.3.3 PBMC中IL-21R的流式检测 将每管PBMC调整到1×106PBMC,分别加入CD4-FITC、IL-21R-PE,室温避光表面染色15min;1mL PBS洗涤细胞后用300μL流式染色Buffer重悬细胞,上流式细胞仪检测。首先圈出CD4+的淋巴细胞,然后再从CD4+淋巴细胞中圈出CD4+IL-21R+的细胞。
1.3.4 细胞培养 用含10%胎牛血清的1640细胞培养液将PBMC重悬,用96孔U型培养板作细胞培养,将500μL细胞悬液加入1孔中,PBMC数量为1×106,加入50ng/mL PMA、500ng/mL Ionomycin,37℃培养箱中培养5h,取上清液检测IL-21水平。
1.3.5 PBMC RNA的抽提 向106个PBMC加入1mL RNAisoTMPlus后振荡混匀,按照RNA抽提试剂盒说明进行,RNA沉淀常温干燥后,加20μL DEPC水溶解。皮肤组织称重量,TRIzol组织匀浆,按RNA抽提试剂盒进行抽提。取1.5μL在紫外分光光度计上测量RNA浓度,根据D260/D280的比值来估算核酸纯度,正常值范围为1.8~2.0。
1.3.6 反转录 参照TaKaRa公司反转录试剂盒说明书进行,按10μL的反应体系配制RT反应液(反应液的配制在冰上进行): 总RNA为500ng,PrimeScript缓冲液2μL,PrimeScript RT酶混合I 0.5μL,Oligo dT Primer 0.5μL,Random 6 mers 0.5μL,余下的量用RNase Free dH2O补齐。
1.3.7 RT-PCR 本实验所用的引物,均由Invitrogen公司合成。实验步骤参照TaKaRa公司SYBR green荧光定量PCR试剂盒说明书,具体步骤如下: 进行两步法PCR扩增反应。预变性: 95℃ 30s,1个循环;PCR反应: 95℃ 5s,60℃ 20s,40个循环;解链: 95℃ 15s,60℃ 30s,95℃ 15s,1个循环。得到每个标本不同指标的Ct值,根据公式2-⊿⊿Ct计算出所测指标的相对表达量。
1.3.8 Western印迹法检测IL-21和IL-21R在皮肤组织中的表达 (1) 蛋白质样品制备: 利用液氮、研钵粉碎组织块,加入裂解液,利用组织匀浆机进一步匀浆,移入离心管,4℃ 12000r/min,离心10min,取上清液,BCA法测定蛋白浓度并校准不同样品的蛋白浓度。(2) 常规蛋白电泳: SDS聚丙烯酰胺凝胶电泳后,将蛋白转移至硝酸纤维素膜上,室温避光封闭2h,相应一抗4℃孵育过夜,膜漂洗3次后,二抗室温孵育2h,应用ECL显色试剂盒显色。
1.3.9 IL-21、IL-21R的ELISA测定 采集静脉血5mL,以3000r/min,离心15min后取上清液。PBMC培养5h后取上清液,均于-80℃冰箱保存备用。按照ELISA试剂盒说明书建立标准曲线,样品加样,酶标仪测定450nm处D450值,根据标准曲线读取样品浓度。
1.4 统计学处理
2 结 果
2.1 CD4+IL-21+细胞和CD4+IL-21R+细胞在银屑病患者PBMC中的表达
银屑病患者外周血PBMC中CD4+IL-21+细胞百分率较健康对照组有显著升高[银屑病组(4.14±1.23)%,健康对照组(1.82±0.64)%,P<0.01),CD4+IL-21R+细胞较健康对照组亦有显著升高[银屑病组(2.37±0.79)%,健康对照组(1.57±0.54)%,P<0.01],见图1。

图1 CD4+IL-21+细胞和CD4+IL-21R+细胞在银屑病外周血PBMC中的比例Fig.1 The ratio of CD4+IL-21+ cells and CD4+IL-21R+ cells in peripheral blood of psoriasis patientsA: 银屑病患者和健康对照组PBMC中IL-21+细胞和IL-21R+细胞流式细胞仪散点图;B: 统计学分析,与对照组相比,*P<0.01
2.2 IL-21、IL-21R mRNA在银屑病患者PBMC中的表达
58例银屑病患者及20例健康对照人群的PBMC中IL-21 mRNA的相对表达量分别为5.14±2.49和2.54±1.01;IL-21R mRNA的相对表达量分别为3.55±2.04和2.59±0.79。银屑病患者外周血PBMC中IL-21、IL-21R表达水平均明显高于正常对照组,差异有统计学意义(P<0.01,P<0.05)。
2.3 IL-21、IL-21R mRNA在银屑病患者组织中的表达
RT-PCR检测25例银屑病患者皮损组织和15例正常对照者皮肤组织中IL-21 mRNA、IL-21R mRNA的表达。银屑病患者和正常对照皮肤组织中IL-21 mRNA的相对表达量分别为12.4±4.56和3.59±1.29;IL-21R mRNA的相对表达量分别为5.35±2.28和2.59±0.85。银屑病患者皮肤组织中IL-21、IL-21R表达水平均明显高于正常对照组,差异有统计学意义(P<0.01)。
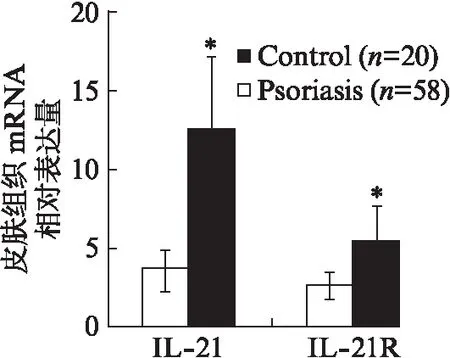
图2 健康对照组和银屑病患者皮肤组织中IL-21和IL-21R mRNA的表达水平Fig.2 The mRNA expression of IL-21 and IL-21R in skin tissues of psoriasis patients and healthy controls与对照组比较,*P<0.01
2.4 银屑病患者皮肤组织中IL-21、IL-21R的蛋白表达水平
Western印迹法检测25例银屑病患者皮损组织和15例正常对照者皮肤组织中IL-21、IL-21R蛋白的表达。Western印迹法结果显示,银屑病患者和正常对照皮肤组织相比IL-21、IL-21R蛋白表达水平明显升高,见图3。
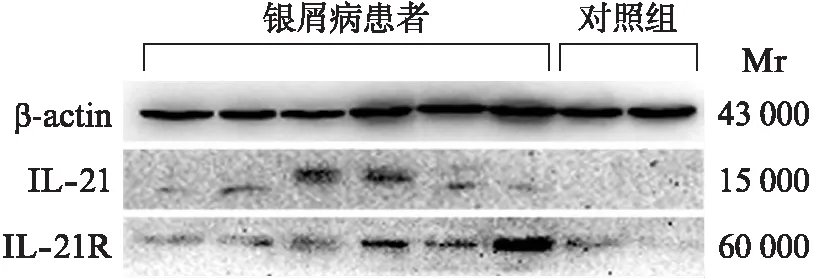
图3 Western印迹法检测银屑病患者和正常对照皮肤组织中IL-21、IL-21R蛋白表达差异Fig.3 The protein expression of IL-21 and IL-21R in skin tissues of psoriasis patients and healthy controls detected by Western blotting
2.5 银屑病患者PBMC培养上清中IL-21水平
银屑病患者PBMC分泌IL-21的水平为(159.35±15.15)ng/L,明显高于正常对照组的(67.76±12.08)ng/L,差异有统计学意义(P<0.01)。
3 讨 论
银屑病是在多基因遗传背景下由T细胞介导的炎症性皮肤病,以角质形成细胞过度增殖和异常分化及炎性细胞浸润为主要特征[5]。真皮内的CD4+T细胞及其产生的细胞因子是银屑病发病的中心环节,表皮角质形成细胞的增殖只是免疫学反应继发结果之一[6]。因此,探索细胞因子在银屑病发病中的作用对于探讨有效的治疗方法有着重要的意义。
人类IL-21基因位于染色体4q26-q27上[2],IL-21通过IL-21R及γc链发挥信号转导作用。γc链是IL-21R复合体的组成部分,IL-21通过IL-21R/γc链激活JAK1、JAK3、STAT1、STAT3通路[7]。在γc链缺失的情况下IL-21可以和IL-21R结合,但是细胞内的信号转导只有在γc链存在的情况下才能进行[2]。IL-21R产生的信号诱导调节性B细胞(B10细胞)扩增和IL-10分泌,因此人和鼠B10细胞能通过IL-21的交互认知调控T细胞自身免疫[8]。IL-21有促进淋巴细胞增生的功能,增加CD8+T细胞和NK细胞的毒性,并直接抑制树突状细胞的抗原提呈作用[9]。有研究在Ⅰ型糖尿病的模型中发现,在体内和体外T-bet缺乏均导致IL-21依赖的CD8+T细胞细胞毒性的缺陷,因此,IL-21通过转录因子T-bet的作用驱动CD8+CTL的分化[10]。IL-21对NK细胞的生长和功能有多重效果,能通过上调IFN-γ和颗粒酶B,浓度依赖性的增强NK细胞的细胞毒性作用。在体内实验中,IL-21促进NK细胞和CD8+T细胞产生更多的穿孔素和颗粒酶B,增强细胞毒性作用[11]。IL-21能促进IL-23R的表达,增加IL-23的细胞应答。IL-21虽然可以在体外促进Th17细胞的分化,但在过敏性脑炎模型中,Th17细胞的发展在WT和IL-21r敲除的小鼠中并没有差别[12]。也有研究报道IL-21可以增加γδT细胞产生的IL-17[13]。IL-21可抑制Treg细胞的功能,并且在Treg细胞缺失的情况下,IL-21促进炎症性疾病的发生[14]。Tfh细胞分泌IL-21,IL-21促进Tfh的分化[15],但IL-21对于Tfh细胞和Th17细胞的发展不是必需的[7]。
研究发现,IL-21参与了多种自身免疫性疾病的发生,如系统性硬化、类风湿性关节炎(RA)、银屑病、系统性红斑狼疮、糖尿病等。在系统性硬化的皮肤组织和RA患者的关节滑膜组织内,IL-21R mRNA的表达显著升高,RA患者IL-21R阳性细胞高表达在滑膜侵入关节软骨和骨的部位,尤其在滑膜组织内的巨噬细胞和成纤维细胞[16]。研究发现银屑病患者的皮损中IL-21蛋白和mRNA均明显高于同一患者的非皮损和正常人。银屑病患者血清中IL-21的水平较正常对照组血清中IL-21的水平升高,并和PASI评分呈正相关。关于Ustekinumab治疗银屑病的可能靶点研究显示,对该单抗治疗反应不敏感的患者和敏感患者相比较,反应敏感患者皮损部位的IL-20,IL-21,P40的mRNA水平显著下调[18]。在严重免疫缺陷小鼠(SCID小鼠)的真皮内注射重组IL-21以及Th1、Th17炎性细胞可以诱导出银屑病样皮损,在SCID小鼠的移植皮损中注射IL-21的抗体,移植皮损有所好转。可见,IL-21在银屑病的发病中发挥了重要的作用。综上所述,IL-21能促使多种免疫细胞分泌炎症因子,增强细胞毒性细胞的杀伤作用,在免疫机制中发挥着多种作用。
本研究证实在银屑病患者外周血和皮损中存在IL-21和IL-21R,其水平明显高于正常对照组,可见IL-21和IL-21R在银屑病的发病中发挥了重要的作用,为探索IL-21在银屑病中发病中的作用提供了理论依据,将来IL-21有望成为治疗性细胞因子用于银屑病治疗。
【参考文献】
[2] GHARIBI T, MAJIDI J, KAZEMI T, et al. Biological effects of IL-21 on different immune cells and its role in autoimmune diseases[J]. Immunobiology, 2015,221(2): 357-367.
[3] LEI L, ZHONG X N, HE Z Y, et al. IL-21 induction of CD4+T cell differentiation into Th17 cells contributes to bleomycin-induced fibrosis in mice[J]. Cell Biol Int, 2015,39(4): 388-399.
[4] WAN C K, OH J, LI P, et al. The cytokines IL-21 and GM-CSF have opposing regulatory roles in the apoptosis of conventional dendritic cells[J]. Immunity, 2013,38(3): 514-527.
[5] KIM J, KRUEGER J G. Highly effective new treatments for psoriasis target the IL-23/Type 17 T cell autoimmune axis[J]. Annu Rev Med, 2016,68(1): 255-269.
[6] GIROLOMONI G, STROHAL R, PUIG L, et al. The role of IL-23 and the IL-23/TH17 immune axis in the pathogenesis and treatment of psoriasis[J]. J Eur Acad Dermatol Venereol, 2017,31(10): 1616-1626.
[7] TANGYE S G. Advances in IL-21 biology-enhancing our understanding of human disease[J]. Curr Opin Immunol, 2015,34: 107-115.
[8] YOSHIZAKI A, MIYAGAKI T, DILILLO D J, et al. Regulatory B cells control T-cell autoimmunity through IL-21-dependent cognate interactions[J]. Nature, 2012,491(7423): 264-268.
[9] HEGAB D S, ELGARHY L H, ATTIA M. Are peripheral natural killer cells and interleukin-21 interrelated in psoriasis pathogenesis? [J]. Ann Dermatol, 2017,29(1): 108-110.
[10] SUTHERLAND A P, JOLLER N, MICHAUD M, et al. IL-21 promotes CD8+CTL activity via the transcription factor T-bet[J]. J Immunol, 2013,190(8): 3977-3984.
[11] QI L, YE L J, REN H L, et al. Multiple effects of IL-21 on human NK cells in ex vivo expansion[J]. Immunobiology, 2015,220(7): 876-888.
[12] SPOLSKI R, LEONARD W J. Interleukin-21: a double-edged sword with therapeutic potential[J]. Nat Rev Drug Discov, 2014,13(5): 379-395.
[13] SUTTON C E, MIELKE L A, MILLS K H. IL-17-producing γδ T cells and innate lymphoid cells[J]. Eur J Immunol, 2012,42(9): 2221-2231.
[14] VOGELZANG A, MCGUIRE H M, LIU S M, et al. IL-21 contributes to fatal inflammatory disease in the absence of Foxp3+T regulatory cells[J]. J Immunol, 2014,192(4): 1404-1414.
[15] NIU J, SONG Z, YANG X, et al. Increased circulating follicular helper T cells and activated B cells correlate with disease severity in patients with psoriasis[J]. J Eur Acad Dermatol Venereol, 2015,29(9): 1791-1796.
[16] JÜNGEL A, DISTLER J H, KUROWSKA-STOLARSKA M, et al. Expression of interleukin-21 receptor, but not interleukin-21, in synovial fibroblasts and synovial macrophages of patients with rheumatoid arthritis[J]. Arthritis Rheum, 2004,50(5): 1468-1476.
[17] DE OLIVEIRA P S, CARDOSO P R, LIMA E V, et al. IL-17A, IL-22, IL-6, and IL-21 serum levels in plaque-type psoriasis in Brazilian patients[J]. Mediators Inflamm, 2015,2015: 819149.
[18] GEDEBJERG A, JOHANSEN C, KRAGBALLE K, et al. IL-20, IL-21 and p40: potential biomarkers of treatment response for ustekinumab[J]. Acta Derm Venereol, 2013,93(2): 150-155.

