POFUT1对人胃腺癌裸鼠移植瘤微血管生成的抑制作用
樊启林, 王志荣
(同济大学附属同济医院消化内科,上海 200065)
胃癌(gastric cancer, GC)是一种严重威胁人类健康的恶性肿瘤,居全世界肿瘤发病率的第4位和癌症死亡率的第2位[1]。因此对胃癌的深入研究具有重要的临床意义和价值。蛋白-O-岩藻糖基转移酶1(protein O-fucosyltransferase 1, POFUT1)在口腔癌和肝癌中明显高表达[2-3]。以往的研究显示,POFUT1在胃癌中表达明显增高,可促进胃癌细胞生长、增强胃癌细胞的迁移和侵袭能力。胃癌的生长、侵袭和转移同其他实体肿瘤一样,都依赖于新生血管形成过程中所提供的营养[5-6]。内皮细胞生长因子(vascular endothelial growth factor, VEGF)是一种促肿瘤血管新生的重要因子,其表达水平与肿瘤的恶性程度、转移和微血管密度等呈正相关。CD31为微血管密度(microvessel density, MVD)的标记物之一,可作为肿瘤血管新生能力的重要指标之一。本研究通过检测裸鼠移植瘤组织中VEGF和CD31的表达及POFUT1和VEGF的蛋白表达来探讨POFUT1在胃癌肿瘤血管形成中的作用。
1 材料与方法
1.1 动物和试剂
20只SPF级裸鼠,雄性,7~8周龄,体质量17~20g,由中国科学院上海实验动物中心提供。分笼饲养于同济大学附属同济医院中心实验室SPF级动物房。BGC823人胃腺癌细胞由中国科学院上海细胞库提供。
所用试剂POFUT1抗体购自Abcam公司,1∶500 稀释;VEGF购自Abcam公司,1∶500稀释;CD31购自Abcam公司,1∶1000稀释;RIPA、多聚甲醛、免疫组织化学试剂盒、BCA试剂盒、ECL试剂盒均购自上海碧云天生物技术有限公司;Lipofectamine 2000试剂盒购自Invitrogen公司;POFUT1引物由生工生物工程股份有限公司合成。
1.2 细胞培养与传代
人胃腺癌BGC823细胞在DMEM培养基(含10%胎牛血清)中维持,置于37℃、5% CO2恒温培养箱中培养。细胞为单层贴壁生长,待贴壁细胞融合达80%时以胰酶(含0.02%EDTA)消化传代。以上各项操作均在同济大学附属同济医院动物实验中心无菌细胞培养室的超净台中进行。
1.3 POFUT1低表达和过表达稳定胃癌细胞株的构建
1.3.1 干扰慢病毒载体shRNA-POFUT1及过表达慢病毒载体PLV-POFUT1的构建 根据人POFUT1基因(NM_015352.1)序列设计2对Oligo序列,将其合成并进行退火形成双链DNA。对干扰慢病毒载体PDS019_PL-shRNA-GFP-F进行连接反应,利用感受态细菌DH5α进行转化反应。将菌液接种于LB培养基中,对挑选的质粒进行测序,将测序正确的菌液进行质粒抽提和进行质检。干扰慢病毒构建使用的引物信息如下。POFUT1-495上游引物: 5′-CACC-GCCCATTCTGGGATCAGTTTCCGAAGAAACTGA-TCCCAGAATGGGC-3′;下游引物: 5′-AAAAGCC-CATTCTGGGATCAGTTTCTTCGGAAACTGATCC-CAGAATGGGC-3′。POFUT1-109上游引物: 5′-CA-CCGACCACTTTATTGGCAACTCGAAAGTTGCCA-ATAAAGTGGTC-3′;下游引物: 5′-AAAAGACCA-CTTTATTGGCAACTTTCGAGTTGCCAATAAAGT-GGTC-3′。设计针对POFUT1的过表达序列,序列信息如下: 5′-AGACTAGTTCTAGAATGGGCGCCGCC-GCGTGGGC-3′;5′-GAGGGGCGGGATCCTCAGAA-CTCGTCCCGCA-GCT-3′。利用PCR获取POFUT1过表达片段,对载体进行酶切,不依赖连接酶(ligase independent clonign, LIC)方法连接载体与片段,送样进行测序,结果比对一致后,进行质粒抽提。
1.3.2 shRNA-POFUT1、shRNA control、PLV-POFUT1及PLV contro1慢病毒包装及滴度测定 取一灭菌EP管,将POFUT1过表达慢病毒质粒及包装质粒按1∶3比例混匀置于EP管中,再向其加入无血清培养液,室温放置10min;另取一EP管,加入LipofectamineTM2000和无血清培养液,轻轻混匀,室温放置10min。将上述2个EP管的DNA溶液和脂质体溶液混在一起,室温放置20min。将种植于六孔板中的293T细胞的培养液吸走,添加DNA-脂质体复合物,放回细胞培养箱孵育过夜。转染后第3、5天陆续收获含病毒的上清液,离心半径8cm,3000r/min,离心20min,去除沉淀。收取培养上清液,显微镜下观察包装的效率。分装病毒上清液,保存放置于-80℃。测定慢病毒滴度,将病毒10倍梯度稀释,并设置10个稀释度和空白对照,病毒转染72h后加入杀稻瘟菌素进行抗性筛选,依据GFP荧光细胞克隆数计算慢病毒的滴度(TU/ml)。按同样方法制备POFUT1稳定低表达细胞株。
1.3.3 shRNA-POFUT1和PLV-POFUT1稳定细胞株的筛选和检测 将制备好的慢病毒shRNA-POFUT1、shRNA control、PLV-POFUT1及PLV contro1病毒液分别感染胃癌细胞BGC823(MOI 50)。对于shRNA-POFUT1、shRNA control两组的BGC823细胞,用含有杀稻瘟菌素的DMEM培养液进行细胞传代培养,筛选稳定转染克隆,将稳定转染的细胞命名为shRNA-POFUT1-BGC823、shctl-BGC823。对于PLV-POFUT1及PLV contro1两组的BGC823细胞,在DMEM培养液中加入嘌呤霉素进行抗生素筛选,将稳定转染的细胞命名为PLV-POFUT1-BGC823及PLV contro1-BGC823细胞。提取以上4种细胞总蛋白,Western印迹法检测稳定表达胃癌细胞系中POFUT1表达水平的变化。
1.4 裸鼠移植瘤体内生长曲线的测定及比较
取对数生长期4种BGC823细胞复苏、传代后进行常规收集,用DMEM培养液调整细胞终密度至5×107个/ml。取0.2ml细胞悬液接种于裸鼠右下肢根部背部皮下。隔日观察成瘤情况并记录时间,每3d用游标卡尺测量肿瘤大小,并重复测量3次,取平均值,按公式V=L×W2/2(L为最长径,W为与L相垂直的横径)计算瘤体积。接种第30天,末次测量后颈椎脱臼处死,切除肿瘤测量大小并做后续检测。绘制各组肿瘤生长曲线并比较。
1.5 免疫组织化学法检测VEGF和MVD
用4%多聚甲醛固定瘤组织,石蜡包埋,4μm切片,标本切片严格按照免疫组织化学染色试剂盒步骤进行VEGF和CD31检测。采用Image-pro plus 6.0图像分析软件(美国Media Cybernetics公司),在高倍视野(×400)下计数。参照Maeda[7]标准检测瘤组织的MVD,首先在低倍镜(×40)下整体观察DC31染色的阳性血管(邻近良性组织区域和微血管稀少硬化区除外),并选择MVD最高及“热点”区域,计数MVC,求其平均值并计算MVD(MVD=MVC/面积,0.1885mm2/高倍视野)。微血管统计标准: 单个可与周围血管、肿瘤细胞和其他结缔组织区分的棕染内皮细胞或内皮细胞团,均可计数为1个微血管,无论是否形成管腔;基层较厚或管腔直径>8个红细胞直径的血管均不计数[8]。VEGF判断标准: 细胞内有棕黄或棕褐色颗粒且强度高于背景的着色细胞为阳性细胞,无棕黄或棕褐色颗粒为阴性细胞[9]。
1.6 Western印迹法检测裸鼠瘤组织中POFUT1和VEGF的蛋白表达
将肿瘤组织加入裂解液行超声粉碎,严格按BCA试剂盒说明书测定蛋白浓度。经10% SOS-聚丙烯酰胺凝胶电泳将等量蛋白转到PVDF膜上,5%脱脂奶粉室温封闭1h,POFUT1和VEGF一抗4℃孵育过夜,室温1h孵育二抗(CST),ECL化学发光试剂显影检测POFUT1和VEGF的蛋白。
1.7 统计学处理
2 结 果
2.1 裸鼠接种BGC823后的一般情况
皮下接种shRNA-POFUT1、PLV-POFUT1及其对照组人胃癌BGC823细胞后3~4d,接种部位出现直径约0.3cm大小的肿瘤结节,成瘤率为100%。观察和检测期间,所有裸鼠均未出现明显的活动减少、反应迟钝、精神萎靡、消瘦等现象。试验结束时无一裸鼠死亡。
2.2 各组细胞间POFUT1蛋白表达差异
Western印迹法显示,与shRNA control组相比,shRNA-POFUT1组的POFUT1蛋白表达水平显著下调;与PLV contro1相比,PLV-POFUT1组的POFUT1蛋白水平显著增强,证实转染成功,见图1。

图1 慢病毒稳转胃癌细胞株BGC823中POFUT1表达水平Fig.1 The expressions of POFUT1 in shRNA-POFUT1, shRNA control, PLV-POFUT1 and PLV control BGC823 cells
2.3 各组裸鼠移植瘤生长
在shRNA-POFUT1、shRNA control两组中裸鼠移植瘤体积均随时间延长而逐渐增大,但shRNA-POFUT1组较shRNA control组肿瘤体积增殖曲线较陡直,表明shRNA-POFUT1组POFUT1基因低表达可显著抑制移植瘤生长,差异有统计学意义(P<0.05)。在PLV-POFUT1及PLV contro1两组中裸鼠移植瘤体积也呈随时间延长而逐渐增大的趋势,但PLV-POFUT1较PLV contro1组肿瘤体积增殖曲线较平缓,表明PLV-POFUT1组POFUT1基因过表达可显著促进移植瘤生长,差异有统计学意义(P<0.05),见图2、3。
2.4 各组免疫组化染色检测VEGF、MVD结果比较
VEGF位于细胞的胞膜和细胞质,胞质尤为明显,以胞膜或胞质中出现棕黄色颗粒为阳性。结果显示,shRNA-POFUT1组VEGF表达明显低于shRNA control组,两组间差异有统计学意义(P<0.05);PLV-POFUT1组VEGF表达明显高于PLV contro1组,两组间差异有统计学意义(P<0.05)。CD31主要表达于血管内皮细胞中,阳性染色呈棕黄色颗粒状(图4),PLV-POFUT1组表达阳性率显著高于PLV control组;shRNA-POFUT1表达阳性率明显低于shRNA control组(P<0.05),见表1。
2.5 裸鼠肿瘤组织蛋白POFUT1和VEGF蛋白表达
Western印迹法显示,与shRNA control组相比,shRNA-POFUT1组的POFUT1和VEGF蛋白表达水平均显著下调;与PLV contro1相比PLV-POFUT1组的POFUT1和VEGF蛋白水平均显著增强,见图5。
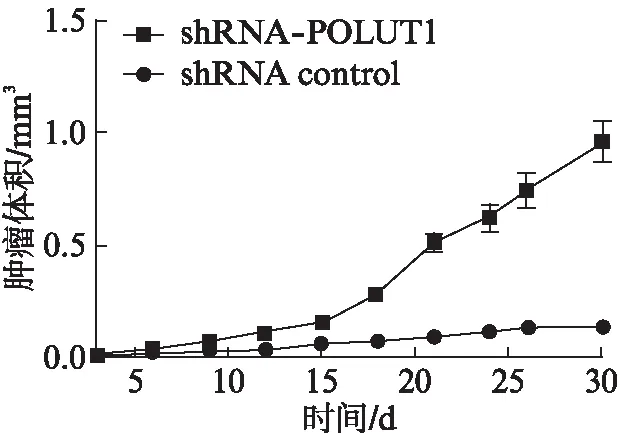
图2 shRNA-POFUT1和shRNA control组移植瘤体积的比较Fig.2 The comparison of volume of transplantated tumor between shRNA-POFUT1 and shRNA control groups
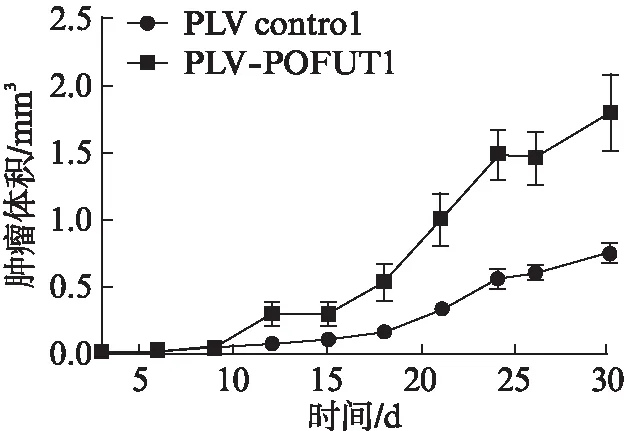
图3 PLV-POFUT1和PLV control组移植瘤体积的比较Fig.3 The comparison of volume of transplanted tumor between PLV-POFUT1 and PLV control groups

图4 4组移植瘤中VEGF和CD31的表达水平(SP,×400)Fig.4 The expressions of VEGF and CD31 in shRNA-POFUT1,shRNA control, PLV-POFUT1 and PLV control groups(SP,×400)
表14组移植瘤间VEGF和CD31表达差异
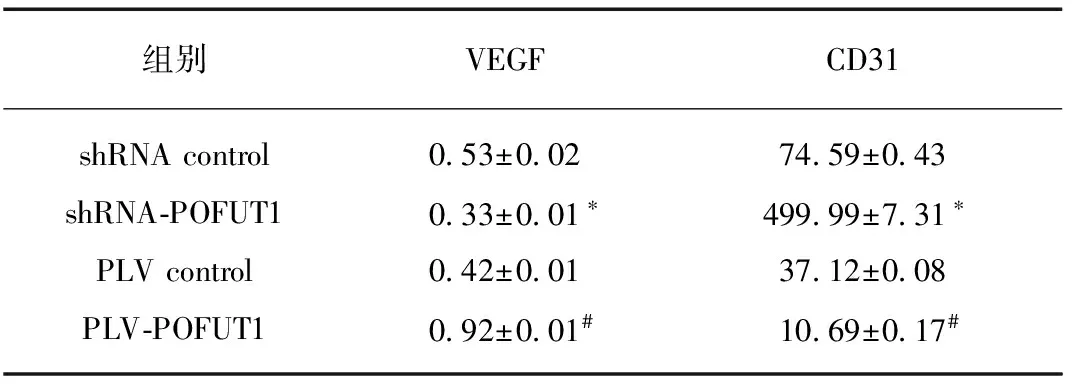
组别VEGFCD31shRNAcontrol0 53±0 0274 59±0 43shRNA⁃POFUT10 33±0 01∗499 99±7 31∗PLVcontrol0 42±0 0137 12±0 08PLV⁃POFUT10 92±0 01#10 69±0 17#
与shRNA control组相比,*P<0.05;与PLV control组相比,#P<0.05
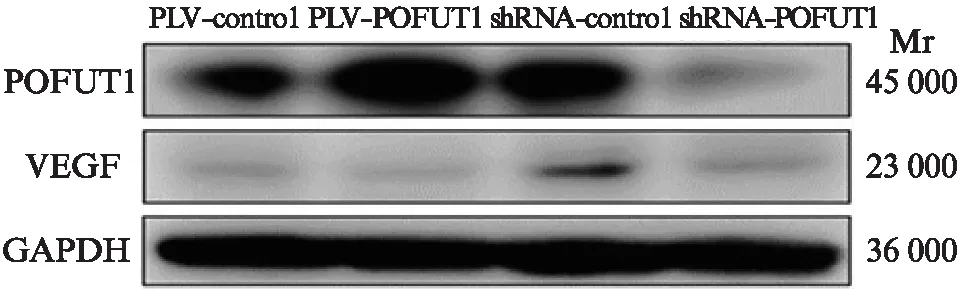
图5 裸鼠移植瘤中POFUT1和VEGF的蛋白表达水平Fig.5 Protein expressions of POFUT1 and VEGF in the transplanted tumors
3 讨 论
胃癌作为一种严重威胁人类健康的恶性肿瘤,手术完全切除仍是治疗未转移胃癌患者的主要手段;但是胃癌术后复发率高达50%~70%,5年生存率仅20%~50%,而发生转移的患者5年生存率低于5%,侵袭和转移是导致胃癌患者死亡的最主要原因之一[1]。目前关于胃癌发病机制的研究主要集中于幽门螺杆菌、血管生成和基因改变方面。新生血管形成是由内皮祖细胞、内皮细胞、细胞基质在各种促血管生长因子的作用下共同完成的[10]。肿瘤血管新生是胃癌等实体瘤生长、浸润和转移非常关键的因素,一方面为其提供所需要的营养和新陈代谢的途径,另一方面因其管壁通透性高而有利于肿瘤细胞的转移[11]。VEGF是一种具有高度特异性的血管内皮细胞刺激因子和血管通透因子,不仅参与新生血管的构建,还促使内皮细胞发生迁移和血管内物质渗漏[12]。因此,VEGF与肿瘤血管新生密切相关,是肿瘤发生发展的重要标志。蛋白-O-岩藻糖基转移酶1(POFUT1)和蛋白-O-岩藻糖基转移酶2(POFUT2)的结构十分相似,同属于FUT家族,以GDP-Fuc为糖基供体将L-Fuc转移到肽链Ser/Thr的侧链羟基上,催化合成O-岩藻糖苷键[13]。POFUT1在机体的分化和发育过程中发挥极其重要的作用。有研究表明,沉默果蝇体内的POFUT1,会影响Notch受体-配体蛋白的互相结合,并影响其信号转导,以至于果蝇出现机体发育不全[14]。另外,POFUT1基因突变可致小鼠胚胎发育出现异常[15]。目前,研究发现POFUT1在口腔癌中表达增高,而且POFUT1表达与肿瘤大小显著相关,其表达能促进肿瘤进展,也可成为口腔癌诊断和治疗的靶点[2]。POFUT1-Notch在肝癌中出现异常活化,POFUT1过表达能够促进肝癌进展[3]。在胃癌方面,利用oncomine数据库在mRNA水平分析胃黏膜上皮与胃癌中POFUT1的表达水平,对69例胃癌样本进行分析,发现在胃癌中POFUT1的表达显著增加[16]。同时,在细胞水平上的研究表明,POFUT1可能通过Notch信号通路调控E-cadherin/β-catenin的表达而影响胃癌细胞的迁移和侵袭,POFUT1能够促进胃癌细胞生长,增强胃癌细胞的迁移和侵袭能力[16]。目前,对于POFUT-1在肿瘤血管新生中的作用机制尚不清楚,所以,本研究的创新处在于探讨POFUT-1对人胃腺癌裸鼠移植瘤微血管生成的作用。本试验通过制备人胃腺癌BGC823的POFUT-1慢病毒低表达及其对照组、过表达及其对照组细胞模型,采用皮下成瘤的方法,分别用这4组细胞构建裸鼠皮下移植瘤模型,然后观察和测算肿瘤体积大小;30d后处死裸鼠并取瘤,应用免疫组化方法检测3组中POFUT1、VEGF、CD31的表达及其差异;另采用Western印迹法检测裸鼠瘤组织中POFUT1和VEGF的表达及其差异。结果显示,POFUT1基因低表达可显著抑制移植瘤生长,POFUT1基因过表达可显著促进移植瘤生长;POFUT1基因低表达时裸鼠肿瘤组织中VEGF表达明显低于shRNA control组,POFUT1过表达裸鼠肿瘤组织中VEGF表达明显高于PLV control组。
综上所述,POFUT1可能够通过抑制肿瘤微血管生成和VEGF表达来抑制裸鼠移植瘤微血管的生成。这为胃癌的靶向治疗提供了新的思路,具有重要的临床应用价值,但该作用机制的研究尚不成熟,还需不断研究探讨。
【参考文献】
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2): 69-90.
[2] YOKOTA S, OGAWARA K, KIMURA R, et al. Protein O-fucosyltransferase 1: a potential diagnostic marker and therapeutic target for human oral cancer[J]. Int J Oncol, 2013,43(6): 1864-1870.
[3] MA L, DONG P, LIU L, et al. Overexpression of protein O-fucosyltransferase 1 accelerates hepatocellular carcinoma progression via the Notch signaling pathway[J]. Biochem Biophys Res Commun, 2016,473(2): 503-510.
[5] RUNDHAUG J E. Matrix metalloproteinases and angiogenesis[J]. J Cell Mol Med, 2005,9(2): 267-285.
[6] BERGERS G, BENJAMIN L E. Tumorigenesis and the angiogenic switch[J]. Nat Rev Cancer, 2003,3: 401-410.
[7] MAEDA K, CHUNG Y S, TAKATSUKA S, et al.Tumour angiogenesis and tumour cell proliferation as prognostic indicators in gastric carcinoma[J]. Br J Cancer, 1995,72(2): 319-323.
[8] WEIDNER N, FOLKMAN J, POZZA F, et al. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma[J]. J Nail Cancer lnst, 1992,84: 1875-1887.
[9] DIAS F J, ISSA J P, BARBOSA A P, et al. Effects of low-level laser irradiation in ultrastructural morphology,and immunoexpression of VEGF and VEGF R-2 of rat masseter muscle[J]. Micron, 2012,43: 237-244
[10] 顾闻宇.内皮祖细胞在肿瘤新生血管形成中的作用机制[J].同济大学学报(医学版),2012,(1): 117-120,124.
[11] CHIEN C C, KEMPSON I M, WANG C L, et al. Complete microscale profiling of tumor microangiogenesis: a microradiological methodology reveals fundamental aspects of tumor angiogenesis and yields an array of quantitative parameters for its characterization[J]. Biotechnol Adv, 2013,31: 396-401
[12] NONAKA Y, YOSHIDA W, ABE K, et al. Affinity improvement of a VEGF a ptamer by in silico maturation for a sensitive VEGF-detection system[J]. Anal Chem, 2013,85: 1132-1137.
[13] CHEN C I, KEUSCH J J, KLEIN D, et al. Structure of human POFUT2: insights into thrombospondin type 1 repeat fold and O-fucosylation[J]. EMBO J, 2012,31(14): 3183-3197.
[14] STAHL M, UEMURA K, GE C, et al. Roles of Pofut1 and O-fucose in mammalian Notch signaling[J]. J Biol Chem, 2008,283(20): 13638-13651.
[15] YAO D, HUANG Y, HUANG X, et al. Protein O-fucosyltransferase 1 (Pofut1) regulates lymphoid and myeloid homeostasis through modulation of Notch receptor ligand interactions[J]. Blood, 2011,117(21): 5652-5662.
[16] DONG S, WANG Z, HUANG B, et al. Bioinformatics insight into glycosyltransferase gene expression in gastric cancer: POFUT1 is a potential biomarker[J]. Biochem Biophys Res Commun, 2017,483(1): 171-177.

