靶向整合素αvβ3受体磁共振/荧光双模态成像纳米探针的体外成像性能及光动力治疗效应评价
张旭南, 王培军
(同济大学附属同济医院影像科,上海 200065)
肺癌是一种严重威胁人类健康的恶性肿瘤,居我国肿瘤发病率和死亡率的首位[1-2]。早期肺癌起病隐匿,常规临床检查难以发现微小癌灶,当出现相应的肺癌症状时,预示着肺癌进展到中晚期或存在远处转移,丧失根治可能。因此对肺癌早期诊断及治疗的研究具有重要的临床意义和价值。临床常用检查手段是采用CT探查肺癌病灶,但对小病灶缺乏较高的特异性。近年来随着分子影像学的发展,由纳米化药物作为载体装载成像剂并修饰肿瘤特异性标记物而制成的分子影像探针,在细胞层面通过探针与癌细胞特异性高表达的蛋白发生反应,实现肿瘤早期敏感的特异性成像。RGD-Gd@BSA-Ce6是以牛血清白蛋白(bovine serum albumin, BSA)作为载体[3],装载钆剂及光敏剂Ce6,使具有磁共振/荧光双模态成像功能同时发挥光敏剂光动力治疗作用。文献报道,整合素αvβ3受体在肺癌中明显高表达[4]。αvβ3被证实参与了肺癌组织发生、生长、侵袭和转移过程中的新生血管形成。不仅如此,αvβ3受体在肺癌中的高表达又可以增强癌细胞的恶性程度及耐化疗药的能力[5]。而小分子多肽精氨酸-甘氨酸-天冬氨酸序列(Arg-Gly-Asp, RGD)[6]可特异性识别并结合整合素αvβ3受体,因此可作为与肺癌细胞特异性结合的靶向剂。本研究通过体外测定RGD-Gd@BSA-Ce6的弛豫率和其磁共振T1加权图像,评估该纳米探针的MR成像性能;采用激光共聚焦成像和细胞光照毒性实验评估探针与肺癌细胞的靶向亲和力和光动力治疗效果,MTT实验评价纳米探针的生物安全性。
1 材料与方法
1.1 细胞与试剂
环状RDG小分子多肽、纳米探针Gd@BSA-Ce6由同济大学生物医学工程与纳米材料研究院李永勇教授实验课题组提供。非小细胞肺癌细胞系A549由同济大学附属肺科医院提供;DMEM高糖型培养液和PBS(磷酸盐缓冲液)购自美国HyClone公司;胎牛血清购自美国Gibco公司。
1.2 细胞培养与传代
以下各项操作均在同济大学生物医学工程与纳米材料研究院无菌细胞培养室的超净台中进行。人肺腺癌细胞A549在DMEM培养液(含10%胎牛血清)中维持,置于37℃、5% CO2恒温培养箱中培养。细胞为单层贴壁生长,待贴壁细胞融合达80%~90%时以胰酶(含0.02%EDTA)消化传代。
1.3 纳米探针磁共振T1弛豫率及T1加权信号采集
将RGD-Gd@BSA-Ce6和商品化Gd-DTPA(商品名: 钆喷酸葡胺注射液)用PBS稀释获得不同浓度(以Gd3+的浓度计0.022、0.043、0.087、0.173、0.347、0.693mmol/L),每一种浓度取200μL置于核磁管中,采用体外磁场发生仪(EIS AB MFG-1000 In Vitro Magnetic Field Generator)进行T1弛豫时间数据的采集,并计算RGD-Gd@BSA-Ce6和Gd-DTPA各自T1的弛豫率。弛豫时间测量完成后,对r1值进行拟合计算。
将所用样品放置于磁共振线圈中(头颈部线圈),采用西门子公司3.0T磁共振(Siemens Verio 3.0T MRI)进行横断位扫描,扫描参数为: 重复时间(repeat time,TR)=600ms,回波时间(echo time,TE)=10ms,层厚(slice thickness)=2.0mm,FOV read=150mm。将扫描图像传输至工作站。
1.4 激光共聚焦成像
取悬浮在高糖DMEM培养液中的A549细胞进行细胞计数,配制成2ml细胞悬液接种在6孔板中(3.0×105/孔)。随后置于37℃、5%CO2培养箱中培养24h,待细胞贴壁。然后滴加Ce6、Gd@BSA-Ce6和RGD-Gd@BSA-Ce6(Ce6的最终浓度为0.6μmol/L),在37℃下共培养2h,然后将细胞用PBS漂洗2次,每孔滴加4%多聚甲醛1ml固定10min,去除多聚甲醛后用0.5ml的DAPI染色10min。用PBS漂洗3次后,滴加抗荧光淬灭封片剂,锡箔纸封装避光保存。最后采用共聚焦激光扫描显微镜成像。
1.5 A549细胞光动力治疗
将A549细胞悬液100μL/孔(细胞数目约为8×103)分别加入96孔板中,每一种浓度设置4个复孔,随后置于37℃、5%CO2培养箱中培养24h,待细胞贴壁。将事先配置好的含药培养基Gd@BSA-Ce6、RGD-Gd@BSA-Ce6和游离Ce6溶液(以Ce6浓度计: 0.3、0.6、1.2、2.4、4.8μmol/L)加入96孔板中(100μL/孔)共孵育24h。同时设立两组对照组,一组加入不含任何细胞和纳米材料的培养基,另一组只加入含细胞的培养基。取1个96孔板做光照组,给予650nm波长光激发,强度为5mW/cm2,每孔光照持续3min。光激发结束将光照组96孔板置于37℃、5%CO2培养箱中孵育4h,随后每个孔加入CCK8检测试剂20μL,再次孵育1h后使用酶标仪于450nm处测定每孔吸光度(D450)并计算细胞存活率。
1.6 细胞水平生物安全性
为了了解细胞水平上RGD-Gd@BSA-Ce6探针的生物安全性,将293T细胞悬液100μL/孔(细胞数目约为8×103个)加入到96孔板中,同样每一种浓度设置4个复孔,随后置于37℃、5%CO2培养箱中培养72h。待80%细胞融合贴壁,将事先配置好的含药培养基Gd@BSA-Ce6、RGD-Gd@BSA-Ce6和游离Ce6溶液(以Ce6浓度计,具体浓度同实验1.5)加入96孔板中(100μL/孔)共孵育24h。每个孔加入MTT细胞毒性检测试剂10μL,37℃孵育4h后使用酶标仪于490nm处测定每孔吸光度(D490)并计算细胞存活率。
1.7 统计学处理
2 结 果
2.1 RGD-Gd@BSA-Ce6弛豫率测定结果
Gd3+造影剂是一种顺磁性造影剂,其T1信号强度随着Gd3+浓度的升高而增加,因此RGD-Gd@BSA-Ce6的成像效果可以通过T1弛豫率来评估。结果显示,RGD-Gd@BSA-Ce6的弛豫系数为18.615,Gd-DTPA的弛豫系数为3.404,RGD-Gd@BSA-Ce6是Gd-DTPA的5.5倍,见图1。T1加权图像表现出随着Gd3+浓度升高,二者的T1信号明显增加,且同一浓度下RGD-Gd@BSA-Ce6的信号显著高于Gd-DTPA,见图2。

图1 RGD-Gd@BSA-Ce6及 Gd-DTPA弛豫系数拟合图Fig.1 The linear fitting chart about relaxation coefficient of RGD-Gd@BSA-Ce6 and Gd-DTPA
2.2 A549肺腺癌细胞对纳米探针的摄取情况
共聚焦激光扫描显微镜结果显示,与游离Ce6组相比,Gd@BSA-Ce6组的融合荧光强度明显增强;而与Gd@BSA-Ce6组相比,RGD-Gd@BSA-Ce6组的融合荧光强度明显增强,见图3。

图2 RGD-Gd@BSA-Ce6、Gd-DTPA和PBS磁共振T1加权图Fig.2 MRI T1-weighted image of RGD-Gd@BSA-Ce6,Gd-DTPA and PBS
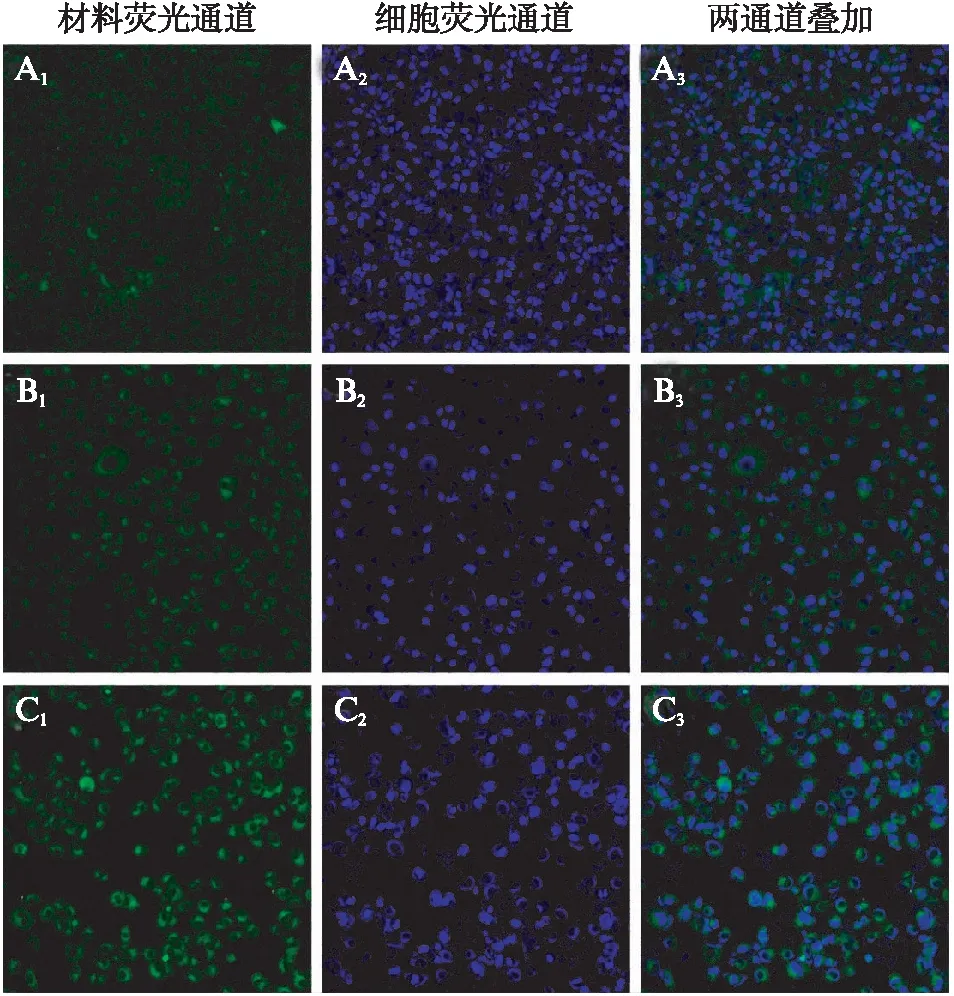
图3 A549肺腺癌细胞分别与游离Ce6、Gd@BSA-Ce6、RGD-Gd@BSA-Ce6共孵育2h后的激光共聚焦图像Fig.3 The laser confocal imaging of lung adenocarcinoma A549 cells incubated with free Ce6, Gd@BSA-Ce6 and RGD-Gd@BSA-Ce6 for 2hA1~3游离Ce6; B1~3: Gd@BSA-Ce6;C1~3: RGD-Gd@BSA-Ce6
2.3 纳米探针对A549肺腺癌细胞暗毒性和光毒性影响
CCK8实验结果显示,非光照组中不同浓度下三种药物的细胞存活率都在60%以上,其组内与组间对比差异无统计学意义(P>0.05),且与不加药物的对照组对比无明显变化(P>0.05)。而光照组中,在特定波长光激发下随着浓度增加,各个处理组中相对细胞存活率呈减小趋势,同时RGD-Gd@BSA-Ce6(Ce6浓度: 1.2~4.8μmol/L)处理组较相同Ce6浓度的游离Ce6组和Gd@BSA-Ce6组表现出明显的细胞毒性作用(P<0.05),见图4。
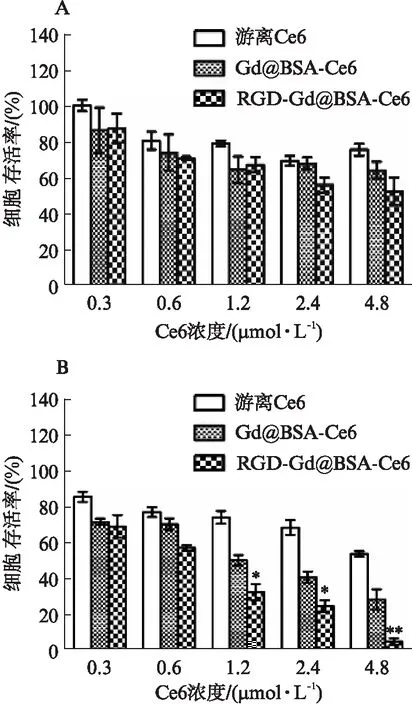
图4 不同浓度游离Ce6、Gd@BSA-Ce6和RGD-Gd@BSA-Ce6作用于A549肺腺癌细胞24h后细胞相对活力图Fig.4 The relative cell viability of lung adenocarcinoma A549 cells after incubation with different concentrations of free Ce6, Gd@BSA-Ce6 and RGD-Gd@BSA-Ce6 respectively A: 光照;B: 未光照
2.4 纳米探针对293T细胞的生物安全性效应
MTT实验结果显示,在与不同浓度三种药物共培养下,细胞存活率都在60%以上,各组内与组间对比差异无统计学意义(P>0.05)且与不加药物的对照组对比差异无统计学意义(P>0.05),见图5。
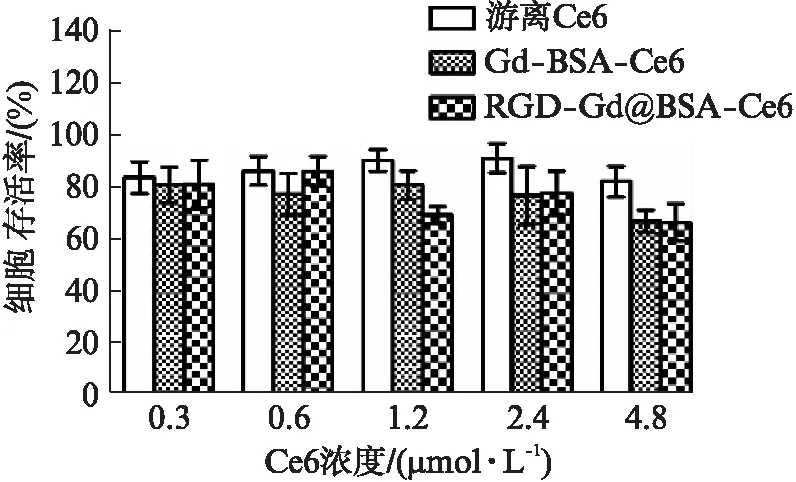
图5 不同浓度游离Ce6、Gd@BSA-Ce6和RGD-Gd@BSA-Ce6作用于293T细胞24h后细胞相对活力图Fig.5 The relative cell viability of 293T cell after incubation with different concentrations of free Ce6, Gd@BSA-Ce6 and RGD-Gd@BSA-Ce6 respectively
3 讨 论
在我国及世界范围内,肺癌的发病率及死亡率在多种肿瘤中居于首位,死亡率皆在40%~54%左右,而且早期难以发现,确诊患者中有75%已是肺癌晚期。作为一种高发病率、高死亡率的恶性肿瘤,肺癌已经严重威胁了人类身体健康并造成巨大的家庭和社会负担。肺癌的早期诊断和治疗显得尤为重要,而传统的影像学诊断存在一定滞后性和低敏感性,分子影像技术可为实现早期诊断和治疗提供有力支持。
整合素是一类广泛表达在细胞膜表面的受体蛋白,主要参与细胞间和细胞与细胞外基质间的黏附作用。整合素家族中,αvβ3受体已被证实在肿瘤细胞及肿瘤新生血管内皮细胞表面广泛高表达,且参与肿瘤早期发生、生长、浸润和转移[7],是一种针对肺癌等实体肿瘤的理想靶向标记物。RGD作为一种靶向整合素αvβ3受体的小分子多肽,未来有望成为构建靶向结合肿瘤组织的有效生物标记物之一。
荧光成像由于其灵敏性高、重复性好、光稳定性高、提供信息量多等优点[8],在生命科学领域具有广泛的应用价值。在肿瘤成像方面,多种肿瘤靶向的标记物可快速广泛进行荧光标记,从而在细胞及分子水平获取肿瘤发生、发展与周围组织的关系等多种行为学信息。二氢卟吩e6(Ce6)提取于植物叶绿素,来源丰富,在肿瘤组织中选择率高且正常组织代谢效率高。不仅如此,Ce6可在一定范围内波长的激光照射下产生较多的单线态氧,发挥光动力治疗优势。由于Ce6容易在肿瘤组织内富集,这使得产生的光动力治疗效果对肿瘤组织的选择性高而减少对正常组织的损伤少。近几年来研究表明,Ce6已在黑色素瘤[8]、肺癌[10]、膀胱癌[11]、皮肤癌[12]等多种肿瘤中表现出较好的治疗功效。本研究表明,对比非光照条件下的靶向纳米探针,光照条件下靶向纳米探针具备对肺癌细胞的高效杀伤作用。
MRI作为一种临床上广泛应用的成像技术具有高空间分辨率、高组织穿透性及无电离辐射等优点,同时又具有多参数、多序列成像以及血管成像、水成像、波谱成像等多种特殊成像功能,这使得其在分子影像研究领域得到广泛应用,也成为实现双/多模态成像功能的有效补充。目前临床上最常用的MRI对比剂是T1对比剂(钆喷酸葡胺)。利用Gd3+这一强顺磁性的金属离子,可显著缩短T1的驰豫时间,提高T1信号强度。本研究利用生物矿化技术制备整合素靶向的分子影像探针RGD-Gd@BSA-Ce6,通过弛豫率测定和T1加权图像扫描,发现其表现出比商品化Gd-DTPA更显著的成像性能。
BSA作为牛血清中的一种白蛋白,具有多种氨基酸残基和可修饰官能团,可与多种阳离子、阴离子和其他小分子物质结合,具有生物相容性良好、易修饰和合成绿色便捷等理化特性,在纳米医学和材料学领域被广泛用作纳米探针的载体[3,12]。本研究中通过生物矿化法合成RGD-Gd@BSA-Ce6分子影像探针,融合了荧光成像和MRI的优势且提高了光动力治疗效果,在激光共聚焦实验中,癌细胞对三种药物存在明显的结合能力差异。其可能的原因在于: 游离Ce6作为一种疏水性物质,在血清或细胞外液中容易发生团聚,不易被肿瘤细胞吞噬;而Gd@BSA-Ce6和RGD-Gd@BSA-Ce6有亲水性的蛋白衣壳结构包载Ce6,可增加其亲水性。同时,由于整合素靶向结合多肽RGD的存在,使探针更加容易牢固聚集在肿瘤细胞周围,增加被摄取的概率。
生物大分子BSA包载的光敏剂和钆剂不仅能提高脂溶性的Ce6在血液和组织间液中的溶解性,而且在探针合成过程中联合PEG修饰可显著降低游离钆剂和Ce6对正常组织器官的毒性作用,保证纳米探针在体内的长时间循环,改善药代动力学。本实验中,不同浓度下三种药物与人胚胎肾细胞293T共孵育24h后各组细胞存活率均超过60%,这证实RGD-Gd@BSA-Ce6具有良好的生物相容性。然而,本研究也存在一些缺点: (1) 由于肺的构造和功能特点,肺癌的早期临床诊断主要依赖于CT,而MRI由于扫描时间长,无法避免因肺呼吸运动而产生的伪影,因此目前MRI对肺癌诊断缺乏早期诊断优势。(2) 肺癌组织位于机体内部,而Ce6的激发光对机体的穿透深度仅为1~3cm,有限的穿透能力尚不能激发聚集肺肿瘤组织上的纳米探针产生良好成像和光动力治疗效应。(3) 本实验并未在活体上进行靶向成像实验和光动力治疗实验,体内外环境的差异对探针的成像和治疗效果的影响仍无法准确评估。
综上所述,通过生物矿化技术制备具有整合素αvβ3受体靶向功能的BSA探针载体,包覆钆剂和光敏剂Ce6而制备成的影像探针,具有优于商品化Gd-DTPA的T1成像性能和显著的与A549肺癌细胞结合能力,可发挥良好的MRI和荧光双模态成像和光动力治疗功效。它融合了MRI增强成像的高分辨率、高穿透深度和无辐射特点及荧光成像的敏感性高、光稳定性良好、可重复利用、光照激发产生大量单线态氧等优势,避免了MRI的低敏感性和荧光成像受组织深度的限制等劣势。MRI/荧光双模态成像并辅助光动力治疗的影像探针,未来有望提高肺癌的检出率和减少对比剂注入次数,并实现早期诊断、术中导航、辅助治疗、术后评估等一系列诊疗措施,展现出新型分子影像探针巨大的诊疗一体化优势。
【参考文献】
[1] 支修益,石远凯,于金明.中国原发性肺癌诊疗规范(2015年版)[J].世界临床药物,2016,37(7): 433-436.
[2] 宋勇,杨雯.2014年晚期非小细胞肺癌内科治疗进展[J].解放军医学杂志,2015,40(1): 10-15.
[3] WEN Y, DONG H, LI Y, et al. Nano-assembly of bovine serum albumin driven by rare-earth-ion (Gd) biomineralization for highly efficient photodynamic therapy and tumor imaging[J]. J Mater Chem B, 2016,4(4): 743-751.
[4] CHEN X, SIEVERS E, HOU Y, et al. Integrin αvβ3-targeted imaging of lung cancer[J]. Neoplasia, 2005,7(3): 271.
[5] GAO J, HU Z, LIU D, et al. Expression of Lewis y antigen and integrin αvβ3 in ovarian cancer and their relationship with chemotherapeutic drug resistance[J]. J Exp Clin Cancer Res, 2013,32(1): 36.
[6] GUO Z M, HE B, JIN H W, et al. Targeting efficiency of RGD-modified nanocarriers with different ligand intervals in response to integrin αvβ3 clustering[J]. Biomaterials, 2014,35: 6106-6117.
[7] QIU Q, WANG Q, DENG C, et al. Small molecular peptide-ScFv αvβ3 conjugates specifically inhibit lung cancer cell growth in vitro and in vivo[J]. Am J Cancer Res, 2016,6(12): 2846.
[8] SHELEG S V, ZHAVRID E A, KHODINA T V, et al. Photodynamic therapy with chlorin e(6) for skin metastases of melanoma[J]. Photodermatol Photoimmunol Photomedicine, 2004,20(1): 21-26.
[9] 刘峰君,叶雯,何欣源等.胰腺癌细胞纳米探针的磁共振荧光双模态成像及抗肿瘤效果观察.中国临床医学,2016,23(4): 428-432.
[10] CHEN B, ZHENG R, LIU D, et al. The tumor affinity of chlorin e6 and its sonodynamic effects on non-small cell lung cancer[J]. Ultrasonics Sonochem, 2013,20(2): 667-73.
[11] CHINW W, LAU W K, BHUVANESWARI R, et al. Chlorin e6-polyvinylpyrrolidone as a fluorescent marker for fluorescence diagnosis of human bladder cancer implanted on the chick chorioallantoic membrane model[J]. Cancer Letters, 2007,245(1-2): 127.
[12] BEACK S, KONG W H, JUNG H S, et al. Photodynamic therapy of melanoma skin cancer using carbon dot-chlorin e6-hyaluronate conjugate[J]. Acta Biomaterialia, 2015,26: 295.
[13] ZHANG B, JIN H, LI Y, et al. Bioinspired synthesis of gadolinium-based hybrid nanoparticles as MRI blood pool contrast agents with high relaxivity[J]. J Mater Chem, 2012,22(29): 14494-14501.

