ZIC5在前列腺癌中的表达及意义
张 瑜, 奚雪滔, 赵 雪
(上海交通大学医学院附属同仁医院泌尿外科,上海 200336)
前列腺癌(prostate cancer)是男性十大致死性肿瘤之一,发病率逐步上升[1]。前列腺癌根治术和内分泌治疗能改善患者生存期,中、高危局限性前列腺癌的10年复发率分别为54%和71%[2],中国前列腺癌患者近10年死亡率缓慢上升[1]。在内分泌治疗18~24个月后,大部分患者会进展为激素非依赖性前列腺癌[3];虽然仍然可以选择行放化疗,但预后差,进展迅速。因此,亟待寻找新的治疗方法,而基因靶向治疗也是近年一直探索的方向。ZIC5(Zic family member 5)是ZIC家族中一员。ZIC蛋白家族参与调控许多发育过程,ZIC1、ZIC2、ZIC3参与调控转录活动,可以抑制I-mfa。但关于ZIC5的研究甚少,有研究报道ZIC5具有促癌作用。Satow等报道了ZIC5受PDGFD调控,增强黑色素瘤的侵袭性。本研究旨在探讨ZIC5在前列腺癌中的表达水平及其对前列腺癌生物学特性的影响。
1 材料与方法
1.1 细胞培养
人前列腺癌细胞株PC3和LNCaP购自上海中国科学院细胞库。LNCaP为雄素依赖性前列腺癌细胞。PC3细胞源于骨转移的前列腺癌,具有雄激素非依赖性。两种细胞均培养于含10%胎牛血清的RPMI 1640培养液(Gibco,上海立菲生物科技有限公司)中,置于37℃、5%CO2的孵箱中培养。人前列腺正常上皮细胞RWPE-l购自上海中科院细胞库,使用KSMF培养液(Gibco,上海立菲生物科技有限公司)培养。293细胞使用DMEM(10%胎牛血清和1%抗生素)培养液培养。抽提PC3、LNCaP和RWPE-1细胞的RNA和蛋白。选取2013年1月至2016年12月于上海交通大学医学院附属同仁医院收集的前列腺癌根治术标本以及配对的癌旁正常组织标本38例,平均年龄(70.8±7.6)岁。
1.2 细胞转染
人前列腺癌细胞LNCaP和PC3接种于6孔培养板并贴壁后,使用阳离子脂质载体LipofectamineTM2000将ZIC5 siRNA转染入LNCaP和PC3细胞,转染前细胞密度为70%~85%,转染空白载体组(negative control, NC)组作为阴性对照组,siRNA和NC组转染终浓度为50nmol/L,转染48h后抽提总RNA,72h后抽提总蛋白。ZIC5 siRNA序列由上海吉玛制药有限公司设计,并合成为siRNA Oligo用于瞬时转染。其中ZIC5 siRNA-3序列如下。上游引物: 5′-CGUAGCAAAGGAACAGCA-TT-3′,下游引物: 5′-UGCUGUUCCUUUGCUAC-GGTT-3′。NC序列: 上游引物5′-UUCUCCGAAC-GUGUCACGUTT-3′;下游引物5′-ACGUGACACG-UUCGGAGAATT-3′。
1.3 荧光定量RT-PCR
TRIzol(Invitrogen,美国)法提取各实验组LNCaP和PC3细胞以及液氮中冻存的前列腺癌组织标本总RNA,反转录获取cDNA后进行PCR反应。PCR反应条件如下: 94℃变性;94℃变性20s,57℃退火40s,72℃延伸40s,32个循环;72℃孵育10min。qRT-PCR引物如下。ZIC5上游引物: 5′-GTCTATGGGCCTGATTGTGTAGT-3′;下游引物: 5′-GCCAAATCCGCTAATCTCA-GC-3′;GAPDH上游引物: 5′-GGAGCGAGATC-CCTCCAAAAT-3′;下游引物: 5′-GGCTGTTGT-CATACTTCTCATGG-3′。miR-449荧光定量则使用TaqMan microRNA检测试剂盒和TaqMan探针。2-ΔΔCt法分析相对表达量。
1.4 Western印迹法分析
转染siRNA ZIC5 72h,使用RIPA细胞裂解液(江苏碧云天公司,P1003B)提取蛋白,二辛可酸(bicinchonininc acid, BCA)试剂盒(江苏碧云天公司)测定蛋白浓度,并调整待测样本的蛋白质含量。每孔加30μg的蛋白样品,电泳、转膜、封闭,按1∶1000稀释一抗孵育,置4℃孵育过夜。PBST中洗膜3次,每次10min,分别按1∶1000稀释二抗孵育1h,PBST中洗膜3次,每次10min。通过Odyssey双色红外荧光成像系统(美国LICOR公司)读取目的电泳条带的光密度值。ZIC5(货号: ab115566)、E-cadherin(货号: ab15148)、Vimentin(货号: ab92547)购于Abcam公司。
1.5 Transwell迁移实验
siRNA组和NC对照组细胞从6孔板中消化下来,将细胞密度调整为3×105/mL,取0.2mL接种到Transwell小室,将Transwell小室置于24孔板内,上室内为含1%血清的培养液,下室添加含10%血清的培养液0.5mL。培养18h后用棉签头擦掉小室内细胞,甲醇固定,0.1%结晶紫染色,洗净风干后于Leica荧光倒置显微镜200倍视野下拍照,随机选取4个视野拍照,计数细胞。
1.6 细胞侵袭实验
将Matrigel在4℃冰箱中融化成液体,1∶8稀释后,在上室加入稀释后的Matrigel(BD公司)60~80μL,37℃ 30min使Matrigel聚合成凝胶。siRNA组和NC对照组细胞从6孔板中消化下来,调整细胞密度为4×105/ml,取0.2mL接种到Transwell小室,并将Transwell小室置于24孔板内,上室内为含1%血清的培养液,下室为含10%灭活血清的培养液。培养20h后用棉签头擦掉小室内细胞,甲醇固定,0.1%结晶紫染色,洗净风干后于Leica荧光倒置显微镜200倍视野下拍照,随机选取4个视野拍照,计数细胞。
1.7 miRNA预测及双荧光素酶报告实验
使用Target Scan和miRanda生物信息平台分析,在ZIC5 3’UTR区320~326位点上可能是miR-449家族的结合位点,体外合成该位点的DNA片段(wild type, WT)及该位点缺失的突变体的DNA片段(Mutant,MUT),并将这两个片段克隆至含双荧光素酶报告基因的载体psiCHECK-2中。WT和MUT质粒与miR-449家族mimics(hsa-miR-449a: UGGC-AGUGUAUUGUUAGCUGGU;hsa-miR-449b: AGG-CAGUGUAUUGUUAGCUGGC)[5]分别转染至293细胞中,48h后荧光素酶检测试剂盒测荧光素酶活性。
1.8 统计学处理
2 结 果
2.1 ZIC5在前列腺癌中表达水平上升
定量PCR显示,在前列腺癌细胞株PC3(PC3vsRWPE-1,t=7.625,P=0.002)和LNCaP(LNCaPvsRWPE-1,t=3.519,P=0.025)中表达水平显著高于正常前列腺上皮细胞RWPE-1。38例前列腺癌中,28(75.7%)例前列腺癌患者标本ZIC5表达水平较癌旁正常组织高(t=4.201,P<0.001)。高表达的ZIC5与前列腺癌Gleason评分具有相关性。根据Gleason评分将入组患者分为≥7分(23例)组和<7分组(15例),以及根据ZIC5表达水平的中位数分为ZIC5高表达组(28例)和低表达组(10例),结果显示在Gleason评分≥7分组中,ZIC5高表达患者比例显著升高(20/23),Fisher精确概率相关性分析显示差异有统计学意义,表明ZIC5表达水平与Gleason评分具有相关性(P<0.05)。
2.2 siRNA成功干扰ZIC表达水平
使用LipofectamineTM2000转染ZIC5 siRNA。q-RT-PCR显示,转染siRNA后,成功干扰ZIC5 RNA在前列腺癌PC3和LNCaP中的表达水平,蛋白质免疫印迹杂交显示,ZIC5蛋白水平较对照组也显著下降,见图1。
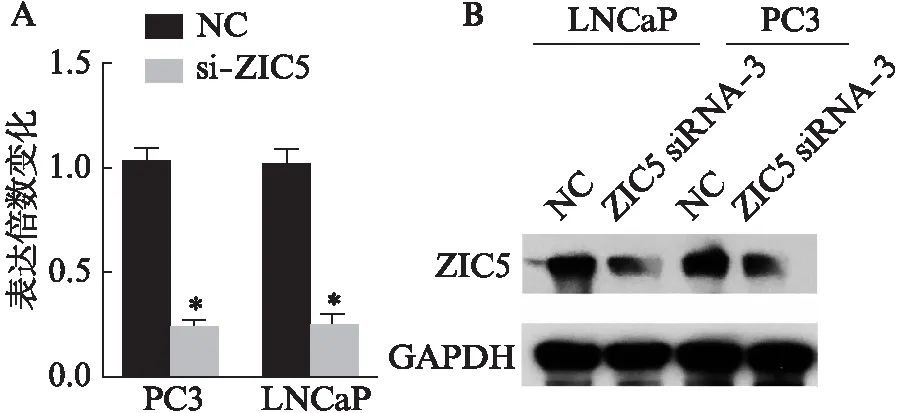
图1 si-ZIC5成功干扰ZIC5 mRNA和蛋白在前列腺癌细胞株中表达Fig.1 ZIC5 mRNA and protein were successfully knocked down by using siRNA ZIC 5A: siRNA ZIC5成功干扰;B: ZIC5蛋白在前列腺癌细胞株中的表达;与NC组相比,*P<0.001
2.3 ZIC5 siRNA抑制前列腺癌细胞增殖
成功干扰ZIC5在前列腺癌细胞株中的表达水平后,CCK-8增殖能力检测显示,PC3和LNCaP细胞的在24h后增殖能力出现下降,与对照组比较,差异具有统计学意义(P<0.01),见图2。
2.4 ZIC5 siRNA抑制前列腺癌细胞迁移和侵袭
成功干扰ZIC5在前列腺癌细胞株中的表达水平后,Transwell迁移能力检测显示,PC3(NCvssi-ZIC5:t=18.73,P<0.001)和LNCaP(NCvssi-ZIC5:t=16.2,P<0.001)细胞的迁移能力出现下降,同对照组比较,差异具有统计学意义。在Transwell上室铺Matrigel基质胶,检测干扰ZIC5后前列腺癌细胞侵袭能力变化。结果显示,siRNA组PC3(NCvssi-ZIC5:t=7.82,P<0.01)和LNCaP前列腺癌细胞侵袭能力同NC对照组相比显著下降(NCvssi-ZIC5:t=4.62,P<0.01),见图3。
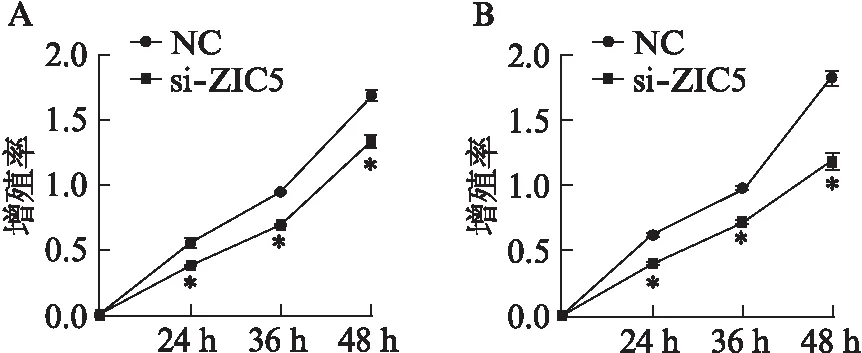
图2 干扰ZIC5表达后显著抑制前列腺癌细胞增殖Fig.2 Proliferation of prostate cancer cells was suppressed after downregulation of ZIC5A: PC3;B: LNCaP;与NC组相比,*P<0.01

图3 干扰ZIC5抑制前列腺癌细胞迁移能力和侵袭能力Fig.3 Knock-down of ZIC 5 inhibited cell migration and cell invasion of prostate cancer cellsA: 前列腺细胞迁移能力;B: 前列腺癌细胞侵袭能力;与NC组相比,*P<0.05
2.5 ZIC5与miR-449表达呈负相关
通过miRanda和Target Scan生物信息平台,筛选到miR-449家族可能是ZIC5上游调控miRNA。荧光定量PCR结果显示,miR-449a(24/38)和miR-449b(25/38)在前列腺癌组织中表达水平显著低于癌旁正常组织,差异有统计学意义,见图4。线性回归分析发现,ZIC5 mRNA与miR-449a(r=-0.64,P<0.05)、miR-449b(r=-0.52,P<0.05)在前列腺癌组织中的表达水平呈负相关,见图5。构建ZIC5 3’UTR野生型载体(WT)以及miR-449a和miR-449b结合位点突变型载体(MUT),突变ZIC5 3’UTR上miR-449a和miR-449b结合位点后,转入miR-449a和miR-449b,相对荧光值未见明显变化,而野生型中则显著降低,见图5,表明miR-449a和miR-449b,结合ZIC5 3’UTR,干扰其表达。
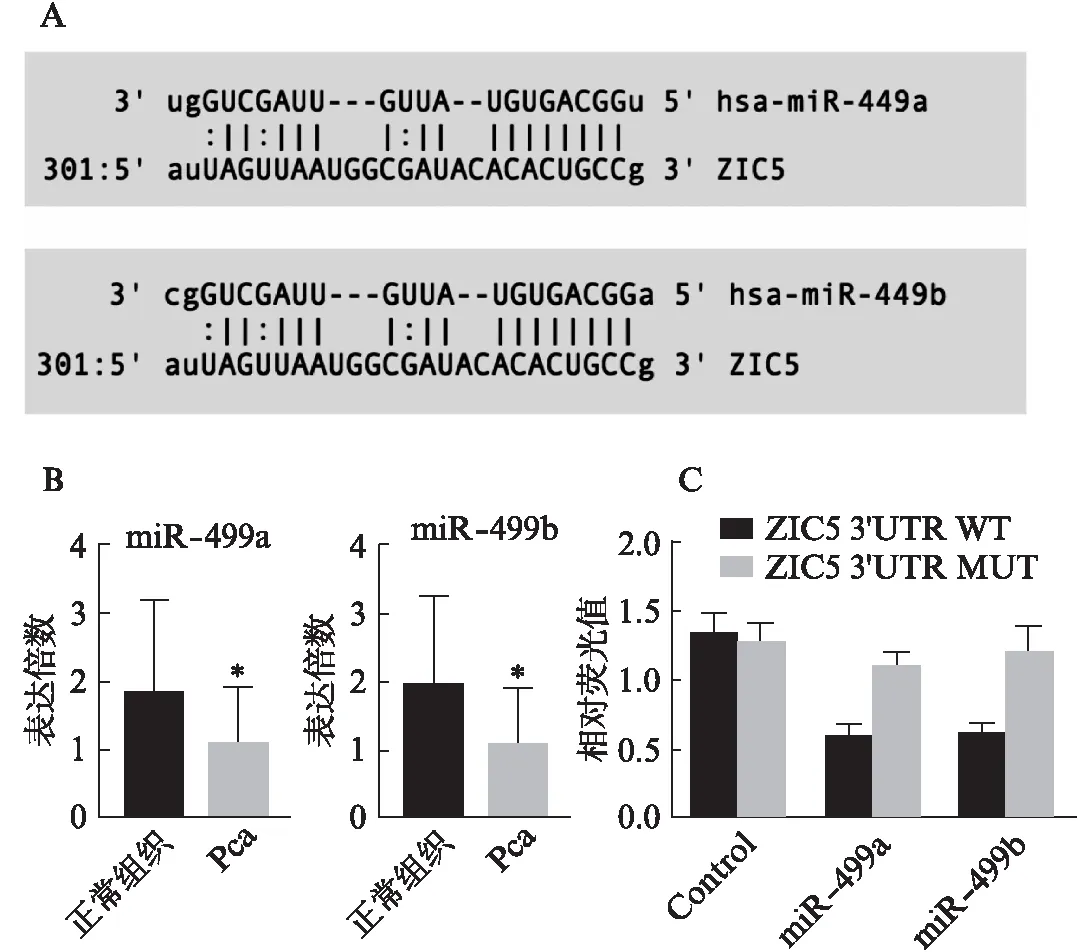
图4 ZIC5与miR-449a家族在前列腺癌中的表达水平及双荧光素酶基因验证Fig.4 Correlation between ZIC5 and miR-449 family in prostate cancer samples and miR-449 family targeting ZIC5 3’UTR was verifiedA:ZIC5 3’UTR 上miR-449a和miR-449b结合位点预测;B:miR-449a和miR-449b在前列腺癌和癌旁正常组织中表达水平; C:双荧光素酶报告基因验证miR-449a和miR-449b靶向ZIC5 3’UTR;与癌旁正常组织相比,*P<0.05
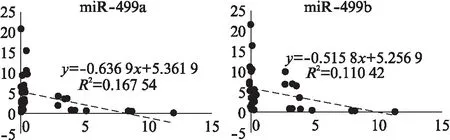
图5 miR-449a和miR-449b与ZIC5相关性分析Fig.5 Correlation analysis between miR-449a, miR-449b and ZIC5
2.6 miR-449和ZIC5逆转前列腺癌EMT状态
转染siRNA后,EMT通路中,Vimentin蛋白表达水平显著下降,E-cadherin水平呈现上升。转染ZIC5上游抑制miRNA miR-449家族mimics后,ZIC5、Vimentin蛋白水平呈现下降,E-cadherin水平上升,见图6。因此,miR-449家族通过靶向ZIC5,逆转EMT通路,抑制前列腺癌细胞生长。

图6 ZIC5激活前列腺癌中的上皮间质状态Fig.6 ZIC5 activates epithelial-mesenchymal transition in prostate cancer
3 讨 论
前列腺癌在我国的发病率正呈逐年上升的趋势,虽然前列腺癌根治和内分泌治疗能延长患者生存期,但进展为非激素依赖性前列腺癌时,肿瘤则发展迅速。基因靶向治疗可为非激素依赖性前列腺癌带来新的治疗策略,关于治疗靶点的研究也较多,但尚未出现特异和敏感性高的靶点。Nakata等[6]在非洲蟾蜍中鉴定出ZIC5。目前研究发现,ZIC基因家族编码锌指蛋白转录因子在中枢神经系统发育过程中具有重要作用,Nyholm等[7]报道了ZIC5在中脑盖发育过程中促进细胞增殖,组合的ZIC2-ZIC5通过调节Wnt信号通路调节细胞增殖。但关于ZIC5在肿瘤中作用的研究则甚少。Sun等[8]报道ZIC5在非小细胞肺癌(non-small-cell lung cancer, NSCLC)中表达水平上升,异常表达水平与NSCLC分级具有相关性。沉默ZIC5后,NSCLC细胞被抑制在G2期,细胞增殖能力被抑制[9]。本研究发现ZIC5在前列腺癌中表达水平较癌旁正常组织高,并且在Gleason评分高的组织中表达水平也高于对照组。干扰ZIC5后显著抑制前列腺癌细胞的增殖和迁移。ZIC5通过调节cyclin B1和CDK1磷酸化水平调节NSCLC细胞的增殖和侵袭。ZIC5不仅与肿瘤的发生相关,在肿瘤耐药性获得上也具有一定作用。Satow等[4]研究发现,ZIC5过表达能显著增强黑色素瘤细胞在体内外的生长和转移以及对化疗药物的耐受,ZIC5可能通过调节PDGFD和FAK促进黑色素瘤的发生、进展。
本研究通过生物信息学以及靶基因实验验证,ZIC5受miR-449家族调控,miR-449靶向ZIC5的3’-UTR,并且逆转EMT通路。microRNA在前列腺癌的发生和进展中具有重要作用[10],miR-449家族在许多肿瘤中是癌基因,促进肿瘤的发生和进展。Bou等[11]报道miR-449在胃癌中表达水平下降,过表达miR-449可以激活抑癌基因P53,抑制胃癌细胞生长和转移。Luo等[12]研究显示,miR-449在非小细胞肺癌中表达下降,过表达miR-449后抑制癌基因c-Met,抑制非小细胞肺癌的迁移和侵袭。因此,高表达的ZIC5促进肿瘤的发生和进展,在前列腺癌中充当癌基因作用,ZIC5的异常表达受miR-449家族调控,其在前列腺癌中表达水平显著下降。ZIC5可能系潜在的靶向治疗的靶基因。
【参考文献】
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2): 115-132.
[2] D’AMICO A V, MOUL J W, CARROLL P R, et al. Surrogate end point for prostate cancer-specific mortality after radical prostatectomy or radiation therapy[J]. J Natl Cancer Inst, 2003,95(18): 1376-1383.
[3] WONG Y N, FERRALDESCHI R, ATTARD G, et al. Evolution of androgen receptor targeted therapy for advanced prostate cancer[J]. Nat Rev Clin Oncol, 2014,11(6): 365-376.
[4] SATOW R, NAKAMURA T, KATO C, et al. ZIC5 drives melanoma aggressiveness by PDGFD-mediated activation of FAK and STAT3[J]. Cancer Res, 2017,77(2): 366-377.
[5] YANG X, FENG M, JIANG X, et al. miR-449a and miR-449b are direct transcriptional targets of E2F1 and negatively regulate pRb-E2F1 activity through a feedback loop by targeting CDK6 and CDC25A[J]. Genes Dev, 2009,23(20): 2388-2393.
[6] NAKATA K, KOYABU Y, ARUGA J, et al. A novel member of the Xenopus Zic family, Zic5, mediates neural crest development[J]. Mech Dev, 2000,99(1-2): 83-91.
[7] NYHOLM M K, WU S F, DORSKY R I, et al. The zebrafish zic2a-zic5 gene pair acts downstream of canonical Wnt signaling to control cell proliferation in the developing tectum[J]. Development, 2007,134(4): 735-746.
[8] SUN Q, SHI R, WANG X, et al. Overexpression of ZIC5 promotes proliferation in non-small cell lung cancer[J]. Biochem Biophys Res Commun, 2016,479(3): 502-509.
[9] MALUMBRES M, BARBACID M. Cell cycle, CDKs and cancer: a changing paradigm[J]. Nat Rev Cancer, 2009,9(3): 153-166.
[10] 李军亮,吴登龙,黄盛松,等.miRNA-29a调控H3K4甲基化在前列腺癌病理机理中的作用[J].同济大学学报(医学版),2016,37(6): 6-11.
[11] BOU-KHEIR T, FUTOMA-KAZMIERCZAK E, JACOBSEN A, et al. miR-449 inhibits cell proliferation and is down-regulated in gastric cancer[J]. Mol Cancer, 2011,10: 29.
[12] LUO W, HUANG B, LI Z, et al. MicroRNA-449a is downregulated in non-small cell lung cancer and inhibits migration and invasion by targeting c-Met[J]. PLoS One, 2013,8(5): e64759.

