酞菁配合物的合成及在肿瘤诊断与治疗中的研究进展
王远越 杨红 周治国 杨仕平

摘要:
由于酞菁(Pc)配合物具有大的共轭体系,在催化、光电转换以及生物医学领域均具有广泛的应用.Pc配合物的合成主要包括:插入配位合成方法、直接取代合成法、模板反应合成法.Pc配合物在肿瘤诊断与治疗领域的应用主要包括光声成像(PAI)、磁共振成像(MRI)、光动力治疗(PDT)以及光热治疗(PTT)等.综述了Pc配合物的合成和在肿瘤诊断与治疗领域的最新研究进展.
关键词:
酞菁; 合成; 生物医学
中图分类号: O 611.3文献标志码: A文章编号: 1000-5137(2018)01-0100-13
Synthesis and biomedical applications of phthalocyanine complexes
Wang Yuanyue, Yang Hong*, Zhou Zhiguo, Yang Shiping
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
Abstract:
Because of its large conjugated system,phthalocyanine complexes have been widely used in catalysis,photoelectric conversion,and biomedicine.Phthalocyanine complexes can be synthesized by many methods such as coordination insertion method,direct substitution method,and template reaction method.The applications of phthalocyanine complexes have been reported in tumor diagnosis and treatment mainly including photoacoustic imaging (PAI),magnetic resonance imaging (MRI),photodynamic therapy (PDT),and photothermal therapy (PTT).Here,the recent advances in synthesis and biomedical applications of phthalocyannine complexes were reviewed.
Key words:
phthalocyanine; synthesis; biomedicine
收稿日期: 2017-09-18
基金項目: 国家自然科学基金(21371122)
作者简介: 王远越(1992-),女,硕士研究生,主要从事铱配合物的合成及性质方面的研究.E-mail:1903458165@qq.com
*通信作者: 杨红(1978-),女,博士,教授,主要从事配位化学、纳米医学方面的研究.E-mail:yanghong@shnu.edu.cn
引用格式: 王远越,杨红,周治国,等.酞菁配合物的合成及在肿瘤诊断与治疗中的研究进展 [J].上海师范大学学报(自然科学版),2018,47(1):100-112.
Citation format: Wang Y Y,Yang H,Zhou Z G,et al.Synthesis and biomedical applications of phthalocyanine complexes [J].Journal of Shanghai Normal University(Natural Sciences),2018,47(1):100-112.
0引言
图1Pc和Pc配合物结构图
酞菁(Pc)是Scottish公司在1928年由邻苯二甲酸酐合成邻苯二甲酰亚胺的过程中,因一次设备事故意外发现的.它是一类卟啉的衍生物(图1),属于苯并氮杂卟啉.Pc具有很强的配位能力,能够与超过70种不同的元素进行配位,也可以与不同的配体形成轴向配位化合物或桥接配合物.由于Pc具有18电子大环共轭体系,使其最大吸收相对于卟啉显著红移,通过在Pc环上引入不同的取代基和中心金属离子,可以使其最大吸收红移至700~800 nm.Pc配合物不仅对组织的透过率较高,而且对光、热甚至酸碱具有较高的稳定性,有利于在生物体系中的应用.本文作者主要重点介绍了Pc配合物的合成方法以及在肿瘤诊断和治疗中的研究进展.
1Pc配合物的合成
根据不同的金属(M)可以合成不同的Pc化合物,例如Pc化合物H2Pc、Li2Pc、CuPc、AlC1Pc、AlOHPc、TiOPc、SiCl2Pc和Si(OH)2Pc.Pc纯化一般采用升华和溶液冲洗.常采用分区升华的方法提纯Pc化合物.该方法一般需要N2流.升华分为三个区域:升华区(高温区)、聚集区(中温区)和低温区,根据各个区域温度的不同实现杂质和Pc产物的收集.温度场和N2气流的存在使得传质成为可能,溶液冲洗是在Pc合成中用有机溶剂,碱性溶液和5%(质量分数)的热盐酸溶液连续洗涤.
1.1插入配位合成法
插入复合物合成法(简称插入法)首先合成无金属Pc,然后与金属盐反应,金属离子参与4个氮原子配位反应,使得相应的金属插入Pc环得到金属Pc配合物(图2).非金属Pc的中心孔直径比周期表中大多数金属离子大,使无金属Pc可以和几十种金属离子,特别是过渡金属离子形成稳定的金属Pc络合物.Cook 等[1]使用烷氧基取代酞腈合成的无金属Pc与金属盐反应,形成相应的金属Pc.在合成无金属Pc过程中,锂与正戊醇反应生成的戊醇锂促进该过程的进行.该方法的缺点是低产率(通常为20%~30%),并且产物通常与无金属Pc混合,不容易分离纯化,近年来一直使用较少.但是使用插入方法可以合成一些不稳定性金属Pc络合物,如Pc铁在一些有机溶剂中非常不稳定,对纯化过程带来了很多麻烦,用醇锂法得到纯的无金属Pc,然后用插入法获得金属络合物,可以解决后处理中Pc分解的问题.
图2插入法合成金属Pc化合物[2]
1.2直接取代合成法
该方法涉及具有取代基的金属Pc化合物.可以通过上述合成方法首选合成出具有取代基的非金属Pc配合物,然后控制一定的反应条件,加入一些相应的金属盐合成具有取代基的金属Pc化合物,但难以合成目标产物,不仅存在副产物,且可能存在异构体,产率低.Lobo等[3]参照此方法合成出一系列金属Pc化合物(图3).
图3直接取代合成法合成金属Pc
1.3模板反应合成法
模板反应合成方法是以中心金属为模板,可直接形成Pc环分子片段通过模板反应制备Pc金属络合物.与插入配位法相比,模板反应合成方法无需制备非金属Pc,而是通过分子片段和中心金属直接进行合成相应的金属Pc,该反应是一个很复杂的过程.合成步骤少于插入方法,产量一般较高(通常大于30%),产物中杂质种类少,很容易被纯化,近年来已被广泛使用.图4显示了从分子片段直接合成无金属Pc和酞菁金属络合物的主要合成方法.其中R1、R2、R3和R4可以是氢原子或其他取代基,例如羧基、酰氨基、腈基、硝基、磺酸基、卤素原子、烷氧基等.“模板反应”合成方法根据其使用的不同催化剂,可分为1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)液相催化法[4]和钼酸铵催化法.
图4模板反应合成方法
1.3.1DBU液相催化合成法
DBU为Pc碱性催化剂在成环反应中的催化能力将随着温度的升高而提高.该方法通常用于缩合一些更困难的分子片段[5].该方法具有一些缺点:在制备原料时需要用到剧毒的氰化物,且反应条件比较苛刻,需在无水条件下进行.但是因其产物产率较高且纯化方法简单而受到青睐.Liu 等[6]采用先将醇转化为相应的甲苯磺酸酯,然后用2,3-二氰基氢醌进行亲核取代,得到二取代的酞腈.在Zn(OAc)2·2H2O和DBU存在下,将这些化合物与过量的未取代的邻苯二甲腈进行反应,得到相应的“3+1”环化产物,由于苯环上的取代基增加了分子的水溶性使得分子是两亲性的,这是理想型光敏剂所具有的显著特性.
1.3.2钼酸铵固相催化合成法
图52-甲氧基-1,3-二甲基苯金属酞菁
(TDMP-MPc)合成路线图
在固化反应瓶中加入用来合成Pc配合物的分子碎片(邻苯二甲酸酐或邻苯二甲酰胺等衍生物)、催化剂(无机酸)、氨化剂(尿素等),还可以将反应物加入到无机盐作為助熔剂以降低熔融温度,进入马弗炉加热至熔融状态下进行.Kudo等[7]通过固相法合成烷氧基金属Pc(图5).当尿素熔融时,反应保持恒定一段时间.一方面可以防止尿素的分解失去大量的氨,另一方面也可以防止氨释放得太快.改变反应环境可以改善在熔融状态反应物混合物不均匀的现象[8].虽然反应方法比较简单,但是副产品比较多,影响产率,同时分离和纯化也比较困难.Shaabani等[9]在传统方法的基础上使用微波处理,高效地缩短合成时间并提高产率.
2Pc配合物在肿瘤诊断中的研究
成像已经成为癌症研究、临床试验和医学实践中不可或缺的工具.Pc类化合物由于大环的π体系的强疏水性相互作用,使其在水性介质中溶解度较低且易于聚集,导致光敏效率大大降低[10].目前光动力治疗(PDT)的主要限制因素为随着波长增加组织穿透深度降低,但人体组织对650~1 100 nm范围的光具有良好的组织穿透深度.因此目前Pc光敏剂的研究热点是:合成出具有良好水溶性、低聚集性且在近红外具有较强吸收的新型Pc衍生物.Pc类化合物由于具有特殊的结构,使其具有优良的光学性能,作为一种优良的光敏剂已获得广泛推广.Pc在可见光700 nm左右处有一个强烈的吸收带,当Pc分子同其他电学或光学活性基团连接后会具有许多独特的光学性质[11].
2.1Pc配合物在光声成像(PAI)中的研究成像
PAI技术是一种具有广泛应用前景的无损生物医学成像技术,其结合了纯光学成像高选择特性和纯超声成像中穿透深的优点,克服了光在组织中的高散射限制,实现了对活体深层组织的高分辨、高对比度成像.脉冲激光照射生物组织时,位于组织体内的吸收体吸收脉冲光能量,产生瞬时升温并膨胀,由此产生超声波.这时位于组织体表面的超声探测器可以接收到这些外传的超声波,并根据探测到的光声信号来重建组织内光能量吸收分布的图像[12](图6).该方法有机地结合了光学成像和声学成像的特点,可提供深层组织高分辨率和高对比度的组织断层图像.从原理上避开了光散射的影响,突破了高分辨率光学成像深度“软极限” (约1 mm),可实现50 mm的深层活体内组织成像.PAI将光学成像和超声成像的优点结合起来,一方面,在PAI中用来重建图像的信号是超声信号,生理组织对超声信号的散射要比对光信号的散射低2~3个数量级,因此可提供较深的成像深度和较高的空间分辨率;另一方面,相比纯超声成像,光声图像中不同组织间的光学对比度较高.PAI可以无标记地对单个细胞成像,对血管形态的高分辨成像,对不同组织的成分进行解析和对血液参数高特异性的功能检测,实现了从细胞到组织结构的多尺度示踪及功能成像,可用于研究动物体脑功能、肿瘤细胞转移和肿瘤形态结构、生理、病理特征、血流异常、药物代谢功能、深层荧光蛋白表达、基因活性等方面的内容.Lee等[13]成功制备了两种纳米萘Pc并进行淋巴结PAI.通过左前爪注射给药后进行活体PAI,如图7所示,A,H分别注射两种等量的纳米萘Pc(A组最大吸收峰在707 nm,H组最大吸收峰在860 nm).将鸡乳腺组织分层在大鼠的顶部,成像深度从2 mm分别增加到6 mm(图7F,M)和10 mm(图7G,N).对于两种纳米萘Pc来说,前哨淋巴结在两个深度处都清楚地观察到.表明这两种纳米萘Pc显示出良好的PAI能力.近年来,作为血清蛋白主要成分的人血清白蛋白(HSA)由于其固有的生物相容性,免疫原性低,循环半衰期长,低水平的单核吞噬细胞系统清除,改善药代动力学性质,以及药物传递中的多种作用被广泛用作天然药物载体,用于螯合无机氧化物或有机分子,例如硒化铋、IR825和Ce6[14-17].由已知报道可知基于HSA的纳米粒子通过静脉内注射会优先在肿瘤部位积聚[18-19].同时Pc为有前景的第二光敏剂[20-21].铁(II)酞菁(FePc)广泛用于各种催化转化,酯和肟的制备,还原、氧化和自由基反应[22-23].但是其较差的水溶性和较低单线态氧产率限制了FePc作为光敏剂在癌症诊疗中的应用.纳米粒子和光敏剂的结合,不仅使光敏药物在活体内循环时间增加,同时增加光敏剂在肿瘤位置的富集,以及提高光敏剂对光的吸收率,增强了PDT的靶向性光学深度.Jia等[24]因此合成出一种新型稳定的纳米粒子HSA-FePc (HSA-FePc NP),同时显著改善了FePc在溶液中的稳定性.他们研究了HSA-FePc NP在体内的光声(PA)成像性能.如图8所示,采集不同的时间间隔注射有HSA-FePc NP或FePc分子的4T1荷瘤小鼠的PA图像.结果表明,HSA-FePc NP是一种优异的PA成像剂,而且与FePc分子相比,可以显著提高肿瘤微结构的对比度和空间分辨率.同时静脉注射12 h后,肿瘤位点的HSA-FePc NP的PA信号达到最大值.除了肝脏和肾脏中稍高的HSA-FePc NPs积累之外,与其他器官(心脏、脾脏和肺)相比,肿瘤显示出更高的强度,表明静脉注射的HSA-FePc NP通过EPR效应定位在肿瘤部位.
图6(a) 光声信号激发与探测;(b) PAI实现过程示意图
图7两种纳米萘酞菁活体光声成像.(a),(h)通过前哨淋巴结注射两种等量的纳米萘Pc的PAI(A组为最大吸收峰
在707 nm的纳米萘Pc, H组最大吸收峰在860 nm的纳米萘Pc);(b),(i)分别为A,H组的对照组PAI;(c),
(j)为A、H组注射28 min后的PAI;(d),(k)分别为C、J组PAI的伪彩图;(e),(l)分别C、J沿着黄色虚线切割横
截面PAI;(f),(m)分别为A、H组前哨淋巴结横截面PAI,且在大鼠上方覆盖一层鸡胸部组织;(g),(n)分别为
A、H组前哨淋巴结横截面PAI,且在大鼠上方覆盖两层鸡胸部组织
图8(a) 不同浓度的HSA-FePc NPs水溶液PAI;(b) 静脉注射FePc或HSA-FePc NP后肿瘤位点的时间
依赖性活体PA成像;(c) 肿瘤部位的时间依赖性光声信号强度
2.2Pc配合物在磁共振成像(MRI)中的研究
MRI是一种无辐射的肿瘤成像技术,能够非侵袭性地提供体内多种信息,包括解剖、生理甚至分子信息[25].其具有良好的时间及空间分辨率和优秀的软组织对比及组织穿透力,能够实现多序列、多参数成像[26].由于MRI敏感性相对较低,临床上通常使用钆配合物造影剂以增强MRI效果.近年来,纳米分子探针在MRI中的应用极大地增强了其对活体内组织、细胞及分子水平生理生化变化过程(生物合成、细胞增殖、代谢、凋亡、信号通路改变、代谢物在体内分布等) 的鉴别能力,使MRI分子影像在肿瘤诊断、分期、个性化治疗、疗效监测等各方面的应用中发挥重要作用[27].大多数MRI造影剂是由镧系元素离子(通常是钆(Ⅲ)基螯合物)的环化螯合物制成的顺磁络合物[27-28].造影剂的功效取决于溶剂和配体之间水的相互作用.结合水的交换标度依赖于配体和金属离子的性质.用螯合剂1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)制备的络合物表现出较大的结合水速率.Gürek等[29]将钆(Ⅲ)原子复合到DOTA单元上然后与具有光敏性的锌(Ⅱ)酞菁偶联(Gd-DOTA-Pc).Pc的常见缺点是区域异构体混合物及其严重的聚集倾向,这是由于在水溶液中两种大环化合物之间的叠加机会大大增加.偶联到Pc上的Gd-DOTA要求具有良好的MRI效果:快速的水交换,可持续的旋转动力学和有限的内部运动.一般来说,临床使用的造影剂由于其低分子量而具有较慢的水交换率.众所周知,增加MRI成像剂的分子大小可增强其成像效果.分子的吸收光谱表现出单一的窄Q带,是典型的非聚集的金属Pc络合物的明显标志.临床使用的造影剂的效率由其松弛度r1表示,主要受配位于中心Gd3+的水分子的停留时间(τM)和整个分子的旋转相关时间(τR)的影响[30-32].同时,由于局部运动导致τR值的缩短,具有较高分子量的共轭物可以显示比预期的更低的r1.当脱氧原子在Gd(III)配位时形成6元螯合环时,发现DOTA衍生物的平均τM在理想范围内.在各种Gd3+物质的量浓度(0.05,0.10,0.20,0.40,0.80和1.60 mmol/L)的水中测量缀合物的纵向松弛率(1/T1),并且在T1加权核磁成像上可以观察到明显的浓度依赖性(图9).但缀合物的r1值稍低于商用的MRI造影剂,证实缀合物保留了Gd-DOTA部分的对比成像特性.较弱的值可归因于间隔臂上的酰胺官能团,可能阻断水结合位点.
图9Gd-DOTA-Pc中不同Gd3+浓度的水溶液的MRI
3Pc配合物在肿瘤治疗中的研究
癌症已经成为威胁人们生命健康的主要疾病之一,如何治疗癌症是全世界一直关注的重要课题.现有的临床治疗手段,包括放射治疗、化疗(化学药物治疗)、激素治疗、免疫治疗等,经常会引起一些副作用,发展新的治疗方法成为当务之急.与常规的肿瘤治疗手段相比,光学治疗表现出了很强的优势.光学治疗包括PDT和光热治疗(PTT),由于其方便性和微创性,成为一种有效治疗癌症的新兴技术.PDT正在发展为一种治疗癌症和一些非癌症疾病的重要方法.光敏剂是PDT的关键因素之一.Pc配合物因具有结构较易修饰、暗毒性低、光物理光化学特性较理想等特点,被认为是一类很有潜力的光敏剂[33].
3.1Pc配合物在PDT治疗中的研究
PDT是近几十年来发展起来的一种新兴癌症治疗技术.PDT需要包含三要素:光敏剂、光和活性氧(ROS)[28].三要素相互作用,缺一不可.三要素中的任一要素单独使用均不具有毒性,但其结合在一起共同作用,就可以产生具有高细胞毒性的活性氧,从而达到治疗的目的.根据产生的活性氧的类型不同,PDT的作用机理可以分为两类型,Ⅰ型以产生氧自由基为主,Ⅱ型以产生单线态氧为主.目前,人们普遍认为Ⅱ型机理为PDT的主要作用机制.光的波长也是影响PDT的重要因素.随着波长的增加,光线对组织的穿透能力逐渐增强.其中,650~1 100 nm波长范围通常被称为人体组织光学窗口,这一波段的光线可以穿透组织[34].LED因其光谱宽度窄、光效高、寿命长等特点已成为PDT中理想的替代光源[35].理想的光敏剂应具有以下特点:1) 成分单一,稳定性高.成分单一有助于对光敏剂进行质量控制,减少杂质可能引发的副作用;2) 暗毒性小,光毒性强.避光下,理想的光敏剂本身及其代谢产物不具有毒性.光照下,光敏剂分子应具有高的活性氧产率,氧化细胞内大分子或细胞器,从而达到分子内部杀死细胞的目的;3) 选择性好.理想的光敏剂对癌细胞应具有选择性,能够在癌细胞中特异性聚集而不影响正常组织细胞;4) 长波吸收.在红光和近紅外区有较强吸收以匹配组织透过窗口;5) 具有一定水溶性.水溶性有利于光敏剂在人体内的扩散和吸收.
Pc主要用作PDT中的光敏剂.PDT的原理如图10所示,基态Pc S0在激光照射下,进入单线态激发态S1,S1不稳定,辐射衰减产生荧光(hvF)通过通道间跃迁产生三线态T1:中心离子和周围环上的磺酸基团的数目对光动力疗法的功效具有显著影响.Pc由于其具有更加扩展的共轭π体系,使其最大吸收相对于卟啉显著红移.通过在Pc分子上引入相应的取代基和中心金属离子,Pc的最大吸收可以红移至700~800 nm,该波段人体的透过率高,从而具有优于卟啉的光化学性质.当今Pc类光敏剂已经成为癌症治疗中最具有应用前景的第二代光敏药物之一,而水溶性的Pc衍生物更是其中的研究热点[36].一般都是通过引入离子(-SO3-,-COO-,-N(CH3)3+,-NH3+)和非离子基团(低聚乙二醇,-OH)制备水溶性金属酞菁化合物(MPcs)[37].Ikeuchi等[38]合成一类新型稳定的水溶性锌(II)酞菁光敏剂.由具有3-二甲基氨基丙氧基取代基的邻苯二甲腈制备在α位具有4个带正电荷的取代基的锌酞菁(ZnPc)配合物3-二甲基氨基丙氧基锌酞菁(α-ZnTAPc).由于二甲基氨基的部分质子化(α-ZnTAPc)可溶于pH为中性的水溶液中,在704 nm处观察到Q带.与α位四磺酸基取代酞菁(α-ZnTSPc)相比,α-ZnTAPc的Q带位置显着地红移,分析原因是烷氧基鏈的供电子性质导致最高占据分子轨道(HOMO)轨道的不稳定性.α-ZnTAPc较α-ZnTSPc很不稳定,α-ZnTAPc在水中(荧光量子产率,Φf=0.02)和二甲基亚砜(DMSO,Φf=0.06)中的Φf值低于α-ZnTSPc,分析原因为分子内光致电子从外周胺到光激发的ZnPc环的转移.当将带负电荷的α-ZnTSPc和带正电荷的α-ZnTAPc的水溶液混合,在623 nm观察到新的宽吸收峰,在约720 nm处具有较弱的电荷转移带.这些光谱变化可归因于在共面排列中形成相反电荷分子的堆叠.α-ZnTSPc的荧光发射在两种溶液混合后完全淬灭,因为形成聚集体和电子转移.通过加入NaCl和温度变化不改变混合物的吸收光谱,显示其是高度稳定的.尽管PDT近年来已经得到广泛的研究,临床前诊治也已经显示出较有希望的结果,但是它在临床上仍然不太常用于癌症治疗.首先,大多数针对PDT进行的光敏剂缺乏肿瘤组织选择性,并且也被正常组织高度摄取,这引起很多副作用,例如皮肤光敏性和光敏反应[39].其次,PDT对巨大的实体瘤和转移性肿瘤的效果较差.Zhang等[40]合成出一种新型水溶性ZnPc衍生物,通过三甘醇链连接他莫昔芬(Tamoxifen,作为特异性雌激素受体调节剂(SERM)是第一个针对乳腺癌的靶向药物)改善了ZnPc-Tamoxifen的两亲性和生物相容性,同时保持了Tamoxifen的最大靶向能力.进行细胞实验可以发现ZnPc-Tamoxifen几乎不具有暗毒性,同时MCF-7(高表达雌激素受体(ER+))癌细胞对ZnPc-Tamoxifen的摄取较MDA-MB-231(低表达雌激素受体(ER-))细胞具有一定的特异选择性(图11(a)).进行活体PDT可以发现ZnPc-Tamoxifen静脉注射到荷瘤小鼠体内,在48 h内表现为肿瘤大小比先增加然后逐渐降低.然而只注射ZnPc的小鼠肿瘤/正常物质的量比随时间而没有明显变化(图11(b)).所有结果表明ZnPc-Tamoxifen对过表达的雌激素受体(ERs)和肿瘤组织的MCF-7乳腺癌细胞的高特异性具有亲和力.
图10PDT原理示意图
3.2Pc配合物在PTT中的研究
PTT利用在近红外具有较强光吸收的材料将光能转化为热能,从而杀死癌细胞,与传统的化疗、放疗相比具有副作用小、特异性好的优点.PTT的基本原理是在激光照射条件下,利用光热转换产生的高热量来破坏、消除癌细胞.其中,在癌细胞位点上较强的近红外光学吸收以及高的光热转换效率是PTT
图11(a) 不同细胞对ZnPc-Tamoxifen的摄取情况;(b) 注射ZnPc-Tamoxifen和ZnPc的小鼠肿瘤体积随时间的变化
能否成功实施的关键.吲哚菁绿是美国食品和药物管理局批准的可以用于临床近红外成像的有机小分子,同时它也是一种理想的光热试剂.但是,它在一定浓度下会发生团聚从而使其水溶性较差,另外它会非特异性吸附在蛋白上,这些缺点限制了它在PTT中的应用[41].
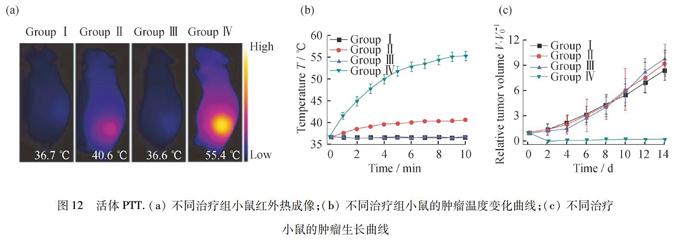
Ricciardi 等[42]合成出两种新型的基于金属Pc的光敏剂,NiPc(OBu)8和NiNc(OBu)8.已发现NiNc(OBu)8满足PTT的条件.即光能穿透组织的近红外区域并显示出有效的光子吸收(ε845 nm=2×105 mol·L-1·cm-1),并且快速失活以产生高度局部化的热效应,可导致细胞死亡.同时可以证明该化合物被无色素黑素瘤细胞有效摄取,通过产生光热而有效地破坏这种细胞,而不需要分子氧[43],因此它们适用于PTT.在实验中他们也验证了NiPc(OBu)8和 NiNc(OBu)8的失活机制,其中超快实验和时间依赖密度泛函理论(TDDFT)计算结果一致,表明Pc环的苯并环化通过诱导位于激发态S1(π,π*)和基态之间的相对能量的显著变化来修饰S1(π,π*)的光去活化机制[44].该部分的工作只是在理论上进行了讨论,并没有进行活体验证.Jia等[45]合成的HSA-FePc NP实现了在活体层次的PAI和PTT.已知FePc作为光敏剂受限于低的水溶性和低的单线态氧产率,导致不能够应用于临床.但是FePc表现出强烈的近红外吸收和无荧光的性质.通过HSA改性,克服了FePc的水分散性差和非靶向性的缺点,使HSA-FePc NP可以应用于PTT.其光热转换效率高达44.4%且该纳米粒子毒性较低.静脉给药后的荷瘤小鼠在用671 nm(0.5 W·cm-2)激光照射10 min后,肿瘤的温度迅速升至55.4 ℃(图12),从而杀死癌细胞.治疗组小鼠可以存活50 d以上.
圖12活体PTT.(a) 不同治疗组小鼠红外热成像;(b) 不同治疗组小鼠的肿瘤温度变化曲线;(c) 不同治疗
小鼠的肿瘤生长曲线
3.3Pc配合物光动力学/光热协同治疗中的研究
将PTT和PDT整合到单一系统中,在癌症治疗中具有巨大的潜力.因为它们相对于个体治疗反应可以提高治疗效率,降低副作用[46].因单纯的金属Pc一般不具有PTT效果,对于Pc类化合物同时具有PDT和PTT效果一般需要对Pc环进行修饰,接上具有PTT效果的基团或试剂.目前因牛血清白蛋白(BSA)能够同时解决Pc化合物水溶性差的问题,还具有更好的生物相容性,受到大多数学者的青睐.单壁碳纳米角(SWNHs)的平均锥角为120°,直径为2~5 nm,长度为40~50 nm的喇叭形纳米结构,形成直径为50~100 nm的圆形聚集体.直径处于最佳尺寸范围,能够增强其在肿瘤部位的高通透性和滞留效应(EPR),且不含有金属杂质,在体外和体内都具有可忽略的毒性[47-48].Zhang等[49]在已知理论基础上以ZnPc为PDT剂,中空的单壁碳纳米角(SWNHox)为热敏剂(PHT),BSA增强生物相容性实现了体外和体内双重光疗效果.Zhang[50]前期工作证实了SWNHox与BSA共轭能够增强对H460细胞(人大细胞肺癌细胞)的摄取.将5RP7细胞皮下移植到裸鼠的左侧和右侧.两侧肿瘤瘤内注射给药,治疗时使用670 nm激光照射左侧腹部的肿瘤照射10 min持续10 d(图13(a),(b)),形成自身对照.可以发现注射ZnPc-SWNHox-BSA后的激光照射显着抑制肿瘤生长(图13(c),红).在该部分的工作中对于双光疗的机理也进行了研究.通常认为光学激发光敏剂将能量转移到氧分子以产生破坏肿瘤细胞的单线态氧[51-52].但是在该部分工作中他们发现,ZnPc-SWNHox-BSA在670 nm激光照射不产生单线态氧.通过使用蒽-9,10-二丙酸二钠盐(ADPA)化学方法检查单线态氧的产生.在单线态氧的存在下,ADPA荧光被猝灭,并且其吸收峰,例如在358,378和400 nm时被减弱.但用ADPA 检测ZnPc-SWNHox-BSA时发现并没有荧光的变化.进行相关实验他们发现当ZnPc被光激发时,电子转移到SWNHox中,并在ZnPc-SWNHox-BSA体系中形成电荷分离状态.结果与从光激发的ZnPc分子到富勒烯[53-54],碳纳米管[55-56]和SWNH[57]的电子转移的研究一致.当存在氧气时,可以从ZnPc-SWNHox-BSA的电荷分离状态接受电子,产生氧负离子以及随后的其他反应性物质如羟基.这些活性物质的存在导致附近癌细胞的死亡,从而达到PDT和PTT的效果.
图13活体光动力和光热协同治疗.(a) 肿瘤细胞移植7 d后,在小鼠左右侧各有肿瘤且左侧的肿瘤正在用
670 nm激光照射;(b) 用ZnPcSWNHox-BSA治疗10 d(第17 d)并在其左侧激光照射肿瘤的小鼠;
(c) 不同治疗条件后左侧肿瘤的相对体积
4展望
综上所述,Pc化合物的合成方法很多.但总体上存在一个共同的难题:目标产物的产率普遍比较低且纯化困难.Pc化合物在生物领域应用的前提是需要改善Pc的水溶性,以及改善水溶性Pc在水溶液中聚集的问题.目前研究方向主要围绕高水溶性,高单纯态氧产率且以及能在水溶液中以低聚集态存在的Pc合成.Pc类化合物作为光敏剂并用于肿瘤治疗仍有很大的发展空间.
参考文献:
[1]Cook M J,Dunn A J,Howe S D,et al.Octaalkoxy phthalocyanine and naphthalocyanine derivatives:Dyes with Q-band absorption in the far red or near infrared [J].Journal of the Chemical Society Perkin Transactions,1988,1(8):2453-2458.
[2]Baumann M E,Capraro H G,Hilfinker R,et al.Synthesis of axially disubstituted octakis-alkoxy-germanium(IV) phthalocyanines [J].Proceedings of SPIE-The International Society for Optical Engineering,1994,2078:460-466.
[3]Lobo A C S,Silva A D,Tomé V A,et al.Phthalocyanine labels for near-infrared fluorescence imaging of solid tumors [J].Journal of Medicinal Chemistry,2016,59(10):4688-4696.
[4]Sastre ,Rey B D,Torres T.Synthesis of novel unsymmetrically substituted push-pull phthalocyanines [J].Journal of Organic Chemistry,1996,28(13):8591-8597.
[5]Gaigalas A K,Wang L,Cole K D,et al.Photodegradation of fluorescein in solutions containing n-propyl gallate [J].Journal of Physical Chemistry A,2004,108(20):4378-4384.
[6]Liu J Y,Lo P C,Jiang X J,et al.Synthesis and photodynamic activities of di-α-substituted zinc phthalocyanine derivatives [J].Dalton Transactions,2009,21(21):4129-4135.
[7]Kudo T,Kimura M,Hanabusa K,et al.Fabrication of gas sensors based on soluble phthalocyanines [J].Journal of Porphyrins & Phthalocyanines,2015,3(1):65-69.
[8]Kudrevich S,Brasseur N,Madeleine C L,et al.Syntheses and photodynamic activities of novel trisulfonated Zinc phthalocyanine derivatives [J].Journal of Medicinal Chemistry,1997,40(24):3897-3904.
[9]Shaabani A,Maleki-Moghaddam R,Maleki A,et al.Microwave assisted synthesis of metal-free phthalocyanine and metallophthalocyanines [J].Dyes & Pigments,2007,74(2):279-282.
[10]Li X S,Ke M R,Zhang M F,et al.A non-aggregated and tumour-associated macrophage-targeted photosensitiser for photodynamic therapy:A novel zinc(ii) phthalocyanine containing octa-sulphonates [J].Chemical Communications,2015,51(22):4704-4707.
[11]Cheng Z H,Cai T T,Chen J H,et al.Synthesis and application of phthalocyanine metal compounds [J].Petrochemical,2012,41(9):1092-1100.
[12]Wang Y,Xing D,Zeng Y,et al.Photoacoustic imaging with deconvolution algorithm [J].Physics in Medicine & Biology,2004,49(14):3117-3124.
[13]Lee C,Kim J,Zhang Y,et al.Dual-color photoacoustic lymph node imaging using nanoformulated naphthalocyanines [J].Biomaterials,2015,73:142-148.
[14]Chen Q,Liang C,Wang X,et al.An albumin-based theranostic nano-agent for dual-modal imaging guided photothermal therapy to inhibit lymphatic metastasis of cancer post surgery [J].Biomaterials,2014,35(34):9355-9362.
[15]Li Z,Hu Y,Howard K A,et al.Multifunctional bismuth selenide nanocomposites for anti-tumor thermo-chemotherapy and imaging [J].ACS Nano,2015,10:984-997.
[16]Chen Q,Wang X,Wang C,et al.Drug-induced self-assembly of modified albumins as nano-theranostics for tumor-targeted combination therapy [J].ACS Nano,2015,9(5):5223-5233.
[17]Zhang Y,Zou T,Guan M,et al.Synergistic effect of human serum slbumin and fullerene on Gd-DO3A for tumor-targeting imaging [J].ACS Applied Materials & Interfaces,2016,8(18):11246-11254.
[18]Qin W,Ding D,Liu J,et al.Biocompatible nanoparticles with aggregation-induced emission characteristics as far-red/near-infrared fluorescent bioprobes for in vitro and in vivo imaging applications [J].Advanced Functional Materials,2012,22(4):771-779.
[19]Agudelo D,Bérubé G,Tajmirriahi H A.An overview on the delivery of antitumor drug doxorubicin by carrier proteins [J].International Journal of Biological Macromolecules,2016,88:354-360.
[20]Singh S,Aggarwal A,Arianna G,et al.Glycosylated porphyrins,phthalocyanines,and other porphyrinoids for diagnostics and therapeutics [J].Chemical Reviews,2015,115(18):10261-10306.
[21]Nyokong T,Antunes E.Influence of nanoparticle materials on the photophysical behavior of phthalocyanines [J].Coordination Chemistry Reviews,2013,257(15-16):2401-2418.
[22]Colomban C.Iron Phthalocyanine [J].Synlett,2014,25(17):2521-2522.
[23]Sorokin A B.Phthalocyanine metal complexes in catalysis [J].Chemical Reviews,2013,113(10):8152-8191.
[24]Jia Q,Ge J,Liu W,et al.Biocompatible Iron phthalocyanine-albumin assemblies as photoacoustic and thermal theranostics in living mice.[J].ACS Applied Materials & Interfaces,2017,9:21124-21132.
[25]Jaehong Key J F L.Nanoparticles for multimodal in vivo imaging in nanomedicine [J].International Journal of Nanomedicine,2014,9(1):711-726.
[26]Gore J C,Manning H C,Quarles C C,et al.Magnetic resonance in the era of molecular imaging of cancer [J].Magnetic Resonance Imaging,2011,29(5):587-600.
[27]Aime S,Crich S G,Gianolio E,et al.High sensitivity lanthanide(III) based probes for MR-medical imaging [J].Coordination Chemistry Reviews,2006,250(11):1562-1579.
[28]Woods M,Woessner D E,Sherry A D.Paramagnetic anthanoid complexes as PARACEST agents for medical imaging [J].Cheminform,2006,37(35):500-511.
[29]Tekdark,B,et al.Design of a Gd-DOTA-phthalocyanine conjugate combining MRI contrast imaging and photosensitization properties as a potential molecular theranostic [J].Photochemistry & Photobiology,2015,90(6):1376-1386.
[30]Aime S,Botta M,Terreno E.Gd(III)-Based contest agents for MRI [J].Advances in Inorganic Chemistry,2005,57(57):173-237.
[31]Hermann P,Kotek J,Kubícek V,et al.Gadolinium(III) complexes as MRI contrast agents:Ligand design and properties of the complexes [J].Dalton Transactions,2008,23(23):3027.
[32]Kotková Z,Helm L,Kotek J,et al.Gadolinium complexes of monophosphinic acid DOTA derivatives conjugated to cyclodextrin scaffolds:efficient MRI contrast agents for higher magnetic fields [J].Dalton Transactions,2012,41(43):13509-13519.
[33]Huang J D.Research progress in phthalocyanine complexes for photodynamic therapy [J].Chinese Journal of Laser Medicine,2005,14(4):264-265.
[34]Juzeniene A,Nielsen K P,Moan J.Biophysical aspects of photodynamic therapy [J].Journal of Environmental Pathology Toxicology and Oncology,2006,25(1-2):547-557.
[35]Juzeniene A,Juzenas P,Ma L W,et al.Effectiveness of different light sources for 5-aminolevulinic acid photodynamic therapy [J].Lasers in Medical Science,2004,19(3):139-149.
[36]Uslan C,Sesalan B M.Synthesis of new water soluble phthalocyanines and investigation of their photochemical,photophysical and biological properties [J].Journal of Photochemistry & Photobiology A Chemistry,2012,235(5):56-64.
[37]Tasso T T,Furuyama T,Kobayashi N.Absorption and electrochemical properties of cobalt and iron phthalocyanines and their quaternized derivatives:aggregation equilibrium and oxygen reduction electrocatalysis [J].Inorganic Chemistry,2013,52(16):9206-9215.
[38]Ikeuchi T,Mack J,Nyokong T A,et al.Aggregation control of robust water-soluble zinc(II) phthalocyanine-based photosensitizers [J].Langmuir the Acs Journal of Surfaces & Colloids,2016,32(45):11980-11985.
[39]Sharman W M,Allen C M,Van-Lier J E.Photodynamic therapeutics:Basic principles and clinical applications [J].Drug Discovery Today,1999,4(11):507-517.
[40]Zhang F L,Song M R,Yuan G K,et al.A Molecular combination of zinc(II) phthalocyanine and tamoxifen derivative for dual targeting photodynamic therapy and hormone therapy [J].Journal of Medicinal Chemistry,2017,60(15):6693-6703.
[41]Mordon S,Devoisselle J M,Soulie-Begu S,et al.Indocyanine green:physicochemical factors affecting its fluorescence in vivo [J].Microvascular Research,1998,55(2):146-152.
[42]Ricciardi G,Soldatova A V,Rosa A.On the photophysics of metallophthalocyanine-based photothermal sensitizers:Synergism between theory and experiment [J].Journal of Inorganic Biochemistry,2008,102(3):406-413.
[43]Camerin M,Rodgers M A,Kenney M E,et al.Photothermal sensitisation:Evidence for the lack of oxygen effect on the photosensitising activity [J].Photochemical & Photobiological Sciences Official Journal of the European Photochemistry Association & the European Society for Photobiology,2005,4(3):251-253.
[44]Soldatova A V,Kim J,Peng X,et al.Effects of benzoannulation and alpha-octabutoxy substitution on the photophysical behavior of nickel phthalocyanines:A combined experimental and DFT/TDDFT study [J].Inorganic Chemistry,2007,46(6):2080-2093.
[45]Jia Q,Ge J,Liu W,et al.Biocompatible iron phthalocyanine-albumin assemblies as photoacoustic and thermal theranostics in living mice [J].ACS Applied Materials & Interfaces,2017,9:21124-21132.
[46]Shibu E S,Hamada M,Murase N,et al.Nanomaterials formulations for photothermal and photodynamic therapy of cancer [J].Journal of Photochemistry & Photobiology C Photochemistry Reviews,2013,15(1):53-72.
[47]Chen D,Wang C,Jiang F,et al.In vitro and in vivo photothermally enhanced chemotherapy by single walled carbon nanohorns as a drug delivery system [J].Journal of Materials Chemistry B,2014,2:4726-4732.
[48]Miyawaki J,Yudasaka M,Azami T,et al.Toxicity of single-walled carbon nanohorns [J].ACS Nano,2008,2(2):213-226.
[49]Zhang M,Murakami T,Ajima K,et al.Fabrication of ZnPc/protein nanohorns for double photodynamic and hyperthermic cancer phototherapy [J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(39):14773-14778.
[50]Zhang M,Yudasaka M,Ajima K,et al.Light-assisted oxidation of single-wall carbon nanohorns for abundant creation of oxygenated groups that enable chemical modifications with proteins to enhance biocompatibility [J].ACS Nano,2007,1(4):265-272.
[51]D′Hallewin M A,Baert L.Photodynamictherapy of bladder cancer [C]//Carcinoma of the Bladder.Berlin:Springer,1998:103-112.
[52]Moan J.Porphyrin photosensitization and phototherapy [J].Photochemistry & Photobiology,1986,43(6):681-683.
[53]El-Khouly M E,Araki Y,Fujitsuka M,et al.Photoinduced electron transfer between chlorophylls (a/b) and fullerenes (C60/C70) studied by laser flash photolysis [J].Photochemistry & Photobiology,2001,74(1):22-30.
[54]Souza F D,Ito O.Photoinduced electron transfer in supramolecular systems of fullerenes functionalized with ligands capable of binding to zinc porphyrins and zinc phthalocyanines [J].Coordination Chemistry Reviews,2005,249(13-14):1410-1422.
[55]Guldi D M,Taieb H,Rahman G M A,et al.Cover picture:Novel photoactive single-walled carbon nanotube-porphyrin polymer wraps:efficient and long-lived intracomplex charge separation [J].Advanced Materials,2005,17(7):871-875.
[56]Baskaran D,Mays J W,Zhang X P,et al.Carbon nanotubes with covalently linked porphyrin antennae:Photoinduced electron transfer [J].Journal of the American Chemical Society,2005,127(19):6916-6917.
[57]Sandanayaka A S D,Pagona G,Fan J,et al.Photoinduced electron-transfer processes of carbon nanohorns with covalently linked pyrene chromophores:charge-separation and electron-migration systems [J].Journal of Materials Chemistry,2007,17(24):2540-2546.

