MnO2催化剂的制备及其催化氧化挥发性有机污染物的研究进展
苏佳飞 杨国红 徐合 柯勤飞


摘要:
挥发性有机污染物(VOCs)由于其危害大、来源广,因此受到人们的普遍关注.热催化氧化技术在催化降解挥发性有机污染物方面具有独特的优势,而催化剂二氧化锰(MnO2)由于其在室温下相对于其他催化剂具有较高的处理效果以及易制备等优点而被广泛研究和使用.本文作者着重讲述了催化剂MnO2的特点、制备工艺、降解挥发性有机污染物效率的影响因素及其负载方式等在国内外的研究现状.
关键词:
挥发性有机污染物; 热催化氧化; 二氧化锰
中图分类号: O 614.7+11文献标志码: A文章编号: 1000-5137(2018)01-0123-09
A review on manganese dioxide catalyst for catalytic oxidation of
volatile organic compounds
Su Jiafei, Yang Guohong, Xu He*, Ke Qinfei
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
Abstract:
Volatile organic compounds(VOCs) are a major component in air pollutants and pose great risks to both human health and environmental protection.Thermal catalytic oxidation has been proved to be a convenient innovative technology for its ability to degrade VOCs completely.As a catalyst,MnO2 has shown a lot of advantages such as higher removal efficiency of VOCs at room temperature over other catalysts and has been widely used in the process of thermal catalytic oxidation.This review was focused on the research in the characteristics,preparation technology,impact factors that affect the removal efficiency of VOCs and the loading materials of MnO2.
Key words:
VOCs; thermal catalytic oxidation; MnO2
收稿日期: 2016-09-26
基金項目: 上海市青年科技英才扬帆计划(15YF1408900);国家自然科学基金(81501597);中国博士后面上项目(2015M580341)
作者简介: 苏佳飞(1991-),男,硕士研究生,主要从事环境功能材料方面的研究.E-mail:375559075@qq.com
导师简介: 徐合(1987-),女,博士,讲师,主要从事环境功能材料,生物医用材料方面的研究.E-mail:xuhe@shnu.edu.cn
*通信作者
引用格式: 苏佳飞,杨国红,徐合,等.MnO2催化剂的制备及其催化氧化挥发性有机污染物的研究进展 [J].上海师范大学学报(自然科学版),2018,47(1):123-131.
Citation format: Su J F,Yang G H,Xu H,et al.A review on manganese dioxide catalyst for catalytic oxidation of volatile organic compounds [J].Journal of Shanghai Normal University(Natural Sciences),2018,47(1):123-131.
0引言
挥发性有机污染物(VOCs) 是指常温下饱和蒸汽压大于70 Pa、常压下沸点在260 ℃以下的有机化合物,或在20 ℃条件下蒸汽压大于或者等于10 Pa具有相应挥发性的全部有机化合物.VOCs成分较为复杂,涉及烷烃、不饱和烃、苯系物、醇类、醛酮类、酯类、卤代烃等物种[1],由于来源广、成分复杂,VOCs被视为继粉尘之后的第二类量大面广的大气污染物[2],对人类的健康具有严重的威胁[3],从而引起了人们的普遍关注.
目前,室内VOCs的主要处理技术有吸附处理、热催化氧化、液体吸收处理、生物处理、光催化氧化处理、低温等离子处理、膜吸收等[4].其中热催化氧化技术是在较低温度下,利用催化剂将 VOCs 彻底氧化分解成CO2和H2O.它具有无火焰燃烧、安全性好、对VOCs 质量浓度限制较小、起燃温度较低等优点.催化氧化技术中金属氧化物催化剂由于具有相对较高的催化活性且价格相对便宜从而被广泛用于催化氧化过程[5].Yoshika等[6]比较了多种金属氧化物室温下催化降解甲醛的实验,发现MnO2在室温下相对于其他催化剂(TiO2、ZnO、Mn3O4)具有更高的催化效率,并且产物仅有CO2和H2O,没有其他副产物CO、甲酸的生成.MnO2作为金属氧化物的一种,具有以下的特点:1)MnO2具有特殊的孔结构、高的比表面积、高的孔隙率以及平均氧化价态,因此其具有较高的低温催化氧化活性;2)晶体结构中常含有缺陷、空位,表现出低温还原性;3)在氧化锰孔道结构中常存在着各种阳离子和水分子,以平衡电荷、稳定矿物结构,孔道中存在的阳离子如K+、Ce3+等对其在低温下具有良好的催化氧化效果产生了很大的作用;4)MnO2价格便宜、无毒.由于MnO2这一系列的特点,其在被用于处理甲醛方面受到普遍的关注.
目前,针对MnO2的研究主要集中在不同晶型、不同形貌结构、制备工艺以及掺杂改性和负载方式对其催化降解性能的影响等方面.
1MnO2的结构与特点
MnO2可分为三大类,即一维隧道结构、二维层状结构和三维网状结构,存在5种主晶和30余种次晶.[MnO6]是MnO2的最常见的基本结构单元,是由1个锰原子与6个氧原子配位所構成的八面体,这些八面体以共用边或共用角等方式在空间中生长,最终形成了各种不同晶型的MnO2[7],主要有α-,β-,γ-,δ-和λ-晶型的MnO2等.下面对一些主要的MnO2晶型进行简单介绍.
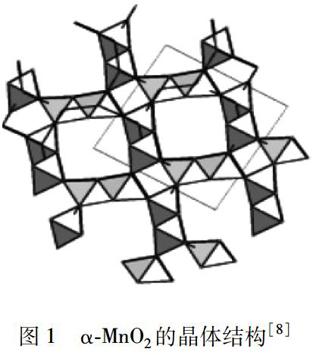
图1α-MnO2 的晶体结构[8]
α-MnO2的显著特征是其晶体结构含有大量的[2×2]隧道或空穴.如图1所示[8],[MnO6]八面体的共用棱沿c轴方向形成双链,这些双链的八面体与邻近的双链共用顶角,以形成[2×2]隧道,这种大隧道能够接纳半径达0.15 nm的诸如Ba2+、K+、Pb2 +、Na +、NH4+等阳离子及H2O分子,因而分别形成了碱硬锰矿、隐钾锰矿、铅硬锰矿等一系列不同矿种[9].
β-MnO2是一维[1×1]隧道结构.[MnO6]八面体以共用棱形成八面体单链,沿c轴伸展.所有八面体都是等同的,平均每个Mn-O原子间距0.186 nm.晶胞c轴尺寸(0.287 nm)代表通过共用棱八面体核(Mn-Mn)间距离[10].β-MnO2的晶体结构如图2所示[8].
δ-MnO2的晶体结构如图3所示[8],可以看到δ-MnO2是层状结构,由[MnO6]八面体以共棱的方式在二维方向无限连接形成片层,而锰原子则占据八面体的空隙.在垂直层方面,空层与填充层交替.层片之间的距离一般约为0.7 nm,层与层之间一般有金属离子填充[11].
图2软锰矿β-MnO2的晶体结构[8]
图3δ-MnO2的晶体结构[8]
2MnO2处理VOCs的原理
MnO2在与其他金属氧化物低温降解VOCs的比较过程中展现出较高的降解效果,从而受到普遍的关注和研究.当MnO2与VOCs接触时,MnO2表面的活性氧(O2-、O-、O2-)先将VOCs氧化成中间产物,再进一步将中间产物继续氧化成CO2和H2O.而表面的活性氧被消耗后将从空气中得到补充.其中O-是活性较高的氧离子,O2-、O2-是活性较低的氧离子,温度的升高有利于将活性较低的氧离子(O2-、O2-)转化为活性较高的氧离子(O-),这也是随着温度的升高,MnO2催化效果提高的原因.
不同结构的MnO2含有不同价态的Mn离子(如 Mn4+,Mn3+),由于这些离子的数量不同,从而使MnO2表面的活性氧物种含量和种类不同,特别是当Mn3+的数量相对增加时,有助于形成更多的表面活性氧(O2-、O-、O-2),有助于催化活性的提高.
Sekine[7]在比较不同金属氧化物催化甲醛的实验中提出了MnO2降解甲醛的机理.首先,气态甲醛分子被氧化物表面氧吸附,并生成中间产物HCHOO,同时这一步为可逆过程,所吸附的甲醛分子也很容易脱附;在氧化物表面形成的中间产物HCHOO生成HCOO,进而转化成CO2.
HCHO(g)+ O(a)→HCHOO(a),
HCHOO(a)→H(a)+ HCOO(g),
HCOO(a)→H(a)+ CO2(g),
2H(a)+ O(a)→H2O.
其中g表示是气态物质,a表示是吸附态物质.
3MnO2的制备工艺
MnO2的主要制备方法有氧化还原法、共沉淀法、溶胶凝胶法、高温煅烧法、水热法、微波加热法等.
Lin等[12]利用氧化还原法将MnSO4.H2O、K2S2O8和 K2SO4溶于去离子水中,同时加入硫酸和硝酸银,40 ℃的条件下生成了介孔α-MnO2.同时比较了不同温度下生成产物的不同以及不同温度下产物降解甲苯的效率.该方法能够在较低的温度下生成大批量产物,但是通常生成的产物会含有一定的杂质且结晶度较差.
利用共沉淀法可以得到不同晶型的MnO2,并且得到的产物相对较多,但是产物的结晶度较差.刘世斌等[13]利用不同比例的高锰酸钾与硫酸锰通过共沉淀的方法,通过控制不同的温度、不同的原料比、不同的反应时间制备出不同晶型和不同形貌的MnO2.
利用溶胶-凝胶法可以得到分散性较好的目标产物.孙洁等[14]利用高锰酸钾、富马酸、三乙胺等通过溶胶凝胶的方法制备出了具有高效催化活性的MnO2,并研究了不同量的三乙胺对产物的影响.
利用水热法可以得到不同晶型、不同形貌的、结晶度较高的MnO2,但是水热法生成的产物的量较少.Cheng等[15]利用高锰酸钾与乙酸为原料,通过水热反应在140 ℃的条件下制备出了长为6~10 μm,直径为20 nm的线状的MnO2,并分析了不同的水热温度、不同的反应时间和不同质量浓度的乙酸对产物的影响.最终通过实验证明了所制备的α-MnO2对甲苯的降解效率远远高于市售的MnO2.
利用煅烧的方法,相对来说反应物的可选择性较为单一,通常是一些在高温下较易分解的物质.Bai等[16]利用硬模板KIT-16,将硝酸锰分散在乙醇中,通过离心的方法得到沉淀并且在200 ℃的条件下进行高温煅烧,最后利用2 mol/L的NaOH去除模板KIT-16,得到具有介孔结构的 β-MnO2.通过与制备的棒状 α-MnO2,β-MnO2比较降解甲醛的效率,发现制备出的介孔结构的 β-MnO2具有更好的催化降解甲醛的作用.
利用微波加热法,与普通水热相比没有加热梯度,反应器内部和外部的温度比较均一,可以较快并且较为均匀的对反应物加热.Huang等[17]以 K2SO4、K2S2O8和MnSO4·H2O为原料利用微波加热的方法合成了纳米纤维状和薄膜状MnO2材料.并比较了不同温度、不同反应时间对甲苯催化效率的影响.
制备MnO2的方法较多,不同的制备方法有其独特的优缺点,目前水热和共沉淀的方法被大家广泛使用,通过控制不同的温度、不同的反应物质的量、不同的反应时间可以得到不同晶型不同形貌的MnO2.
4影响MnO2催化降解VOCs效率的因素
由于MnO2复杂的晶型、形貌结构,导致MnO2催化降解VOCs表现出不同的催化效果.MnO2晶型、形貌的不同使其表現出不同的空间结构、不同的比表面积、不同的活性氧种类以及含量,从而表现出不同的VOCs催化效率.另外,通过掺杂贵金属、金属氧化物,更是提高了MnO2的低温催化活性,贵金属本身对VOCs就具有较高的催化效率,但是其价格昂贵限制了其广泛的使用,由于贵金属表面本身存在大量的活性氧物种,当在MnO2中掺杂贵金属后,由于两者之间的相互作用从而提高了其催化效率.催化过程中不同的VOCs质量浓度、不同的水蒸气含量、不同的空速都会对MnO2的催化降解效果产生一定的影响[18-20].
4.1不同晶型的MnO2的影响
Liang等[21]探究了不同晶型的MnO2催化降解CO效率的研究,得出催化效率从大到小的顺序为α-≈δ->γ->β-,并且在改变CO的质量浓度以及流速的条件下,降解CO 的催化效率仍遵循α->δ->γ->β-.其机理主要是由于MnO2的不同晶型具有不同的空间结构进而表现出对CO差异性的吸附效果,同时不同晶型的MnO2含有不同含量的晶格氧和吸附氧,从而进一步影响其催化效率.
图4不同晶型MnO2在不同温度下催化丙烷的效率[22]
Xie等[22]制备出不同晶型的MnO2,并且比较了不同晶型催化丙烷的催化效率,如图4所示.从图4中得知α晶型的MnO2催化丙烷的效率高于γ、β、δ晶型.通过一系列的比较,得到不同晶型的MnO2催化丙烷的效率不同,其原因主要是由于不同晶型的MnO2具有不同的空间结构,从而表现出对丙烷具有不同的吸附能力,其中α晶型的MnO2吸附丙烷的能力最强,从而表现出最高的催化活性.另外α晶型的MnO2表面的吸附氧、易于移动的内部结构、较强的拉伸能力等也可能对其催化效果产生影响.
总之,不同晶型的MnO2由于其组成结构单元的空间排列不同,低温还原性和活性氧的数量等也不同导致它们对于污染物质有不同的催化效果.其中α-MnO2由于其特殊的结构使其对甲苯、乙烷、甲醛等VOCs均表现出较高的催化效果,并且其制备方法多样,无论是水热还是共沉淀均能制备出结晶度比较高的α-MnO2.因此,α-MnO2在降解VOCs的研究中受到普遍关注.
4.2不同形貌的MnO2的影响
通过控制不同的反应条件可以得到不同微纳米形貌的MnO2.不同形貌的MnO2由于比表面积、低温还原性、表面吸附氧浓度不同导致其降解污染物的效率产生差异.
Wang等[23]利用不同的方法制备出不同形貌的MnO2催化剂(图5),并比较了其对甲苯的催化降解效率(图6).从图6中得知相对于其他三种(如管状、花状、线状)形貌,棒状的MnO2具有最高的催化降解效率,文中进一步验证了棒状的MnO2具有高催化效率的原因可能是由于表面吸附氧浓度高,具有较高的低温还原性能.
图5不同形貌的催化剂的SEM图 (a~b棒状,c~d线状,e~f管状,g~h花状)[23]
图6不同形貌的催化剂降解甲苯的催化效率图[23]
拜冰洋[24]分别利用硬模板SBA-15、KIT-6,利用浸渍煅烧的方法制备出介孔2D-MnO2,3D-MnO2,并与无孔的棒状的1D-MnO2的进行了催化氧化乙醇和甲醛的实验对比.得出催化效果顺序为3D-MnO2>2D-MnO2>1D-MnO2.该顺序与催化剂的孔道维数、比表面积、Mn4+阳离子数、表面吸附氧物种以及低温还原性等因素的顺序是一致的,而这些因素在氧化反应中起着积极的作用.另外,通过控制不同的反应温度制备出具有不同孔径、不同维数的介孔MnO2,它们表现出不同的催化氧化乙醇的活性.
在这些研究中人们希望能够探究微纳米形貌这一单一因素的影响,而实际上由于晶型和形貌能够同时对MnO2的催化活性产生影响,而目前制备同一晶型的不同微纳米形貌的MnO2尚存在一定的难度,如果能够在确定的晶型下(如上部分所提到的具有最高催化活性的α晶型),那么研究MnO2的不同微纳米形貌对于其催化降解甲醛的影响将具有更好的指导意义,而这部分的研究目前相对较少且其影响机理尚不清楚.
4.3贵金属掺杂
贵金属催化剂具有较高的降解室内污染物的活性,但是由于其价格昂贵从而限制了其大量的使用,过渡金属氧化物虽然价格便宜且具有一定的催化活性,但是在室温以及低温的条件下催化活性很低.大量的文献已经证明了贵金属和过渡金属氧化物之间的相互作用可以提高催化剂的催化活性,其机理主要是贵金属的加入能够增加催化剂中氧的活动性和活性氧的数量[18,25],例如在贵金属Ag的掺杂过程中,存在Mn4+/Mn3+和Ag+/Ag0的循环,贵金属的加入有助于增加Mn3+的数量,增加Mn3+的数量有助于形成更多的氧空位,从而大大增加了催化活性[26].并且贵金属颗粒的大小、在催化剂表面的分散性能都对最终的催化效率产生较大的影响[27].目前用于MnO2掺杂的贵金属主要有Pt、Pd、Rh、Ru、Au等,其中Pd、Pt催化效率较高,但是其价格相对昂贵,从而限制了其使用.Au、Ag相对来说催化效率不如Pd、Pt催化效率高,但是其价格相对便宜从而受到普遍的关注和研究.
Sinha等[28]利用紫外光还原的方法制备复合材料Au/γ-MnO2催化氧化5L的VOCs混合气体,表现出较高的催化活性.
Yu等[29]制备出同时负载有Au、Pt的MnO2催化材料,并且比较了不同负载量、只负载Au、只负载Pt的催化剂催化降解HCHO的催化效率.结果证明了负载单一贵金属的催化剂催化活性明显提高,而负载了两种贵金属的催化剂的催化效率高于负载单一贵金属的催化剂催化活性,并且不同负载量的催化剂的催化效率也表现出一定的差异.
虽然通过少量的掺杂可以大大提高过渡金属氧化物的催化活性,但是如何解决贵金属催化剂在过渡金属氧化物表面均匀分散的问题仍是目前研究的热点.
4.4过渡金属氧化物掺杂
通过掺杂过渡金属氧化物可以形成一些固溶体或者通过一定的方法将一些过渡金属氧化物的阳离子掺杂到MnO2的晶格中,最终形成的复合产物比单一的氧化物,具有更好的分散性,提高了与环境污染物质接触机会[30].另外,形成复合产物特别是固溶体后,增加了高活性离子的数量及表面活性氧的种类和数量[30-33],同时两种过渡金属氧化物之间有协调互助的作用,从而进一步提高催化性能.
Hou等[34]利用Ce(NO3)3·6H2O和KMnO4分别在120 ℃和180 ℃合成了掺杂了金属Ce3+、Ce4+离子和CeO2的MnO2复合材料.在120 ℃的条件下反应将金属Ce3+、Ce4+离子掺杂到了MnO2的晶格当中,在180 ℃的条件下得到了掺杂了CeO2的MnO2材料.实验发现掺杂了金属Ce3+、Ce4+离子的复合材料更有助于吸收光能并将其转化为热能,从而表现出在光照条件下较好的降解苯的特性,并且依据此现象提出了新的催化机理.
Li等[35]利用Ce(NO3)3·6H2O、KMnO4、HNO3制备出由棒状和片状组成的空心复合材料,通过控制不同的反应时间得到不同形貌的复合材料,Ce3+的加入促成了空心结构的生成,并且形成的空心结构材料与市售的MnO2相比,催化性能大大提高.
通过不同的方法制备出掺杂有其他过渡金属氧化物的MnO2材料,由于掺杂后的材料可以不同程度地改变原有催化材料的晶格、结构等,从而降低了复合材料的低温还原性能,并且有些掺杂后的材料比表面积大大提高,这些性质都促进了复合材料对于甲醛等气体的降解效率.
5MnO2负载的研究
由于粉末催化剂难以收集易造成二次污染,并且粉末的堆积与团聚也会降低其应用价值,因此研究MnO2催化剂的负载从而制备出具有多种功能的复合材料也受到人们的普遍关注.
通过各种方法制备出的催化剂一般呈现出微米级或者纳米级的粉末状,虽然具有比较高的催化活性,但是由于其呈现粉末状,比较难以收集,容易造成二次污染.而通过与其他多种具有特殊功能的载体材料进行复合,可以有效解决其收集难的问题,同时还可以得到既有催化活性又具有其他特性的多功能材料.目前采用的负载方法主要有浸渍提拉法、高温烧结煅烧、高温水热沉淀法、静电纺丝、电沉积等.
高凯等[36]利用超声浸渍的方法,将MnO2负载到中空的聚偏氟乙烯(PVDF)纤维膜上,得到既有催化性能又有吸附性能的复合型催化材料.利用超声浸渍的方法虽然可以将MnO2相对均匀的分散到载体上,但是由于仅仅采用物理超声的方法,催化剂与载体之间的作用力较弱,不能使催化剂牢固的负载在载体上,从而催化剂易于从载体上脱落,特别是当污染气体的流量较大时,更易使催化剂与载体分离,从而大大降低了催化效果.
利用水热反应的方法可以将催化剂原位负载在载体表面,从而提高了负载量和分散性能.Wang等[37]利用水热的方法,利用硝酸锰和高锰酸钾为原料,在活性碳纤维上沉积了MnO2颗粒,制备出既具有吸附性能又具有催化性能的复合材料,通过控制高锰酸钾的物质的量浓度控制不同的负载量,并研究了复合材料对于NO的催化降解性能.
静电纺丝技术是一种利用聚合物溶液或者熔体在强电场作用下形成单根纳米和微米级别超细纤维的工艺.通过该工艺可以制备出孔隙率高、比表面积大、纤维精细程度与均一性高、长径比大的材料.近年来,通过对电纺丝实验装置的改进,可以制备出大面积、高厚度、杂乱、定向、中空、芯壳、大孔、图案化和三维结构等纤维支架.陈仁忠等[38]利用静电纺丝的方法将MnO2直接分散到聚丙烯腈(PAN)溶液中制备出包裹有MnO2材料的PAN纤维.虽然制备出的复合材料具有高催化效率、易收集等优势,但是大量的MnO2颗粒仍然被纤维所包裹,不能完全地表现出催化材料原有的催化活性从而限制了其利用.
虽然大量的负载方法已经被广泛地研究与使用,但是目前来说仍面临催化剂与载体结合性差、催化剂易与在载体表面团聚、催化剂负载不均匀等問题,这些都大大影响了负载后催化剂的催化性能,所以对于负载方法的改进仍是目前研究的热点和重点之一.
6总结与展望
由于MnO2具有较高的催化活性能够在室温的条件下将VOCs气体进行催化氧化,并且不产生其他的副产物,因此在VOCs的降解研究中得到了广泛的关注.MnO2的晶型以及形貌结构较为复杂,并均能对其催化活性产生较大的影响,目前研究不同晶型MnO2催化氧化VOCs的特性较多,而同时研究MnO2的晶型以及不同形貌对于其催化降解VOCs的影响相对较少且其影响机理尚不清楚.针对MnO2的改性目前也是研究的热点,贵金属掺杂、过渡金属氧化物掺杂等也受到普遍的关注和研究.对于MnO2难收集的问题,目前主要是将MnO2与载体相结合,期望制备出既有吸附性能、过滤性能同时又具有催化性能的复合多功能材料,但是目前所制备的复合材料仍然存在催化剂在载体表面团聚、分散不均匀、活性位点被覆盖等问题,这些问题都亟待解决.
参考文献:
[1]陈颖,李丽娜,杨常青,等.我国VOC类有毒空气污染物优先控制对策探讨 [J].环境科学,2011,32(12):3469-3475.
Chen Y,Li L N,Yang C Q,et al.The VOC kind of toxic air pollutants priority control countermeasures [J].Environmental Science,2011,32(12):3469-3475.
[2]吴祖良,周勇平,高翔,等.放电等离子体处理 VOCs 的研究 [J].电站系统工程,2003,19(4):7-10.
Wu Z L,Zhou Y P,Gao X,et al.Discharge plasma processing of VOCs research [J].Power System Engineering,2003,19(4):7-10.
[3]闫勇.有机废气中VOC 的回收方法 [J].化工环保,1997,17(6):117-128.
Yan Y.Organic exhaust gas of VOC in recycling method [J].Journal of Chemical IndustryEnvironmental Protection,1997,17(6):117-128.
[4]汪涵.挥发性有机废气治理技术的现状与进展 [J].化工进展,2009,28(10):1833-1840.
Wang H.Current situation and progress of volatile organic waste gas treatment technology [J].Journal of Chemical Industry Progress,2009,28(10):1833-1840.
[5]左满宏,吕宏安.催化燃烧与催化剂材料在VOCs治理方面研究进展 [J].天津化工,2007,21(4):8-10.
Zuo M H,Lve H A.Catalytic combustion and catalytic materials research progress in VOCs control [J].Journal of Chemical Industry in TianJin,2007,21(4):8-10.
[6]Yoshika,Seki.Oxidative decomposition of formaldehyde by metal oxides at room temperature [J].Atmospheric Environment,2002,36(35):5543-5547.
[7]Zheng Y,Wang W,Jiang D,et al.Insights into the solar light driven thermocatalytic oxidation of VOCs over tunnel structured manganese oxides [J].Physical Chemistry Chemical Physics Pccp,2016,18(27):18180.
[8]Devaraj S,Munichandraiah N.Effect of crystallographic structure of MnO2 on its electrochemical capacitance properties [J].Journal of Physical Chemistry C,2008,112(11):4406-4417.
[9]夏熙.二氧化锰及相关锰氧化物的晶体结构、制备及放电性能(2) [J].电池,2005,35(1):27-30.
Xia X.Manganese dioxide and manganese oxide crystal structure,preparation and discharge performance (2) [J].Battery,2005,35 (1):27-30.
[10]夏熙.二氧化锰及相关锰氧化物的晶体结构、制备及放电性能(1) [J].电池,2004,34(6):411-414.
Xia X.Manganese dioxide and manganese oxide crystal structure,preparation and dischargeperformance(1) [J].Battery,2004,34(6):411-414.
[11]夏熙.二氧化锰及相关锰氧化物的晶体结构、制备及放电性能(3) [J].电池,2005,35(2):105-108.
Xia X.Manganese dioxide and manganese oxide crystal structure,preparation and dischargeperformance(3) [J].Battery,2005,35(2):105-108.
[12]Lin T,Yu L,Sun M,et al.Mesoporous α-MnO2 microspheres with high specific surface area:Controlled synthesis and catalytic activities [J].Chemical Engineering Journal,2016,286:114-121.
[13]刘世斌,周娴娴,池永慶,等.纳米二氧化锰的制备及其形貌调控 [J].太原理工大学学报,2011,42(4):369-374.
Liu S B,Zhou X X,Chi Y Q,et al.The preparation of nanometer manganese dioxide and its morphology control [J].Journal of TaiYuan University of Technology,2011,42(4):369-374.
[14]孙洁,张莉,张文莉,等.溶胶-乳状液-凝胶法制备纳米MnO2及其催化性质研究 [J].应用化工,2007,36(7):656-659.
Su J,Zhang L,Zhang W L,et al.Sol- emulsion-gel prepared MnO2 nanoparticles and their catalytic properties [J].Journal of Applied Chemical Industry,2007,36 (7):656-659.
[15]Cheng G,Yua L,Lan B,et al.Controlled synthesis of α-MnO2 nanowires and their catalytic performance for toluene combustion [J].Materials Research Bulletin,2016,75:17-24.
[16]Bai B Y,Qiao Q,Li J H,et al.Synthesis of three-dimensional ordered mesoporous MnO2 and its catalytic performance in formaldehyde oxidation [J].Chinese Journal of Catalysis,2016,37(1):27-31.
[17]Huang H,Sithambaram S,Chen C H,et al.Microwave-assisted hydrothermal synthesis of cryptomelane-type octahedral molecular sieves (OMS-2) and their catalytic studies [J].Chemistry of Materials,2010,22(12):3664-3669.
[18]Huang H,Leung D Y C.Complete elimination of indoor formaldehyde over supported Pt catalysts with extremely low Pt content at ambient temperature [J].Journal of Catalysis,2011,280(1):60-67.
[19]Tang X,Chen J,Huang X,et al.Pt/MnOx -CeO2,catalysts for the complete oxidation of formaldehyde at ambient temperature [J].Applied Catalysis B Environmental,2008,81(1-2):115-121.
[20]Xia Y,Dai H,Zhang L,et al.Ultrasound-assistednanocasting fabrication and excellent catalytic performance of three-dimensionally ordered mesoporous chromia for the combustion of formaldehyde,acetone,and methanol [J].Applied Catalysis B Environmental,2010,100(1-2):229-237.
[21]Liang S,Teng F,Bulgan G,et al.Effect of Phase Structure of MnO2 Nanorod Catalyst on the Activity for CO Oxidation [J].Journal of Physical Chemistry C,2008,112(14):5307-5315.
[22]Xie Y J,Yu Y Y,Gong X Q,et al.Effect of the crystal plane figure on the catalytic performance of MnO2 for the total oxidation of propane [J].CrystEngComm,2015,17(15):3005-3014.
[23]Wang F,Dai H X,Deng J G,et al.Manganese Oxides with Rod-,Wire-,Tube-,and Flower-Like Morphologies:Highly Effective Catalysts for the Removal of Toluene [J].Environmental Science & Technology,2012,46(7):4034-4041.
[24]拜冰洋.介孔錳、钴氧化物的研制及其催化氧化乙醇和甲醛的研究 [D].北京:清华大学,2014.
Bai B Y.The development of the mesoporous manganese,cobalt oxide and their catalytic oxidation of ethanol and formaldehyde research [D].Beijing:Tsinghua Univertity,2014.
[25]Huang H,Leung D Y C.Complete oxidation of formaldehyde at room temperature using TiO2 supported metallic Pd nanoparticles [J].Acs Catalysis,2011,1(4):348-354.
[26]Bai B,Qiao Q,Arandiyan H,et al.Three-Dimensional ordered mesoporous MnO2 supported Ag nanoparticles for catalytic removal of formaldehyde [J].Environmental Science & Technology,2016,50(5):2635.
[27]Cao X M,Burch R,Hardacre C,et al.Reaction mechanisms of crotonaldehyde hydrogenation on Pt(111):densityfunctional theory and microkinetic modeling [J].Journal of Physical Chemistry C,2011,115(40):19819-19827..
[28]Sinha A,Suzuki K,Takahara M,et al.Mesostructured manganese oxide/gold nanoparticle composites for extensive air purification [J].Angewandte Chemie International Edition,2007,46(16):2891-4.
[29]Yu X,He J,Wang D,et al.Au-Pt bimetallic nanoparticles supported on nest-like MnO2:synthesis and application in HCHO decomposition [J].Journal of Nanoparticle Research,2012,14(11):1-14.
[30]Wen Y,Tang X,Li J,et al.Impact of synthesis method on catalytic performance of MnO x -SnO2,for controlling formaldehyde emission [J].Catalysis Communications,2009,10(8):1157-1160.
[31]Tang X,Li Y,Huang X,et al.MnO x -CeO2,mixed oxide catalysts for complete oxidation of formaldehyde:Effect of preparation method and calcination temperature [J].Applied Catalysis B Environmental,2006,62(3-4):265-273.
[32]Pozan G S.Effect of support on the catalytic activity of manganese oxide catalyts for toluene combustion [J].Journal of Hazardous Materials,2012(221-222):124-130.
[33]Wang N,Li J,Wu L,et al.MnO2 and carbon nanotube co-modified C3N4,composite catalyst for enhanced water splitting activity under visible light irradiation [J].International Journal of Hydrogen Energy,2016,41(48):22734-22750.
[34]Hou J,Li Y,Mao M,et al.Full solar spectrum light driven thermocatalysis with extremely high efficiency on nanostructured Ce ion substituted OMS-2 catalyst for VOCs purification [J].Nanoscale,2015,7(6):2633-2640.
[35]Li D,Wu X,Chen Y.Synthesis of hierarchical hollow MnO2 microspheres and potential application in abatement of VOCs [J].Journal of Physical Chemistry C,2013,117(21):11040-11046.
[36]高凱,邵伟,李春蕾,等.中空纤维膜负载纳米MnO2制备微催化装置 [J].化工新型材料,2014,42(1):67-70.
Gao K,Shao W,Li C L,et al.Hollow fiber membrane formation of nanometer MnO2 catalytic unit load [J].Chemical New Material,2014,42 (1):67-70.
[37]Wang M,Liu H,Huang Z H,et al.Activated carbon fibers loaded with MnO2,for removing NO at room temperature [J].Chemical Engineering Journal,2014,256(6):101-106.
[38]陈仁忠,胡毅,袁菁红,等.静电纺MnO2/PAN纳米纤维膜的制备及其催化氧化甲醛性能 [J].纺织学报,2015,36(5):1-6.
Chen R Z,Hu Y,Yuan J H,et al.Electrostatic spinning MnO2/PAN nanofibers membrane preparation and its catalytic oxidation of formaldehyde [J].Journal of Textile Journal,2015,36(5):1-6.
——庆祝中国共产党成立一百周年贵金属纪念币展

