苹果褪绿叶斑病毒RT-LAMP检测方法的建立
张双纳,李正男,范旭东,张尊平,任芳,胡国君,董雅凤
苹果褪绿叶斑病毒RT-LAMP检测方法的建立
张双纳,李正男,范旭东,张尊平,任芳,胡国君,董雅凤
(中国农业科学院果树研究所国家落叶果树脱毒中心,辽宁兴城 125100)
【目的】建立一种利用反转录环介导等温扩增(reverse transcription loop-mediated isothermal amplification,RT-LAMP)技术简便、快速检测苹果褪绿叶斑病毒(, ACLSV)的方法。【方法】在ACLSV基因组序列的3个保守区域设计3组引物,每组引物包括一对外引物(F3/B3)和一对内引物(FIP/BIP),从3组引物中筛选出一组效果最好的引物。对RT-LAMP反应体系,即Mg2+、dNTPs、Betaine、FIP/BIP、B3/F3浓度进行优化,Mg2+浓度梯度设置为0、2.0、4.0、6.0、8.0、10.0、12.0 mmol·L-1,dNTPs浓度为0.6、0.8、1.0、1.2、1.4、1.6、1.8 mmol·L-1,Betaine浓度为0、0.2、0.4、0.6、0.8、1.0、1.2 mol·L-1,FIP/BIP浓度为0.8、1.2、1.6、2.0、2.4 µmol·L-1,F3/B3浓度为0、0.1、0.2、0.3、0.4 µmol·L-1;优化RT-LAMP反应条件,采用已优化的反应体系,设置65、63、61、59、57℃ 5个不同的反应温度,反应时间设定为90 min。在引物筛选和反应体系反应条件优化过程中,使用荧光定量PCR仪,在反应体系中加入荧光染料,利用荧光信号积累实时监测整个反应过程,根据扩增曲线判断反应结果。以携带苹果茎沟病毒(,ASGV)、苹果茎痘病毒(,ASPV)、苹果花叶病毒 (, ApMV)的植株叶片中提取的总RNA为模板测试RT-LAMP检测方法的特异性。将含ACLSV的叶片总RNA原液进行10倍梯度稀释,以RNA原液和10-1、10-2、10-3、10-4、10-5、10-6稀释液作为模板,进行RT-LAMP反应,测试RT-LAMP检测方法的灵敏性。随机采集23株苹果树的叶片,同时进行RT-LAMP和RT-PCR检测,加入SYBR GreenⅠ进行可视化检测。【结果】建立了ACLSV RT-LAMP检测方法,优化的检测体系为:6.0 mmol·L-1Mg2+、1.2 mmol·L-1dNTPs、0.2 mol·L-1Betaine、1.6 µmol·L-1FIP/BIP和0.2 µmol·L-1F3/B3引物,最佳反应条件为59℃,60 min。特异性检测中,仅ACLSV检测结果为阳性,对照组均为阴性。灵敏性检测中,RT-LAMP方法最低可检测到10-3RNA稀释液,灵敏度是RT-PCR方法的100倍。随机采取的23株苹果叶片样品RT-PCR阳性检出率为52.2%,RT-LAMP阳性检出率为65.2%,RT-LAMP的检出率高于RT-PCR。【结论】建立的ACLSV RT-LAMP检测方法具有简便、快速、灵敏性高、成本低等特点,可满足基层、科研部门在田间调查、种苗繁育和海关检疫中快速检测ACLSV。
苹果;苹果褪绿叶斑病毒;反转录环介导等温扩增;real-time PCR; 病毒检测
0 引言
【研究意义】苹果褪绿叶斑病毒(,ACLSV)是一种重要的落叶果树病毒病原,在世界各地水果产区广泛分布[1],可侵染苹果[2]、梨[3]、杏[4]、桃[5]、樱桃[6]、李子[7]等多种果树,对果树生长和果实产量、品质造成一定的影响。高效灵敏的检测技术是病毒病防控的基础,可为无毒苗木培育和推广提供重要保障[8]。【前人研究进展】在ACLSV检测技术中,指示植物法费时费工[9];酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法简单低廉[10],但ELISA检测效果受抗体质量限制[11];目前,PCR技术应用最为广泛,但RT-PCR的灵敏性受到限制[12];RT-nested PCR检测敏感性和特异性较高,但需要进行两轮PCR,操作较为繁琐、耗时较长[13-14];real-time RT-PCR比RT-nested PCR的检测敏感性和特异性更高,且后续不需要电泳检测,但需较为昂贵的荧光定量PCR仪,实验及仪器操作也需要专业指导,不利于广泛应用[15-16]。ACLSV在大多数寄主植物中潜伏侵染,在寄主叶片和果实上不表现明显症状[17-18],所以无法通过症状观察进行初步诊断,而且病毒在树体中的含量一般很低,有时会出现假阴性结果[19]。因此,开发一种更加灵敏、简便的ACLSV检测方法十分必要。LAMP是一种新型的核酸扩增技术,该技术采用4条特异性引物识别靶序列上的6个特异区,利用DNA置换聚合酶(Bst DNA polymerase)在恒温条件下对靶基因扩增[20],RT-LAMP是在LAMP的基础上加入反转录酶,使得反转录和核酸扩增同时进行[21]。LAMP反应产物可以进行电泳检测(阳性出现瀑布状条带,阴性样品无条带),也可在反应产物中加入SYBR greenⅠ核酸染料直接观察颜色变化(阳性为绿色,阴性为橙色)或LAMP反应也可以在实时浊度仪(扩增超过阈值为阳性(有核酸扩增),未超过阈值为阴性(无核酸扩增))[22]和实时荧光定量PCR仪(若有“S”型扩增曲线,则判断为阳性(有核酸扩增),若无“S”型扩增曲线,则判断为阴性(无核酸扩增))中进行,直接根据扩增曲线判断反应结果,此方法适用于有条件的实验室。近年来,LAMP方法已逐渐应用于各种动物、植物体的病原微生物以及外源基因的检测中[23-27]。【本研究切入点】使用荧光定量PCR仪,对ACLSV RT-LAMP反应体系和反应条件进行优化,并对此方法的灵敏性、特异性和应用特点进行评价。【拟解决的关键问题】建立ACLSV的RT-LAMP检测方法,以期为该病毒的田间检测和防控提供更好的技术支持,同时也可在开展无病毒苗木培育和生产的科研单位及企业推广应用。
1 材料与方法
试验于2017年在中国农业科学院果树研究所国家落叶果树脱毒中心实验室完成。
1.1 试验材料
1.1.1 生物材料 用于LAMP反应体系和条件优化的植株样品为实验室保存的经RT-PCR和ELISA鉴定为ACLSV阳性的富士苹果组培苗;在特异性反应中,感染苹果茎沟病毒(,ASGV)、苹果茎痘病毒(,ASPV)、苹果花叶病毒(,ApMV)样品和健康植株均为实验室保存的经RT-PCR和ELISA鉴定的富士苹果组培苗;田间样品采自辽宁省兴城市的果园。
1.1.2 主要试剂和器材 BIO-RAD实时荧光定量PCR仪(型号:CFX ConnectTMOptics Module);Bst DNA聚合酶购自NEB公司,随酶提供100 mmol·L-1MgSO4和10×等温缓冲液(20 mmol·L-1Tris-HCl,10 mmol·L-1(NH4)2SO4,50 mmol·L-1KCl,2 mmol·L-1MgSO4,0.1% Tween-20,ph 8.8);M-MLV反转录酶购自Promega公司,10 mmol·L-1dNTP购自TaKaRa公司,Betaine购自Sigma-Aldrich公司,荧光试剂购自广州迪澳生物公司,DL2000 Plus DNA Marker购自近岸蛋白质科技有限公司,DEPC处理水购自生工生物工程(上海)股份有限公司。
1.2 试验方法
1.2.1 总RNA提取 称取苹果叶片样品50 mg,采用柱式法从采集的苹果叶片样品中提取总RNA。采用Eppendorf BioPhotometer D30核酸蛋白测定仪测定提取总RNA的浓度,通过琼脂糖凝胶电泳检测提取总RNA的完整性,于-80℃保存备用。
1.2.2 引物设计和合成 根据GenBank公布的18条ACLSV基因组序列,通过Vector NTI软件进行同源性分析,分别在3个相对保守的区域设计3组RT-LAMP检测引物(Ⅰ、Ⅱ、Ⅲ),并设计一对RT-PCR检测引物(表1)。上述引物由上海生工生物公司合成。

表1 RT-LAMP和RT-PCR检测ACLSV所用引物
1.2.3 RT-PCR检测 反转录体系为1.0 ng RNA、1.0 µL 2 µmol·L-1oligod (T)18、DEPC水补至10 µL,65℃ 5 min;体系中加入4.0 µL M-MLV 5×buffer、4.0 µL 2.5 mmol·L-1dNTPs、1.0 µL M-MLV,42℃ 60 min,70℃ 15 min。合成的cDNA于-20℃保存备用。
PCR反应体系为2.0 µL cDNA模板、2.5 µL 10×PCR buffer、2.0 µL 2.5 mmol·L-1dNTPs、1.0 µL rTaq、10 µmol·L-1上下游引物各1.0 µL、DEPC水补至25 µL。PCR反应条件为94℃预变性4 min;90℃变性30 s,60℃退火30 s,72℃延伸1 min,进行35次循环;72℃延伸10 min。
1.2.4 RT-LAMP检测方法建立 RT-LAMP基本检测体系以100—200 ng·µL-1的RNA为模板进行,各成分含量如下:10×Isothermal Amplification Buffer、6.0 mmol·L-1MgSO4、1.4 mmol·L-1dNTPs、1.6 µmol·L-1FIP/BIP Primers、0.2 µmol·L-1F3/B3 Primers、320 U·mL-1Bst DNA聚合酶、40 U M-MLV、荧光染料、1.0 µL模板RNA、DEPC水补至25 µL。反应体系如下:2.5 µL 10×Isothermal Amplification Buffer,1.0 µL 100 mmol·L-1MgSO4,3.5 µL 10 mmol·L-1dNTPs,1.0 µL 40 µmol·L-1FIP/BIP Primers,1.0 µL 5 µmol·L-1F3/B3 Primers,1.0 µL Bst DNA聚合酶,0.2 µL M-MLV,0.5 µL荧光染料,1 µL RNA模板,DEPC补至25 µL。反应条件为63℃,70 min。
采用表1中3组引物(Ⅰ、Ⅱ、Ⅲ)用于上述RT-LAMP基本反应体系进行反应,确定适宜的引物。
RT-LAMP反应体系优化,Mg2+浓度梯度设置为0、2.0、4.0、6.0、8.0、10.0、12.0 mmol·L-1,其余组分按RT-LAMP基本反应体系添加,DEPC补至25 µL(下同);采用最适Mg2+浓度,dNTPs浓度梯度设置为0.6、0.8、1.0、1.2、1.4、1.6、1.8 mmol·L-1;采用最适Mg2+浓度和dNTPs浓度,Betaine浓度梯度设置为0、0.2、0.4、0.6、0.8、1.0、1.2 mol·L-1;采用最适Mg2+浓度、dNTPs浓度和Betaine浓度,FIP/BIP浓度梯度设置为0.8、1.2、1.6、2.0、2.4 µmol·L-1;采用最适Mg2+浓度、dNTPs浓度、Betaine浓度和FIP/BIP浓度,F3/B3浓度梯度设置为0、0.1、0.2、0.3、0.4 µmol·L-1。
RT-LAMP反应条件优化,采用已优化的反应体系,设置65、63、61、59、57℃5个不同的反应温度,反应时间设定为90 min。
以上RT-LAMP反应均以实验室保存的ACLSV阳性组培苗为样品,在实时荧光定量PCR仪中进行,根据扩增曲线出峰快慢和曲线的光滑程度确定最适反应条件。
1.2.5 RT-LAMP特异性验证 采用优化好的反应体系和反应条件,对常见的苹果病毒进行检测。以感染ASGV、ASPV、ApMV、ACLSV、健康植株叶片的RNA为模板,以无菌水为空白对照进行RT-LAMP特异性检测。通过观察实时荧光定量扩增曲线,肉眼观察加入2.0 µL 1 000×SYBR GreenⅠ后反应液颜色变化(绿色为阳性,橙色为阴性)、琼脂糖凝胶电泳(出现特征性梯状条带为阳性,否则为阴性)等方法判定结果。
1.2.6 RT-PCR和RT-LAMP灵敏性检测 提取感染ACLSV叶片总RNA,浓度为408 ng·µL-1,10倍浓度梯度稀释至10-6,以无菌水为空白对照采用RT-LAMP和RT-RCR进行检测灵敏度对比试验。采用肉眼观察加入2.0 µL 1 000×SYBR GreenⅠ后反应液颜色变化和琼脂糖凝胶电泳分析判定结果。
1.2.7 ACLSV田间样品检测 在辽宁省兴城市的果园中随机采集23个苹果植株叶片,分别进行RT-LAMP和RT-PCR检测,采用琼脂糖凝胶电泳、反应液加入2.0 µL 1 000×SYBR GreenⅠ观察颜色变化分析判定结果。
2 结果
2.1 RT-LAMP引物筛选
用3组引物分别对ACLSV阳性样品进行RT-LAMP扩增,每组引物设3个重复,结果如图1所示。Ⅲ组引物扩增效果最好,出峰最早且曲线光滑;Ⅱ组引物在出峰时间和曲线的光滑度上都不及Ⅲ组引物;Ⅰ组引物没有扩增出“S”型曲线。所以采用Ⅲ引物作为ACLSV RT-LAMP的检测引物。
2.2 RT-LAMP反应体系优化
2.2.1 最适Mg2+浓度 随Mg2+浓度的增加RT-LAMP反应出峰时间越早,当Mg2+浓度到达6.0 mmol·L-1时,出峰时间最早且扩增曲线较光滑,当浓度超过6.0 mmol·L-1后,随Mg2+增加反应效果越来越差。故选择6.0 mmol·L-1Mg2+作为ACLSV RT-LAMP检测的最佳浓度(图2)。
2.2.2 最适dNTPs浓度 随着dNTPs浓度的增加,其反应规律同Mg2+反应规律,dNTPs浓度为1.2 mmol·L-1时扩增曲线光滑出峰时间早,故1.2 mmol·L-1dNTPs为ACLSV RT-LAMP检测最适反应浓度(图3)。
2.2.3 最适甜菜碱浓度 加入甜菜碱后扩增效果明显较好,甜菜碱浓度在0.2—0.8 mol·L-1时对RT-LAMP扩增效果影响差异不大且效果好,所以综合考虑成本因素,选择0.2 mol·L-1甜菜碱为最适反应浓度(图4)。

紫色Purple:Ⅰ组引物扩增曲线Amplification curves of group I primers;红色Red:Ⅱ组引物扩增曲线Amplification curves of group Ⅱ primers;黄色Yellow:Ⅲ引物扩增曲线Amplification curves of group Ⅲ primers
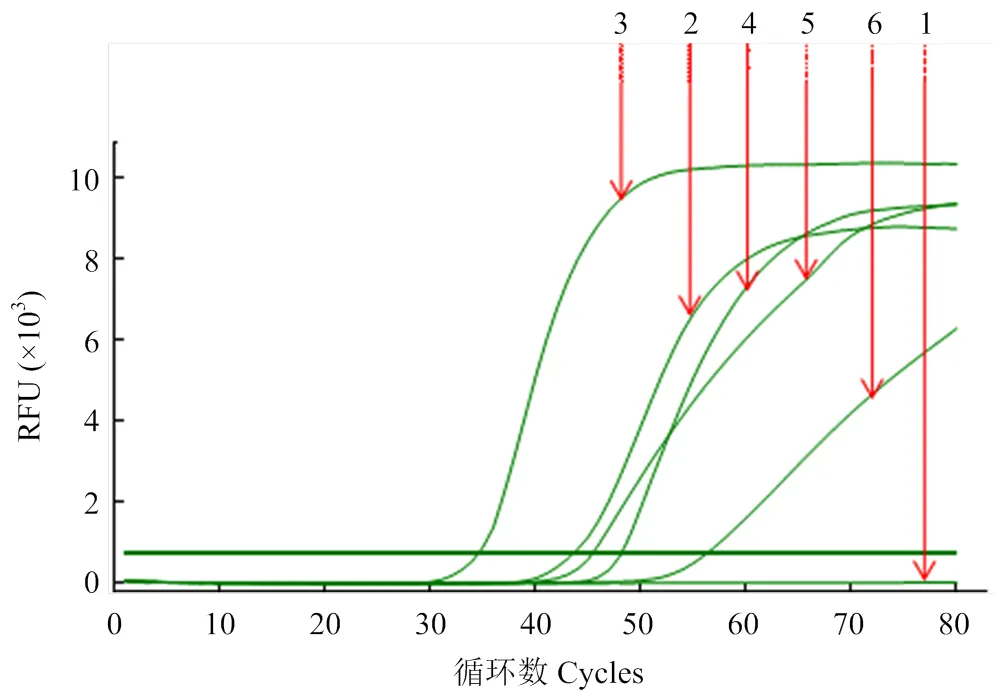
1: 2.0 mmol·L-1; 2: 4.0 mmol·L-1; 3: 6.0 mmol·L-1; 4: 8.0 mmol·L-1; 5: 10.0 mmol·L-1; 6: 12.0 mmol·L-1
2.2.4 最适FIP/BIP浓度 当FIP/BIP浓度为1.6—2.0 µmol·L-1时反应,出峰时间早且曲线光滑,当FIP/BIP浓度高于或低于这个范围时,出峰时间均较晚且曲线不够光滑,故选择1.6 µmol·L-1为FIP/BIP最适反应温度(图5)。
2.2.5 最适F3/B3浓度 当F3/B3浓度为0.2 µmol·L-1时,出峰时间最早且曲线光,当F3/B3浓度高于或低于0.2 µmol·L-1,出峰时间均较晚,且曲线不够光滑,所以选择0.2 µmol·L-1为F3/B3最适反应浓度(图6)。

1: 0.6 mmol·L-1; 2: 0.8 mmol·L-1; 3: 1.0 mmol·L-1; 4: 1.2 mmol·L-1; 5: 1.4 mmol·L-1; 6: 1.6 mmol·L-1; 7: 1.8 mmol·L-1

1: 0 mol·L-1; 2: 0.2 mol·L-1; 3: 0.4 mol·L-1; 4: 0.6 mol·L-1; 5: 0.8 mol·L-1; 6: 1.0 mol·L-1; 7: 1.2 mol·L-1
2.3 最适反应条件
在所设置的4个不同反应温度下,65℃RT- LAMP反应不能进行,63、61℃出峰较晚,59℃时出峰时间最早,且曲线光滑,故选择59℃为RT-LAMP最适反应温度;从在59℃下扩增的两条曲线来看,当反应时间到达60 min时,反应的扩增量已经达到最大值,故选择60 min为反应最适时间(图7)。
2.4 特异性检测
以感染ASGV、ASPV、ApMV、ACLSV和健康植株叶片的RNA为模板,以无菌水为空白对照进行RT-LAMP特异性检测。RT-LAMP扩增产物经2%琼脂糖凝胶电泳,仅ACLSV阳性样品呈现特征性梯状条带,其他样品均未见特征性扩增条带(图8-A);各管中加入2.0 µL 1 000×SYBR GreenⅠ后,仅有ACLSV阳性样品反应液颜色变绿,其他各管均为橙色(图8-B);实时荧光定量PCR仪观测结果同样,ACLSV阳性样品扩增曲线为光滑的“S”型,其他3个病毒阳性样品未形成“S”型曲线(图8-C)。

1: 0.8 µmol·L-1; 2: 1.2 µmol·L-1; 3: 1.6 µmol·L-1; 4: 2.0 µmol·L-1; 5: 2.4 µmol·L-1

1: 0 µmol·L-1; 2: 0.1 µmol·L-1; 3: 0.2 µmol·L-1; 4: 0.3 µmol·L-1; 5: 0.4 µmol·L-1
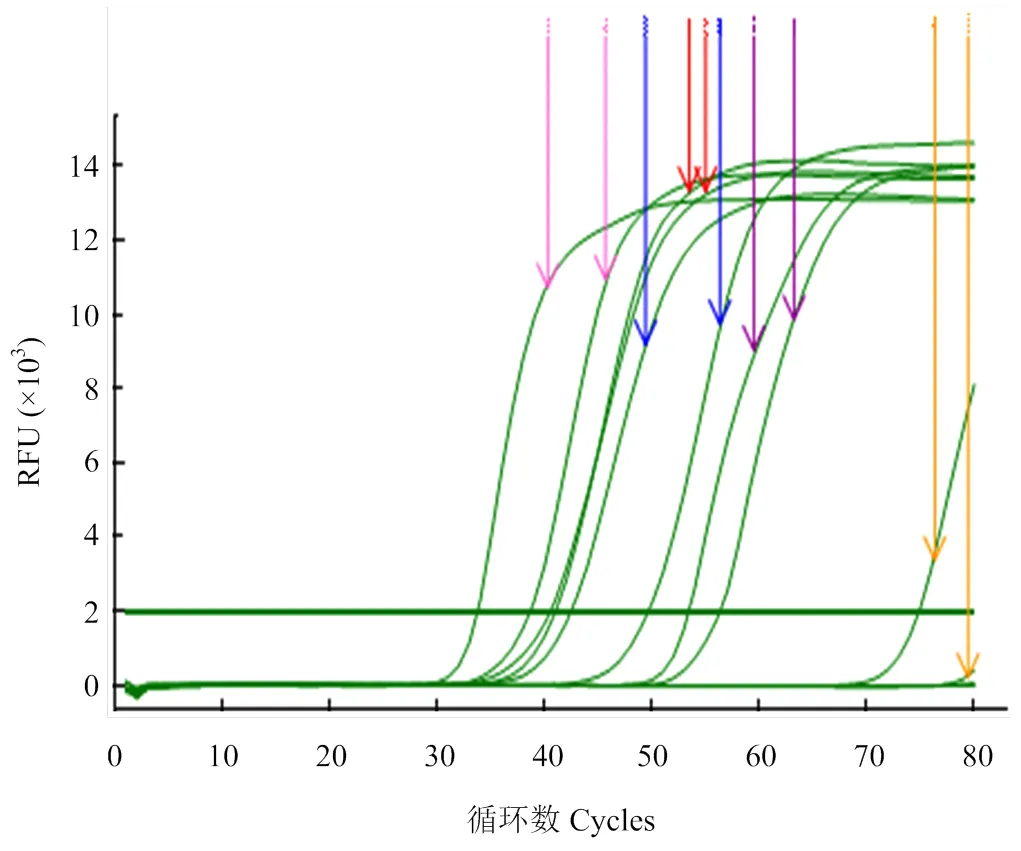
黄色Yellow:65℃;紫色Purple:63℃;蓝色Blue:61℃;粉色Pink:59℃;红色Red:57℃
2.5 RT-PCR和RT-LAMP灵敏性检测
将ACLSV阳性样品总核酸进行10倍梯度浓度稀释至10-6,分别进行RT-LAMP和RT-PCR反应。各管中加入2.0 µL 1 000×SYBR GreenⅠ结果显示总核酸稀释至10-3时,RT-LAMP仍能检测出ACLSV(图9-A、9-B),RT-PCR检测ACLSV的总核酸最大稀释倍数为10-1(图9-C),表明RT-LAMP检测ACLSV的灵敏度是RT-PCR的100倍。
2.6 田间疑似病株检测
将田间随机采集的23个ACLSV疑似感染植株,进行RT-PCR和RT-LAMP检测。结果23个疑似感染植株RT-LAMP检测出15个阳性样品(图10-A、10-B),检出率为65.2%;RT-PCR检测出12个阳性样品(图10-C),检出率为52.2%。RT-LAMP检测出ACLSV阳性样品多于RT-PCR,表明RT-LAMP较高的灵敏性。
3 讨论
在RT-LAMP反应体系和反应条件的优化试验中笔者采用了实时荧光定量PCR仪对结果进行了实时观测,保证了试验结果更为精确和客观,同时也可避免RT-LAMP产物对实验室造成污染的威胁。实时荧光定量PCR仪在反应体系中加入荧光基团,反应体系中荧光显色物质的参与,使得扩增过程中的荧光强度和产物之间建立对应的线性关系,最终通过电脑分析收集的信号形成扩增曲线。理想状态下扩增曲线符合2N方程(N为循环次数),线型应为“J”型,但本研究中扩增曲线通常表现为“S”型。在PCR扩增曲线初期信号的背景值与产生的荧光值不能明显区分,荧光信号随着PCR的产物扩增进入指数期、线性期和最终的平台期后,PCR产物的量就可以在指数期的线型上被检测出来[28]。本试验正是利用了这一原理,在反应体系中加入荧光染料,实时监测扩增过程,后通过扩增曲线确定反应的扩增效果。

A:电泳检测Detection by electrophoresis;B:肉眼观察加入SYBR GreenⅠ后反应液颜色变化Observation of the color change of the reaction liquid after adding SYBR Green I;C:实时荧光定量扩增曲线判断The judgement curves of real-time amplification。1:ACLSV;2:ApMV;3:ASGV;4:ASPV;5:清水对照Water control

A:肉眼观察加入SYBR GreenⅠ后RT-LAMP 反应液颜色变化Observation of the color change of the RT-LAMP reaction liquid after adding SYBR Green I;B:RT-LAMP电泳检测Electrophoresis detection of RT-LAMP;C:RT-PCR电泳检测Electrophoresis detection of RT-PCR。M:2000 bp DNA marker;1—7:RNA原液100—10-6稀释液100-10-6diluents of original RNA;8:清水对照Water control

A:RT-LAMP产物加入SYBR GreenⅠ SYBR Green Ⅰdye result of RT-LAMP product;B:RT-LAMP产物电泳检测electrophoresis detection of RT-LAMP product;C:RT-PCR电泳检测electrophoresis detection of RT-PCR product。M:2000 bp DNA marker;1—23:待测样品Samples;24:清水对照Water control
引物在整个反应中起着重要的作用,不同引物其退火温度及引物间序列碱基大小的不同,直接影响RT-LAMP反应中茎环结构的形成[29],从而影响RT-LAMP反应。本试验依据RT-LAMP反应原理,在18条已报道的ACLSV基因组保守区域设计了3组引物。3组引物设计过程中,在满足反应原理的基础上,尽量将引物位置定位在保守区域,再通过试验验证引物的可用性。由图1可得出的第3组引物效果最好,原因应该是该组引物与ACLSV基因组匹配度更高,其余两组引物可能是不符合RT-LAMP的反应要求。
本试验对RT-LAMP反应体系,即Mg2+、dNTPs、Betaine、FIP/BIP、F3/B3浓度,反应时间和反应温度均进行了优化,确保了反应在最佳的条件下进行,节省了材料和时间。对4种常见的苹果病毒病原进行了RT-LAMP特异性研究,结果表明RT-LAMP检测ACLSV具有很高的特异性。2016年,卢永灿[30]针对梨寄主建立了ACLSV RT-LAMP检测方法。本研究针对苹果寄主,进一步完善了用RT-LAMP法检测不同寄主感染ACLSV的情况,而且通过实时荧光定量PCR仪进行实时监测,试验结果更精确更具有说服力。
高效灵敏是LAMP反应的一大优点,本研究表明RT-LAMP的确具有很高的特异性,RT-LAMP的灵敏度是RT-PCR的100倍。周彤等[21]利用RT-LAMP方法检测水稻黑条矮缩病毒(,RBSDV),结果表明RT-LAMP检测方法可特异地检测植物和飞虱体内的RBSDV,与RT-PCR灵敏度基本一致;刘科宏等[24]研究表明,RT-LAMP方法检测柑橘黄化脉明病毒()灵敏度是RT-PCR方法的10倍;王永江等[31]研究表明,RT-LAMP方法检测柑橘衰退病毒(,CTV)灵敏度是RT-PCR的100倍;Ju[32]利用RT-LAMP技术检测马铃薯卷叶病毒()的灵敏度是RT-PCR技术的2000倍;姜珊珊等[33]研究表明,RT-LAMP检测甘薯羽状斑驳病毒(,SPFMV)灵敏度是RT-PCR的10倍。由此可见,不同的RT-LAMP反应中,RT-LAMP的灵敏度差异较大,原因可能是在不同的反应中设计的引物长度、引物间距离、引物溶解温度、引物末端稳定性、GC含量与二级结构不同,引物和模板的结合率受到了不同的影响,也可能与反应中酶活性、化学试剂、人为操作有关。
目前世界上报道的苹果病毒有39种之多[1],培育无毒苗木以及开展苹果病毒种类调查均需要对病毒进行检测。RT-LAMP作为一种敏感、特异、简便、快速的新型检测技术,具有一定的优越性,已经广泛应用于医学、农业等各个领域。本研究建立的RT-LAMP检测方法,无需专门的仪器,直接以待测样品RNA为模板,一步反应即可完成检测,反应仅需1 h,更适合基层单位对大量样品进行ACLSV检测。
4 结论
成功建立了苹果褪绿叶斑病毒(ACLSV)RT- LAMP检测方法,该方法具有较好的特异性、灵敏性,可以快速地通过肉眼观察试验结果,适合基层单位大量检测ACLSV。
[1] 李文慧, 牛建新. 苹果病毒的研究现状. 北方果树, 2006(4): 3-5.
LI W H, NIU J X. The research status of apple viruses., 2006(4): 3-5. (in Chinese)
[2] Sato K, Yoshikawa N, Takahashi T. Complete nucleotide sequence of the genome of an apple isolate of., 1993, 74(9): 1927-1931.
[3] Zhu H, Wang G P, Hu H J,TIAN R, HONG N. The genome sequences of three isolates offrom pear (sp.) in China., 2014, 36(3): 396-402.
[4] Wang M, Dai H. First report ofin Hawthorn in China., 2015, 99(1): 164.
[5] Niu F, Pan S, Wu Z, JIANG D, LI S. Complete nucleotide sequences of the genomes of two isolates offrom peach () in China., 2012, 157(4): 783-786.
[6] German-retana S, Bergey B, Delbos R P, CANDRESSE, DUNEZ J. Complete nucleotide sequence of the genome of a severe cherry isolate of(ACLSV)., 1997, 142(4): 833-841.
[7] Jelkmann W. The nucleotide sequence of a strain of(ACLSV) responsible for plum pseudopox and its relation to an apple and plum bark split strain., 1996, 86(Suppl. 11): S101.
[8] 陈柳, 尚巧霞, 陈笑瑜, 邢冬梅, 冉策, 魏艳敏, 赵晓燕, 刘正坪. 草莓轻型黄边病毒RT-LAMP检测方法的建立. 中国农业科学, 2015, 48(3): 613-620.
CHEN L, SHANG Q X, CHEN X Y, XING D M, RAN C, WEI Y M, ZHAO X Y, LIU Z P. Detection ofRT-LAMP., 2015, 48(3): 613-620. (in Chinese)
[9] 洪霓, 王国平. 苹果褪绿叶斑病毒生物学及生化特性研究. 植物病理学报, 1999, 29(1): 77-81.
HONG N, WANG G P. The biological and biochemical characterization of, 1999, 29(1): 77-81. (in Chinese)
[10] 耿超, 牟安丽, 刘志强, 李向东, 周涛. 苹果褪绿叶斑病毒外壳蛋白基因的原核表达及抗血清制备. 果树学报, 2012, 29(5): 755-758.
GENG C, MU A L, LIU Z Q, LI X D, ZHOU T. Preparation of antiserum towith coat protein expressed in., 2012, 29(5): 755-758. (in Chinese)
[11] 郑佩燕, 孙宝清, 黄惠敏, 韦妮莉, 李靖, 陈德晖. 采用酶联免疫捕获法和荧光酶联免疫吸附法检测过敏原IgE抗体的比较分析. 重庆医科大学学报, 2011, 36(5): 595-598.
ZHENG P Y, SUN B Q, HUANG H M, wei n l, LI J, CHEN D H. Capture ELISA and FEIA assay for allergen-specific IgE antibody: a comparative analysis., 2011, 36(5): 595-598. (in Chinese)
[12] Lien K Y, Lee W C, Lei H Y, Lee G B. Integrated reverse transcription polymerase chain reaction systems for virus detection., 2007, 22(8): 1739-1748.
[13] 王婧, 毕阳, 朱艳, 韩舜愈, 祝霞, 盛文军, 李敏. 巢式PCR快速检测西瓜细菌性果斑病菌. 中国农业科学, 2014, 47(2): 284-291.
WANG J, BI Y, ZHU Y, HAN S Y, ZHU X, SHENG W J, LI M. Nested-PCR rapidly detectsubsp.from watermelon seeds., 2014, 47(2): 284-291. (in Chinese)
[14] Gundersen D E, Lee I M. Ultrasensitive detection of phytoplasmas by nested-PCR assays using two universal primer pairs., 1996, 35(3): 144-151.
[15] 范旭东, 董雅凤, 张尊平, 任芳, 胡国君, 朱红娟. 葡萄病毒分子检测技术研究进展. 园艺学报, 2014, 41(5): 1009-1019.
FAN X D, DONG Y F, ZHANG Z P, REN F, HU G J, ZHU H J. Progress on molecular detection of grapevine viruses., 2014, 41(5): 1009-1019. (in Chinese)
[16] ČEPIN U, GutiérrÉz-Aguirre I, Balažic L, POMPE- NOVAK M, GRUDEN K, RAVNIKAR M. A one-step reverse transcription real-time PCR assay for the detection and quantitation of., 2010, 170(1/2): 47-56.
[17] Watpade S, Raigond B, Thakur P D, Handa A, Pramanick K K, Sharma Y P, Tomar M. Molecular detection of latentin elite mother plants of apple, 2012, 23(3): 359-363.
[18] Hao L, Xie J, Chen S, Wang S, Gong Z, Ling K S, Guo L, Fan Z, Zhou T. A multiple RT-PCR assay for simultaneous detection and differentiation of latent viruses and apscarviroids in apple trees., 2016, 234: 16-21.
[19] Peng D, Xie J, Qiang W, LING KS, GUO L, FAN Z, ZHOU T. One-step reverse transcription loop-mediated isothermal amplification assay for detection of., 2017, 248: 154-158.
[20] Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. Loop-mediated isothermal amplification of DNA., 2000, 28(12): e63.
[21] 周彤, 杜琳琳, 范永坚, 周益军. 水稻黑条矮缩病毒RT-LAMP快速检测方法的建立. 中国农业科学, 2012, 45(7): 1285-1292.
ZHOU T, DU L L, FAN Y J, ZHOU Y J. Development of a RT-LAMP assay for rapid detection of., 2012, 45(7): 1285-1292. (in Chinese)
[22] Mori Y, Kitao M, Tomita N, NOTOMI T. Real-time turbidimetry of LAMP reaction for quantifying template DNA., 2004, 59(2): 145-157.
[23] MORI Y, Notomi T. Loop-mediated isothermal amplification (LAMP): a rapid, accurate, and cost-effective diagnostic method for infectious diseases., 2009, 15(2): 62-69.
[24] 刘科宏, 陈洪明, 周彦, 李中安. 柑橘黄化脉明病毒RT-LAMP检测方法的建立. 园艺学报, 2015, 42(5): 997-1002.
LIU K H, CHEN H M, ZHOU Y, LI Z A. Establishment of RT-LAMP assay for detection of, 2015, 42(5): 997-1002. (in Chinese)
[25] thai H T C, Le M Q, Vuong C D, PARIDA M, MINEKAWA H, NOTOMI T, HASEBE F, MORITA K. Development and evaluation of a novel loop-mediated isothermal amplification method for rapid detection of severe acute respiratory syndromeCoronavirus., 2004, 42(5): 1956-1961.
[26] Harper S J, Ward L I, Clover G R. Development of LAMP and real-time PCR methods for the rapid detection offor quarantine and field applications., 2010, 100(12): 1282-1288.
[27] 李健, 陈沁, 熊炜, 方雪恩.口蹄疫病毒RT-LAMP检测方法的建立. 病毒学报, 2009, 25(2): 137-142.
LI J, CHEN Q, XIONG W, FANG X N. Establishment of RT-LAMP for rapid detection of., 2009, 25(2): 137-142. (in Chinese)
[28] 李月华. LAMP与SYBR GREEN I实时荧光定量PCR方法检测酸奶中葡糖杆菌的研究[D]. 保定: 河北农业大学, 2015.
LI Y H. Study on LAMP and SYBR GREEN I real time PCR for detection ofin yoghourt[D]. Baoding: Agricultural University of Hebei, 2015. (in Chinese)
[29] 朱韩武, 曹俊, 周华云, 李菊林, 朱国鼎, 顾亚萍, 王伟明, 刘耀宝, 陶志勇, 高琪. 环介导等温扩增技术检测蚊体内间日疟原虫子孢子的研究. 中国血吸虫病防治杂志, 2010, 22(2): 158-163.
ZHU H W, CAO Y, ZHOU H Y, LI J L, ZHU G D, GU Y P, WANG W M, LIU Y B, TAO Z Y, GAO Q. Detection ofsporozoites-carrying mosquitoes using loop-mediated isothermal amplification (LAMP)., 2010, 22(2): 158-163. (in Chinese)
[30] 卢永灿. 三种梨病毒实时荧光定量RT-PCR和RT-LAMP检测技术的研究[D]. 武汉: 华中农业大学, 2016.
lU Y C. The establishment of real-time RT-PCR and RT-LAMP techniques for the detection of three viruses infecting pear plants[D]. Wuhan: Huazhong Agricultural University, 2016. (in Chinese)
[31] 王永江, 周彦, 李中安, 苏华楠, 黄爱军, 唐科志, 周常勇. 柑橘衰退病毒RT-LAMP快速检测方法的建立. 中国农业科学, 2013, 46(3): 517-524.
WANG Y J, ZHOU Y, Li Z A, SU H N, HUANG A J, TANG K Z, ZHOU C Y. A RT-LAMP assay for detection of, 2013, 46(3): 517-524. (in Chinese)
[32] Ju H J. Simple and rapid detection ofby reverse transcription loop-mediated isothermal amplification., 2011, 27(4): 385-389.
[33] 姜珊珊, 冯佳, 张眉, 王升吉, 辛志梅, 吴斌, 辛相启. 甘薯羽状斑驳病毒 RT-LAMP 快速检测方法的建立. 中国农业科学, 2018, 51(7): 1294-1302.
JIANG S S, FENG J, ZHANG M, WANG S J, XIN Z M, WU B, XIN X Q. Development of RT-LAMP assay for rapid detection of(SPFMV)., 51(7): 1294-1302. (in Chinese)
(责任编辑 岳梅)
Establishment of RT-LAMP Assay for Detection of(ACLSV)
ZHANG ShuangNa, LI ZhengNan, FAN XuDong, ZHANG ZunPing, REN Fang, HU GuoJun, DONG YaFeng
(National Center for Eliminating Viruses from Deciduous Fruit Tree, Institute of Pomology, Chinese Academy of Agricultural Sciences, Xingcheng 125100, Liaoning)
【Objective】The objective of this study is to establish a method which uses reverse transcription loop-mediated isothermal amplification (RT-LAMP) technology, and to detect(ACLSV) simply and quickly. 【Method】Three sets of specific primers were designed based on conserved region of ACLSV genomes. Each set of primers includes a pair of outer primer (F3/B3) and a pair of inner primer (FIP/BIP). One feasible set of primers was selected for the RT-LAMP reaction. RT-LAMP reaction system was optimized, that is, the concentration of Mg2+(0, 2.0, 4.0, 6.0, 8.0, 10.0, 12.0 mmol·L-1), dNTPs (0.6, 0.8, 1.0, 1.2, 1.4, 1.6, 1.8 mmol·L-1), Betaine (0, 0.2, 0.4, 0.6, 0.8, 1.0, 1.2 mol·L-1), FIP/BIP (0.8, 1.2, 1.6, 2.0, 2.4 µmol·L-1) and F3/ B3 (0, 0.1, 0.2, 0.3, 0.4 µmol·L-1), respectively. The RT-LAMP reaction condition was optimized, using optimized reaction system, reaction temperature was set to 65, 63, 61, 59, 57℃ and reaction time was set for 90 min. In the process of primers screening and optimizing the reaction system, fluorescent pigment was addedto the reaction system and real-time PCR instrument was used. The whole process was detected in real-time by fluorescence signal accumulation. Finally, the amplification curve was used to analyze the reaction result. the specificity detection of RT-LAMP was tested by using different RNA templates of infected leaves from ACLSV,(ASGV),(ASPV) and(ApMV). To assess the detection sensitivity, 100, 10-1, 10-2, 10-3, 10-4, 10-5, 10-6diluents of original RNA were used as templates of RT-LAMP. To evaluate the application value of this method, 23 apple leaf samples were collected randomly in the field, the optimized RT-LAMP and RT-PCR were used to detect the samples, SYBR GreenⅠwas added to visualize the detection. 【Result】 The RT-LAMP method to detect ACLSV was established. The optimized detection system was 6.0 mmol·L-1Mg2+, 1.2 mmol·L-1dNTPs, 0.2 mol·L-1Betaine, 1.6 µmol·L-1FIP/BIP and 0.2 µmol·L-1F3/B3 primer. The optimum reaction conditions were 59℃ and 60 min. In the specificity test, only the ACLSV test result was positive, the controls were all negative. In the sensitivity test, the 10-3RNA dilution could be detected by RT-LAMP method. It was 100 times higher sensitivity than RT-PCR method. The positive rate of RT-PCR of randomly selected 23 apple leaf samples was 52.2%, and RT-LAMP was 65.2%. Detection rate of RT-LAMP was higher than that of RT-PCR. 【Conclusion】The established ACLSV RT-LAMP detection method is simple, quick, sensitive and low cost. It can be applied in field investigation, seeding breeding and customs quarantine.
apple;(ACLSV); reverse transcription loop-mediated isothermal amplification (RT-LAMP); real-time PCR; virus detection
10.3864/j.issn.0578-1752.2018.09.008
2017-09-26;
2017-11-27
中央级公益性科研院所基本科研业务费专项(1610182016017)、中国农业科学院科技创新工程(ZX75-2018)
张双纳,E-mail:zsnjer@163.com。
董雅凤,E-mail:yfdong1234@163.com

