绿豆萌发过程中蛋白组分及亚基变化
赵天瑶,张亚宏,金涛,康玉凡
绿豆萌发过程中蛋白组分及亚基变化
赵天瑶1,张亚宏1,金涛2,康玉凡1
(1中国农业大学农学院,北京 100193;2湿地生态与农业利用教育部工程研究中心/湖北省涝渍灾害与湿地农业重点实验室,湖北荆州 434025)
【目的】探索不同萌发时期绿豆分离蛋白、清蛋白、球蛋白、谷蛋白和醇溶蛋白含量的动态变化规律,以及蛋白质组分(分离蛋白、球蛋白和清蛋白)的亚基组成及含量变化,为绿豆蛋白的加工利用提供科学依据。【方法】采用等电点沉淀法提取绿豆分离蛋白,并根据Osborne分类法制备绿豆清蛋白、谷蛋白、球蛋白和醇溶蛋白,比较分析萌发前后绿豆分离蛋白及各蛋白组分含量的变化,同时通过SDS-PAGE电泳进一步分析萌发前后蛋白亚基组成及数量的变化。【结果】随着萌发时间的延长,绿豆分离蛋白的含量呈现先增高后下降的趋势,萌发36 h时与未萌发的绿豆相比提高了9.4%。绿豆清蛋白含量随着萌发时间的延长呈逐渐下降的趋势,萌发84 h时含量最小,为20.47 mg∙g-1。球蛋白随着萌发时间的延长呈现先升高后下降的趋势,萌发48 h时其含量最大,且比未萌发时提高了3.47倍。萌发对绿豆醇溶蛋白的含量变化影响不大。绿豆谷蛋白含量在萌发12—36 h和48—72 h变化无明显差异,但相对于未萌发的绿豆仍有一定程度的提高。绿豆蛋白酶活性在萌发36 h后不断上升,变化相对较大,72 h时开始下降。SDS-PAGE电泳图及光密度扫描分析结果发现,绿豆分离蛋白主要由7条条带组成(Ⅰ—Ⅶ),萌发过程中各条带相对含量不断减少,随着萌发时间的延长,分子量在25—66 kD的条带含量逐渐降低,分子量在18—25 kD的亚基条带含量在萌发的前72 h有所增加,萌发至96 h时几乎只剩下Ⅳ条带。绿豆清蛋白主要由4条条带组成(Ⅰ—Ⅳ),分子量分别为61.56、48.99、29.88和20.42 kD,萌发过程中条带Ⅰ相对含量从0 h的18.4%降至60 h的16.4%,萌发72 h后条带Ⅰ消失;条带Ⅱ在萌发过程中始终存在,但是含量不断减少;条带Ⅲ和条带Ⅳ也在萌发过程中不断减少,萌发72 h后消失。同时,分子量为18—25 kD的亚基条带相对含量在24—60 h增加,萌发至72 h逐渐消失,几乎只剩下条带Ⅱ。绿豆球蛋白主要由5条条带组成(Ⅰ—Ⅴ),分子量分别为66、61、50、32和26 kD。萌发过程中亚基条带Ⅰ和Ⅱ都在萌发96 h时消失;而条带Ⅲ在萌发过程前期(0—60 h)相对含量逐渐增大,为34.4%—41.8%,萌发72 h后条带Ⅲ含量迅速下降,萌发至96 h时仅为10.8%;亚基条带Ⅳ和Ⅴ萌发至84 h后消失。分子量在18—25 kD的亚基条带在萌发24—60 h时有所增加,随着萌发时间的延长,出现降解甚至消失。【结论】适当萌发能提高蛋白的含量,促进大分子亚基发生水解,同时有利于小分子亚基或多肽生成,但萌发时间过长并不完全利于蛋白的利用。
绿豆;萌发;蛋白组分;亚基
0 引言
【研究意义】随着社会的不断进步,人民生活质量不断改善,对食品的健康越来越关注。目前,天然产品的价值正在超过合成产品,由于动物蛋白价格昂贵,利用率有限,在世界范围内尤其在一些贫穷国家,低价的膳食纤维蛋白不断被利用,人们对植物蛋白的关注正在不断增强。基于我国人多地少和粮食转化效率低的现状,开发植物蛋白刻不容缓。绿豆是一种优质的植物蛋白资源作物,其蛋白的生产成本仅为动物蛋白的15%左右,具有广阔的应用前景和丰富的保健功能[1-3]。萌发后的绿豆不仅营养价值增加,同时含有丰富的蛋白质和生物活性[4]。然而,目前绿豆的工业化多以生产淀粉为主,绿豆蛋白却被用作牲畜饲料或者废弃物,资源浪费严重[5]。因此,研究绿豆萌发过程中各蛋白组分及亚基含量的变化,有利于开发绿豆蛋白的应用潜力,提高其有效利用率和经济价值。【前人研究进展】种子在萌发过程中内部新陈代谢增加,分子量较大的贮藏蛋白被水解和消耗,不溶性氮含量下降;蛋白质组分及其氨基酸构成发生变化,影响其营养及功能特性[6-7]。研究发现随着萌发时间的延长,小扁豆和马嘴豆蛋白质的含量会逐渐上升[8];萌发5 d后的豌豆分离蛋白含量有所增加,是潜在的食品添加剂[9]。此外,种子萌发可以使谷物和豆类等中有毒、有害或抗营养物质含量有所减少或消除,提高蛋白与淀粉的消化率,同时也可以增加谷物内某些限制性氨基酸和维生素等营养物质的含量[10]。豆类在萌发过程中不仅蛋白质含量会增加,同时其亚基组成也会发生一定的变化。SAVELKOUL等[11-12]研究发现,大豆萌发过程中一些大的蛋白质亚基条带在萌发1—2 d时开始消失,萌发2 d后蛋白质小分子亚基逐渐出现;大豆7S球蛋白的α、α’亚基和11S球蛋白的酸性亚基在萌发过程中不同程度的被分解,分子量在20.0—35.0 kD的亚基条带在萌发后出现[10,13]。王素雅等[14]对萌发过程中小扁豆蛋白亚基的变化研究发现,萌发第3天后小扁豆蛋白质中分子量较大的酸性亚基发生降解,一些分子量较小的亚基条带(28—32、20和10 kD)出现,但是一些原始亚基(35、30、12和11 kD)并未发生变化。【本研究切入点】尽管萌发能够提高种子营养价值和蛋白含量已得到充分的研究证实,但对绿豆不同萌发时期蛋白含量和亚基变化的研究鲜有报道,探索其动态变化规律对蛋白的开发和利用十分重要。【拟解决的关键问题】通过研究绿豆萌发过程中蛋白组分含量的动态变化,并进一步探究其蛋白亚基组成及含量的变化规律,为提高绿豆蛋白的利用提供重要的科学依据,同时开拓绿豆的应用前景。
1 材料与方法
试验于2017—2017年在中国农业大学农学院实验室进行。
1.1 试验材料
供试绿豆品种为‘白绿8号’(蛋白质含量为(27.23± 0.80)g/100 g,脂肪含量为(0.62±0.06)g/100 g,总糖含量为(36.35±0.78)g/100 g),由吉林省白城市农业科学院提供。氢氧化钠、盐酸、氯化钾、氯化钠、三氯乙酸、蔗糖、乙醇、丙酮、溴酚蓝均为国产分析纯试剂;牛血清蛋白、考马斯亮蓝G-250、考马斯亮蓝R-250购于北京广达恒益科技有限公司。
1.2 仪器与设备
人工气候培养箱(上海比朗仪器有限公司);HW.SY21-KP4恒温水浴锅(北京市长风仪器有限公司);KDN-08C定氮仪(上海雷磁仪器厂);UV759CRT紫外分光光度计(上海佑科仪器仪表有限公司);Centrifuge 5810R离心机(德国eppendorf公司);索氏脂肪抽提器(天津玻璃仪器厂);RADWAG分析天平(北京乾明基因技术有限公司);TKHZ-C型恒温振荡器(北京佳源兴业科技有限公司);JY600C型电泳仪(北京君意东方电泳设备有限公司);凝胶成像仪(美国BIO-RAD公司)。
1.3 试验方法
1.3.1 萌发处理 挑选大小一致、健康饱满绿豆籽粒,加入80℃的蒸馏水(1﹕3)烫种3 min后加常温蒸馏水浸泡10 h;最后将浸泡好的绿豆种子平铺到发芽盘中,将发芽盘放入人工气候箱中避光孵育,条件设定温度为(22±1)℃,湿度(80±5)%,每隔6 h浇水一次[15-16]。每隔12 h取样一次,取样后经液氮处理,保存在-40℃冰箱中备用。
1.3.2 蛋白质提取
(1)绿豆分离蛋白制备 绿豆除杂后进行烘干、磨粉,过80目筛备用。称取2 g(精确到0.0001 g)左右样品,置于干燥的烧杯中,加入蒸馏水浸泡,用0.5 mol∙L-1NaOH溶液调节提取液的pH,后放入恒温水浴锅中进行浸提。30 min后将烧杯混合液倒入离心管中,在-4℃、400 r/min的条件下离心20 min,吸取上清液,将其pH调至4.6,同时加入0.05 mol∙L-1HCl溶液搅拌,使沉淀均匀。得到的沉淀经过冷冻干燥后可得绿豆蛋白粉[17]。
(2)绿豆各蛋白组分制备 采用Osborne分级提取工艺[18-20]的方法,略作修改。脱脂后的萌发绿豆粉溶于蒸馏水中,料液比为1﹕10,在室温条件下搅拌1 h后离心(8 000×,20 min,4℃),过滤上清液,加入500 mL蒸馏水再次进行水提,操作条件与之前相同。合并两次所得上清液,调节等电点进行酸沉后离心(8 000×,20 min,4℃),冷冻干燥的成品即为清蛋白。
将提取清蛋白后的沉淀用0.5 mol∙L-1NaCl进行浸提,在室温条件下搅拌浸提1 h后离心(8 000×,20 min,4℃),过滤上清液。再加500 mL 0.5 mol∙L-1NaCl对沉淀进行再次浸提,操作条件与前者相同。合并两次所得的上清液,调节等电点并离心获得沉淀,进行冷冻干燥,所得样品即为球蛋白。
将提取球蛋白后所得的沉淀用70%(v/v)的乙醇进行浸提,在室温条件下搅拌浸提1 h后离心(8 000×,20 min,4℃),过滤上清液。然后再用70%乙醇对沉淀再次浸提,操作条件与前者相同。合并两次所得的上清液,旋转蒸发浓缩后再进行冷冻干燥,所得样品即为醇溶蛋白。
将提取醇溶蛋白后所得的沉淀用0.05 mol∙L-1的NaOH溶液进行浸提,室温条件下搅拌浸提1 h后离心(8 000×,20 min,4℃),过滤上清液。然后再用0.05 mol∙L-1NaOH溶液对沉淀进行再次浸提,操作条件与前者相同。合并两次所得的上清液,边搅拌边向其中滴加20%(w/v)的三氯乙酸,至三氯乙酸的最终浓度为5%(w/v),离心后所得沉淀用预冷的丙酮洗涤3次;然后将沉淀进行热风干燥,所得样品即为谷蛋白。
1.3.3 蛋白质含量和蛋白酶活力的测定 采用考马斯亮蓝法测定萌发后各蛋白的含量,以牛血清蛋白(BSA)作为标准蛋白[21];蛋白酶活力参照凌猛等[22]方法,以酪氨酸作为标准,测定275 nm处吸光值,结果以U∙mg-1表示。
1.3.4 SDS-PAGE电泳 参照LAEMMLI等[23]的方法,采用浓度为12%的分离胶,浓度为5%的浓缩胶进行不连续垂直板状凝胶电泳,板的厚度约1.5 mm。称取1.5 mg的不同蛋白样品,加入样品缓冲液(0.1 mol∙L-1Tris-HCl、1% SDS、0.1 g∙L-1溴酚蓝、150 g∙L-1蔗糖,pH 8.0)500 μL,电泳前静置一夜或沸水浴3—5 min,离心后上样,上样量为10 μL。
电泳时采用恒流模式,样品在浓缩胶部分时采用20 mA电流进行电泳,在分离胶部分将电流增至40 mA。采用考马斯亮蓝溶液R-250对凝胶进行染色1 h,然后使用脱色液进行过夜脱色。采用JY系列凝胶成像分析用于电泳结束后凝胶条带的观察、拍摄,采用Quantity-one软件(version4.6)进行光密度扫描分析,根据各蛋白条带迁移率计算各亚基相对分子量,并计算各蛋白组分含量及纯度。
1.3.5 数据分析 每个处理均平行测定3次,运用Excel整理各项指标的测定结果。所有的试验数据用SPSS software Ver.20.0(SPSS Inc.,Chicago,Illinois)的LSD(最小显著性差异法)进行差异显著性分析(<0.05),图表中各结果用平均值±标准差的形式表示。
2 结果
2.1 绿豆萌发过程各蛋白组分含量
图1显示了不同萌发时期绿豆分离蛋白含量的变化。随着萌发时间的延长,绿豆分离蛋白含量呈先升高后降低的趋势,萌发36 h时绿豆分离蛋白含量达到最高,为23.3×10-2g∙g-1,萌发96 h时其含量最小,为8.79×10-2g∙g-1,并且前36 h内绿豆分离蛋白含量变化无明显差异,与未萌发的绿豆相比,适当的萌发使绿豆分离蛋白的含量提高了9.4%,但是随着萌发时间的延长,绿豆分离蛋白含量逐渐下降,并且均小于未萌发的绿豆分离蛋白含量。因此,较长时间的萌发并不利于绿豆分离蛋白的积累。

图1 不同萌发时期绿豆分离蛋白含量变化
图2表示不同萌发时期绿豆各蛋白含量的变化。由图2-A可以看出,萌发过程中绿豆清蛋白含量为20.74—146.42 mg∙g-1,并且随着萌发时间的延长,绿豆清蛋白的含量逐渐降低,且在不同的萌发时期含量具有显著性差异(<0.05),在萌发0 h时其含量最大,为146.42 mg∙g-1,随着萌发时间的延长,在84 h时含量最小,为20.74 mg∙g-1。在萌发过程中,绿豆球蛋白含量20.74—92.83 mg∙g-1,随着萌发时间的延长,绿豆球蛋白的含量先升高后下降,且在不同的萌发时期含量具有显著性差异(<0.05),在0 h时含量最小,在萌发48 h时其含量为最大,且比未萌发时提高了3.47倍(图2-B)。萌发对绿豆醇溶蛋白的含量变化影响不大;萌发72 h时其含量最大,为2.62 mg∙g-1,在84 h时其含量最小,为1.93 mg∙g-1(图3-C)。绿豆谷蛋白含量在萌发12—36 h内和48—72 h内变化无显著性差异,但是整体上萌发过程提高了绿豆谷蛋白的含量(图3-D)。通过对绿豆分离蛋白、清蛋白以及球蛋白含量的比较和分析可知,清蛋白和球蛋白含量变化是引起绿豆分离蛋白含量变化的重要因素。
2.2 蛋白酶活性变化
图3所示为不同萌发时期绿豆蛋白酶活力变化。在绿豆种子整个萌发过程中蛋白酶活性总体呈上升的趋势。在萌发0—36 h期间,蛋白酶活性有所上升,但变化相对较小;萌发36 h后酶活性仍不断上升,变化相对较大。萌发72 h时活性趋势变化出现转折,蛋白酶活性开始下降。种子萌发过程中,蛋白酶被激活和释放,从结合态转化为游离态,这对萌发过程中绿豆内部代谢及贮藏蛋白的变化有重要作用[24]。
2.3 绿豆萌发蛋白质SDS-PAGE及亚基相对含量
2.3.1 绿豆分离蛋白SDS-PAGE分析 图4所示为不同萌发时期绿豆分离蛋白在非还原条件下进行SDS-PAGE电泳得到的电泳图谱。由图可知,绿豆分离蛋白主要由7条条带所组成(Ⅰ—Ⅶ)。随着萌发时间的不断延长,绿豆分离蛋白不同分子量的亚基含量发生变化,其中分子量在25—66 kD条带含量逐渐降低,条带变弱;而分子量在18—25 kD的亚基条带含量在萌发前60 h左右有所增加,条带加强,随着萌发时间的延长,所有的亚基条带都发生降解,含量减少,条带减弱,并且在萌发至96 h时几乎只剩下Ⅳ条带。

图2 不同萌发时期绿豆各蛋白含量变化

图3 不同萌发时期绿豆蛋白酶活力变化
采用光密度扫描分析电泳图结果见表1,不同萌发时期,绿豆分离蛋白组分存在差异。在萌发过程中,条带Ⅰ—Ⅶ的相对含量不断减少,分别为1.07%—0.26%、5.28%—0.53%、6.61%—1.0%、38.5%—15.7%、3.43%—1.02%、9.89%—1.42%及9.69%—2.67%,即萌发使分子量较大的组分发生降解,降解为小分子蛋白组分。这是由于萌发过程中蛋白水解酶活性提高,使蛋白发生了降解[25]。但分子量在18—25 kD的蛋白条带相对含量在萌发前72 h不断提高,条带加强,随着萌发时间的延长,小分子量的组分都会发生降解,最后几乎只剩Ⅳ条带。这些变化与萌发过程中理化性质的变化有一定的相关性。
2.3.2 绿豆清蛋白SDS-PAGE分析 图5所示为不同萌发时期绿豆清蛋白在非还原条件下进行SDS-PAGE电泳得到的电泳图谱。由图可知,绿豆清蛋白主要由4条条带所组成(Ⅰ—Ⅳ),分子量分别为61.56、48.99、29.88及20.42 kD。随着萌发时间的延长,绿豆清蛋白不同分子量的亚基含量发生变化,4条亚基含量逐渐降低,条带不断减弱,萌发至72 h时,有的条带消失,萌发至96 h几乎只剩下条带Ⅱ,同时从图谱中可以看出分子量为18—25 kD的亚基含量在萌发24—60 h有所增加,条带加强,但是在萌发后期也出现条带不断减弱直至消失,几乎只剩下条带Ⅱ。
采用光密度扫描分析电泳图结果见表2,由表可知,不同萌发时期的绿豆清蛋白多肽或亚基存在差异,相对含量为Ⅱ>Ⅰ>Ⅲ>Ⅳ。萌发过程中条带Ⅰ相对含量为从开始的18.4%降至60 h的16.4%,萌发72 h后条带Ⅰ消失,条带Ⅱ在萌发过程中始终存在,但是含量不断减少,相对含量从51.1%降至27.0%,条带Ⅲ和条带Ⅳ也在萌发过程中不断减少,至萌发72 h后消失,这与绿豆萌发过程中清蛋白含量减少相一致。同时,分子量在18—25 kD的亚基条带含量在24—60 h增加,可能是大分子多肽降解后形成小分子多肽条带,但是萌发至72 h后,这部分的亚基条带逐渐消失,几乎只剩下条带Ⅱ。
2.3.3 绿豆球蛋白SDS-PAGE分析 图6所示为不同萌发时期绿豆球蛋白在非还原条件下进行SDS-PAGE电泳得到的电泳图谱。在该条件下,绿豆球蛋白主要由5条条带所组成(Ⅰ—Ⅴ),分子量分别为66、61、50、32和26 kD。随着萌发时间的延长,绿豆球蛋白不同分子量的亚基含量发生变化,其中绿豆球蛋白亚基条带Ⅰ含量在萌发过程中逐渐下降且在萌发84 h后消失;萌发初期8S球蛋白Ⅲ亚基条带出现先增加后降低的趋势,这与球蛋白在萌发过程中的含量变化相一致,8S的其他亚基条带相对含量逐渐下降,甚至出现了条带消失,这是由于萌发过程中蛋白酶活性增加,使得大分子亚基或多肽出现降解。同时,在萌发24—60 h的18—25 kD小分子量亚基条带有所增加,但随着萌发时间的延长,小分子亚基也会出现降解甚至消失。这说明适当的萌发使大分子亚基发生水解,有利于小分子亚基或多肽生成。
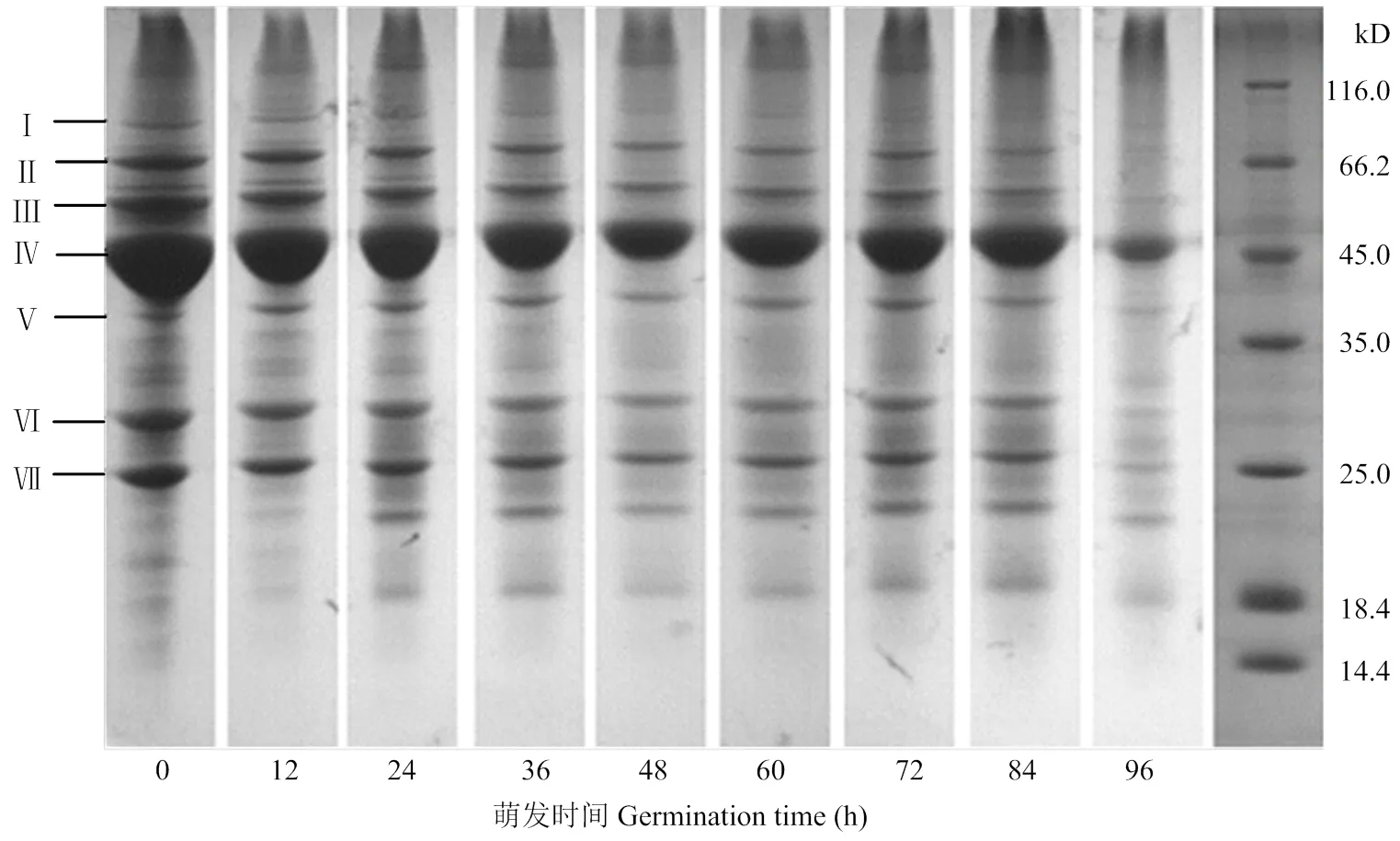
图4 不同萌发时期绿豆分离蛋白SDS-PAGE电泳图谱

表1 不同萌发时期绿豆分离蛋白组分相对含量

图5 不同萌发时期绿豆清蛋白SDS-PAGE电泳图谱

表2 不同萌发时期绿豆清蛋白亚基或多肽相对含量
采用光密度扫描分析电泳图如表3所示,萌发过程亚基条带Ⅰ含量为14.4%—1.45%,萌发至96 h时条带Ⅰ消失;萌发过程中条带Ⅱ相对含量为6.57%—3.36%,萌发至96 h时条带Ⅱ消失;而条带Ⅲ在萌发过程前期0—60 h时相对含量逐渐增大,为34.4%—41.8%,当萌发72 h后条带Ⅲ含量迅速下降,萌发至96 h时仅为10.8%;亚基条带Ⅳ和Ⅴ在萌发过程中的相对含量分别为5.80%—2.27%和9.60%—2.96%,萌发至84 h时,两条带消失。
3 讨论
3.1 绿豆萌发过程中各蛋白组分含量的变化
豆类种子萌发过程中蛋白酶、淀粉酶、植酸酶被激活,使得蛋白质、碳水化合物及脂肪等被降解,豆类的营养价值及功能特性得以提高[26]。大豆种子在整个萌发过程中蛋白酶的活性总体呈上升趋势,萌发0—39 h期间蛋白酶活性变化较小,萌发72 h后活性下降[27],与本研究中绿豆萌发过程中蛋白酶活性的变化一致。此外,研究发现鹰嘴豆[28]、小扁豆[29-30]和豌豆[31]种子在萌发过程中球蛋白含量都呈逐渐降解的趋势;银杏种子在整个萌发过程中,其球蛋白和清蛋白含量呈逐渐下降趋势,醇溶蛋白和谷蛋白含量变化幅度较小[32],这与本研究的结果基本一致。种子萌发过程中各蛋白组分降解成胚及幼苗生长所需的营养物质,释放能量用于营养物质的运输、细胞分裂、生长和分化,促进种子的萌发及幼苗形成[32]。前人在研究萌发过程中荞麦蛋白的变化时,发现萌发使荞麦的清蛋白减少,谷蛋白含量增加,这与绿豆的萌发过程蛋白质的动态变化有相似性,从营养角度看,蛋白组分的含量变化尤其是不易被人体消化的清蛋白减少,更有利于人体的吸收[33]。有研究表明,面筋蛋白的主要构成是醇溶蛋白和谷蛋白,而醇溶蛋白和谷蛋白含量在作物中的含量普遍较低,这是影响食品加工特性(黏弹)的重要因素[34]。绿豆萌发后蛋白质的含量及组分发生改变,这可能会有助于提高蛋白的加工特性。

图6 不同萌发时期绿豆球蛋白SDS-PAGE电泳图谱

表3 不同萌发时期绿豆球蛋白各组分亚基或多肽相对含量
3.2 绿豆萌发过程中分离蛋白亚基的变化
绿豆主要4种蛋白——清蛋白、球蛋白、谷蛋白、醇溶蛋白占绿豆蛋白的比例分别约为49.60%、23.58%、19.42%、7.47%,即绿豆蛋白主要以清蛋白和球蛋白为贮藏蛋白,这与前人关于豆类植物和许多双子叶植物中主要蛋白是清蛋白和球蛋白的研究结论一致[35-36]。在种子的萌发过程中不仅有胚的发育,体内贮藏蛋白也会分解和转化[37]。研究发现,豇豆萌发过程中的蛋白质条带数量呈下降趋势[38];大豆蛋白质随着萌发时间的延长,其大分子蛋白质逐渐消失[27];不同芸豆品种发芽过程中蛋白亚基变化的总体趋势是分子量越大的亚基越早消失,分子量越小的亚基越晚消失[39];此外,小麦[40]、豌豆[41]、花生[42]、玉米[43]等种子随着萌发时间的延长,其大分子的蛋白质亚基首先被降解,之后较小的蛋白质亚基开始降解,与本研究的结果一致。这一过程提高了蛋白质的功能特性,有助于消化。本研究中,通过绿豆分离蛋白的SDS-PAGE电泳图和组分含量变化表可知,绿豆分离蛋白的主要亚基有7种,分子量集中在45—66 kD及18—35 kD这两个区域,在萌发初期以大分子为主,变化较小,随着萌发时间的延长,几乎所有的蛋白条带和含量都发生变化,较大分子量的蛋白含量减小,有的甚至在萌发后期出现几乎快要消失的现象,小分子蛋白的含量有所上升,这与前人研究的萌发过程中少量的贮藏蛋白在有限的区域降解的观点相符[44]。
3.3 绿豆萌发过程中清蛋白亚基的变化
绿豆清蛋白中各类必需氨基酸含量较高,是相对于其他组分蛋白较为优质的蛋白,营养价值高。有研究表明,绿豆清蛋白主要含有6条蛋白分子条带,分别是136.88、61.56、48.99、29.88、25.66和20.42 kD,其中分子量为48.99 kD的条带较宽、颜色深,说明绿豆清蛋白以该亚基分子组分居多[45],这与本研究中基本一致。在本研究中,萌发初期即0—24 h条带Ⅱ含量变化较小,原因可能是大分子量蛋白的降解补充了该分子量蛋白降解的量,因此前期变化较小[27],同时条带Ⅱ在整个萌发过程中始终存在,但也是不断地减弱,与之相反的是一些小分子量的蛋白(14.4—35 kD)含量有所增加,但是在萌发后期都会发生降解,含量较少。绿豆清蛋白在体内的消化率较低,是较难消化的蛋白,可能是因为清蛋白对胃蛋白酶和胰蛋白酶不敏感,但是萌发后清蛋白含量下降,大分子蛋白被降解,会使绿豆清蛋白的消化率提高[46]。
3.4 绿豆萌发过程中球蛋白亚基的变化
绿豆球蛋白主要分为8S球蛋白和11S球蛋白,其中8S球蛋白占球蛋白总量的89%左右,分子量约为200 kD,共由4个多肽分子构成;而绿豆的11S球蛋白则与其他豆类的有所差异,含量较小,分子量约为360 kD,主要由40和24 kD两种亚基通过二硫键构成;另外,研究表明绿豆中还含有少量的碱性7S球蛋白,含量极小[1]。本研究与前人研究相一致。随着萌发时间的不断延长大分子蛋白条带Ⅰ和Ⅱ颜色变浅,宽度逐渐变窄,甚至在萌发至72 h开始慢慢消失,而条带Ⅲ则出现先增加后减少的趋势,可能是因为刚开始萌发时,大分子蛋白被分解成较小分子蛋白,补充了这部分蛋白分子的含量,因此刚开始有所增加,萌发48 h后会迅速降解,这是因为萌发时绿豆体内的酶活性增加,使蛋白分子降解。同时,一些小分子蛋白条带(14.4—25 kD)在萌发前60 h时不断增加,之后不断减少甚至消失。绿豆8S球蛋白中不含有二硫键,而11S球蛋白中含有二硫键,绿豆萌发时,11S球蛋白条带不断地减少,可能是由于萌发过程中,酶活性增加后使11S球蛋白的二硫键断裂,降解成41 kD和20 kD的亚基。
通过分析可知,绿豆分离蛋白与绿豆清蛋白和球蛋白电泳图变化相似,说明绿豆清蛋白和球蛋白是绿豆的主要贮藏蛋白,在萌发过程中分离蛋白的变化主要由清蛋白和球蛋白所引起,清蛋白SDS-PAGE电泳图亚基条带主要集中在45—66 kD和25—35 kD两个区域,球蛋白与其相似,这与杨继民[47]利用SDS-PAGE分离荞麦清蛋白、球蛋白、分离蛋白的结果一致。
4 结论
绿豆分离蛋白的含量随着萌发时间的延长呈现先增高后下降的趋势,清蛋白含量呈逐渐下降的趋势,球蛋白呈现先升高后下降的趋势,醇溶蛋白含量变化较小,谷蛋白含量有所增加。萌发不同时期蛋白的亚基条带存在差异,绿豆分离蛋白、清蛋白的大分子亚基条带(25—66.2 kD)在萌发过程中不断降解,含量不断减少,小分子亚基条带(18—25 kD)在萌发前期和中期含量不断增加;绿豆球蛋白在萌发过程中条带Ⅲ(50 kD)一直存在,呈现先增加后降低的趋势,其他与分离蛋白和清蛋白亚基变化一致,萌发后期大分子与小分子量蛋白含量继续减少甚至消失。综上所述,适当萌发可以提高绿豆蛋白的加工特性,有利于人体消化吸收,可加强绿豆蛋白功能性食品的开发与应用。
[1] MENDOZA E M, ADACHI M, BERNARDO A E, Utsumi S. Mung bean [(L.) Wilczek] globulins: purification and characterization., 2001, 49(3): 1552-1558.
[2] TOMOOKA N, LAIRUNGREANG C, NAKEERAKS P, EQAWA Y, THAVARASOOK C. Center of genetic diversity and dissemination pathways in mung bean deduced from seed protein electrophoresis., 1992, 83(3): 289-293.
[3] WOLF W J, BRIGGS D R. Ultracentrifugal investigation of the effect of neutral salts on the extraction of soybean proteins., 1956, 63(1): 40-49.
[4] SATTAR A, DURRANI S K, MAHMOOD F, AHMAD A, KHAN I.Effect of soaking and germination temperatures on selected nutrients and antinutrients of mung bean., 1989, 34(2): 111-120.
[5] 曾志红, 王强, 林伟静, 周素梅. 绿豆品质特性及加工利用研究概况. 作物杂志, 2011(4): 16-19.
ZENG Z H, WANG Q, LIN W J, ZHOU S M. Quality characteristics and utilization of mung bean., 2011(4): 16-19. (in Chinese)
[6] BENíTEZ V, CANTERA S, AGUILER Y, MOLLá E, ESTEBAN R M, DíAZ M F, MARTíN-CABREJAS M A. Impact of germination on starch, dietary fiber and physicochemical properties in non-conventional legumes., 2013, 50(1): 64-69.
[7] ELKHALIFA A E O, BERNHARDT R. Influence of grain germination on functional properties of sorghum flour., 2010, 121(2): 387-392.
[8] GHUMMAN A, KAUR A, SINGH N. Impact of germination on flour, protein and starch characteristics of lentil () and horsegram (L.) lines., 2016, 65: 137-144.
[9] STARZYńSKA-JANISZEWSKA A, STODOLAK B, MICKOWSKA B. The effect of germination on antioxidant and nutritional parameters of protein isolates from grass pea () seeds., 2010, 16(1): 73-77.
[10] LIU A J, YIN S W, LI L. Structure, trypsin inhibitor activity and functional properties of germinated soybean protein isolate., 2013, 49(3): 911-919.
[11] SAVELKOUL, F H M G, VAN DER POEL A F B, TAMMINGA S. The presence and inactivation of trypsin inhibitors, tannins, lectins and amylase inhibitors in legume seeds during germination: A review., 1992, 42(1): 71-85.
[12] WILSON K A, RIGHTMIRE B R, CHEN J C, TAN-WILSON A L. Differential proteolysis of glycinin and-conglycinin polypeptides during soybean germination and seedling growth., 1986, 82(1): 71-76.
[13] BAMDAD F, DOKHANI S, KERAMAT J. Functional assessment and subunit constitution of lentil () proteins during germination., 2009, 11(6): 690-694.
[14] 王素雅, 赵甲慧, 杨玉玲, 鞠兴荣. 发芽对大豆分离蛋白功能性质的影响. 食品科学, 2011, 32(23): 64-68.
WANG S Y, ZHAO J H, YANG Y L, JU X R. Effect of germination on functional properties of soybean protein isolate., 2011, 32(23): 64-68. (in Chinese)
[15] 刘红开. 乙烯对绿豆芽下胚轴生长代谢的调控效应研究[D]. 北京: 中国农业大学, 2014.
LIU H K. Research of ethylene in regulating growth and metabolism of mung bean sprouts hypocotyl [D]. Beijing: China Agricultural University, 2014. (in Chinese)
[16] Gan R Y, Wang M F, Liu W Y, Wu K, Corke H. Dynamic changes in phytochemical composition and antioxidant capacity in green and black mung bean () sprouts., 2016, 51(9): 2090-2098.
[17] 刘冬儿, 吕天喜. 绿豆分离蛋白的制备及其功能特性研究. 粮食与食品工业, 2007, 14(2): 27-30.
LIU D R, LV T X. Study on preparation and functional characteristics of mung bean protein isolate., 2007, 14(2): 27-30. (in Chinese)
[18] 乔宁, 张坤生, 任云霞. 绿豆中四种蛋白质的分级提取与功能性质研究. 食品工业科技, 2014, 35(17): 83-87.
QIAO N, ZHANG K S, REN Y X. Extraction and function properties of four proteins from mung bean., 2014, 35(17): 83-87. (in Chinese)
[19] 张敏, 周梅, 王长远. 米糠4种蛋白质的提取与功能性质. 食品科学, 2013, 34(1): 18-19.
ZHANG M, ZHOU M, WANG C Y. Extraction and functional properties of four proteins from rice bran., 2013, 34(1): 18-19. (in Chinese)
[20] 乔宁. 绿豆() 蛋白的提取及其功能性质研究[D]. 天津: 天津商业大学, 2014.
QIAO N. Researches on the extraction and properties of mung bean protein [D]. Tianjin: Tianjin University of Commerce, 2014. (in Chinese)
[21] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding., 1976, 72: 248-254.
[22] 凌猛, 祖国仁, 赵长新. 不同发芽条件下日本大米酶活力及水溶性蛋白变化规律的研究. 食品工业科技, 2011, 32(5): 129-131.
LING M, ZU G R, ZHAO C X. Study on the change of the enzyme and water-soluble protein of Japanese rice under different germinating condition., 2011, 32(5): 129-131. (in Chinese)
[23] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4., 1970, 227: 681-685.
[24] Evans D J, Taylor J R N. Extraction and assay of proteolytic activities in sorghum malt., 1990, 96(4): 201-207.
[25] YANG M, LI L, PANDEY A, LARROCHE C, SOCCOL C R. Physicochemical, textural and sensory characteristics of probiotic soy yogurt prepared from germinated soybean., 2010, 48(4): 490-496.
[26] TAYLOR J R N, NOVELLIE L, LIEBENBERG N W. Protein body degradation in the starchy endosperm of germinating sorghum., 1985, 36(169): 1287-1295.
[27] 李淑艳. 萌发过程大豆蛋白质动态变化及营养价值的研究[D]. 北京: 北京林业大学, 2009.
LI S Y. Dynamic analysis on soybean seed [(L.) Meer.] proteins and nutrition during germination [D]. Beijing: Beijing Forestry University, 2009. (in Chinese)
[28] NEVES V A, LOURENçO E J. Changes in protein, trypsin inhibitor and proteolytic activity cotyledons of germinating chickpea., 2001, 51(3): 269 -275.
[29] FERNANDEZ J A, GUERRA H. Biochemical and morphological changes in protein bodies during germination of lentil seeds., 1985, 36: 1296-1303.
[30] GUERRA H, NICOLláS G. Changes in nitrogen fraction and proteolytic activities in the cotyledons of germinating lentils., 1983, 39(3): 277-282.
[31] NIELSEN S S, LIENER I E. Degradation of the major storage protein ofduring germination., 1984, 74: 494-498.
[32] 李生平. 银杏种子萌发过程中贮藏物质代谢机理的研究[D]. 南京林业大学, 2004.
Li S P. Studies on mechanism of storage substance metabolize of gingko biloba seeds during germination [D]. Nanjing: Nanjing Forestry University, 2004. (in Chinese)
[33] 张美莉. 萌发荞麦种子内黄酮与蛋白质的动态变化及抗氧化性研究[D]. 北京: 中国农业大学, 2004.
ZHANG M L. Study on dynamic changes of flavonoids and proteins and antioxidant activities of germinated buckwheat seeds [D]. Beijing: China Agricultural University, 2004. (in Chinese)
[34] 朱新产, 王宝维, 魏益民. 荞麦种子蛋白组分差异研究. 种子, 2000(6): 9-10.
ZHU X C, WANG B W, WEI Y M. Study on the changes of seed protein components in buckwheat grain., 2000(6): 9-10. (in Chinese)
[35] 石建斌, 候万伟, 刘玉皎. 蚕豆种子贮藏蛋白质组分的比较研究. 植物遗传资源学报, 2012, 13(2): 304-307.
SHI J B, HOU W W, LIU Y J. Comparative study on seed storage protein of faba bean., 2012, 13(2): 304-307. (in Chinese)
[36] 徐向东. 豆类(小红豆、大红豆和荷包豆)淀粉和蛋白质性质的研究[D]. 广州: 华南理工大学, 2010.
XU X D. Studies on the properties of starches and proteins in beans (small rea bean, large red bean and scarlet runner bean) [D]. Guangzhou: South China University of Technology, 2010. (in Chinese)
[37] 徐晓燕, 郑蕊, 李春梅, 盖钧镒, 喻德跃. 大豆种子萌发过程中的差异蛋白质组研究. 生物化学与生物物理进展, 2006, 33(11): 1106-1112.
XU X Y, ZHENG R, LI C M, GAI J Y, YU D Y. Differential proteomic analysis of seed germination in soybean., 2006, 33(11): 1106-1112. (in Chinese)
[38] 陈禅友, 汪仕斗, 潘磊, 胡耀军, 丁毅. 豇豆种子萌发进程中蛋白质组分的时空变化. 江汉大学学报(自然科学版), 2006, 34(3): 60-65.
CHEN C Y, WANG S D, PAN L, HU Y J, DING Y. Changes of protein components in different positions and stages of germination in yardlong bean ((L.) Fruhw.)., 2006, 34(3): 60-65. (in Chinese)
[39] 党根友, 冯佰利, 高小丽, 高金峰, 高冬丽, 柴岩. 芸豆种子蛋白组分及其在种子萌发过程中的变化. 华北农学报, 2008, 23(5): 85-88.
DANG G Y, FENG B Y, GAO X L, GAO J F, GAO D L, CHAI Y. Protein pattern of kidney bean seed and changes during kidney bean seed germination., 2008, 23(5): 85-88. (in Chinese)
[40] 李延红, 张华, 韩卓, 陈晓燕, 孙汉巨. 小麦萌发过程中蛋白亚基的消长规律. 农产品加工(学刊), 2013, 7: 61-63.
LI Y H, ZHANG H, HAN Z, CHEN X Y, SUN H J. Dynamic of protein subunits on wheat germination process., 2013, 7: 61-63. (in Chinese)
[41] BASHA S M M, BEEVERS L. The development of proteolytic activity and protein degradation during the germination ofL., 1975, 124: 77-87.
[42] 黄上志, 傅家瑞. 花生种子贮藏蛋白与活力的关系及其在萌发时的降解模式. 植物学报, 1992, 34(7): 543-550.
HUANG S Z, FU J R. The relation of storage protein to vigor and its mobilization pattern in germinating peanut seeds., 1992, 34(7): 543-550. (in Chinese)
[43] 韩春然. 玉米萌发过程中蛋白酶的活力和蛋白质含量的研究. 食品科学, 2007, 28(1): 209-212.
HAN C R. Study on proteinase activity and protein content in corn during germination,, 2007, 28(1): 209-212. (in Chinese)
[44] MüNTZ K, BELOZERSKEY M A, DUNAEVSKY Y E, SCHLERETH A, TIEDEMANN J. Stored proteinases and the initiation of storage protein mobilization in seeds during germination and seedling growth., 2001, 52(362): 1741-1752.
[45] 李永武. 绿豆清蛋白的提取及其功能特性和理化性质研究[D]. 黑龙江: 黑龙江八一龙垦大学, 2014.
Li Y W. Study on Extraction of mung bean albumin and their functional and physico-chemical property [D]. Heilongjiang: Heilongjiang Bayi Agricultural University, 2014. (in Chinese)
[46] IKEDA K, SAKAGUCHI T, KUSANO T, YASUMOTO K. Endogenous factors affecting protein digestibility in buckwheat., 1991, 68(4): 424-427.
[47] 杨继民, 郭柏寿, 陈鹏. 荞麦种子蛋白质研究. 陕西农业科学, 2001(9): 4-6.
YANG J M, GUO B S, CHEN P. Study on protein of buckwheat seed., 2001(9): 4-6. (in Chinese)
(责任编辑 赵伶俐)
The Changes of Protein Components and Subunits in Process of Mung Bean Germination
ZHAO TianYao1, ZHANG YaHong1, JIN Tao2, KANG YuFan1
(1College of Agronomy, China Agricultural University, Beijing 100193;2Engineering Research Center of Ecology and Agricultural use of Wetland, Ministry of Education/Hubei Key Laboratory of waterlogging disaster and wetland agriculture, Jingzhou 434025, Hubei)
【Objective】In order to provide the scientific basis for processing and utilization of mung bean protein, the dynamic changes of mung bean isolated protein, albumin, globulin, gluten and gliadin in different germination stages were investigated.【Method】The isolated protein of mung bean were extracted by isoelectric point precipitation method, and the albumin, gluten, globulin and gliadin of mung bean were prepared according to Osborne classification. The content of each kind of proteins and the activity of protease were determined in different germination period. The changes of composition and quantity of protein subunit before and after germination were further analyzed by SDS-PAGE electrophoresis.【Result】With the extension of germination time, the contents of mung bean isolated protein increased first and then decreased. The mung bean isolated protein was increased by 9.4% compared to non-germinated mung bean. The mung bean albumin content was decreased after the germination, which the minimum value was 20.47 mg∙g-1. The globulin content was increased first and then decreased with the increasing of germination time, with the minimum was observed at 0 h and the highest at 48 h after germination. However, the gliadin content was not influenced by the germination. There was no significant difference in the gluten content of mung bean between the 12-36 h and 48-72 h germination, but the content is still higher than non-germinated seed. Mung bean protease activity increased within 36 h germination, and began to decline at 72 h. Analysis of SDS-PAGE electrophoresis and optical density scanning results showed that there were 7 bands (Ⅰ-Ⅶ) in the mung bean isolated protein, and the relative content of each band decreased continuously. After the germination, the molecular weight of 25 kD to 66 kD proteins gradually decreased. The content of 18 kD and 25 kD isolated proteins increased within 72 h germination, and almost only remained Ⅳ after 96 h of germination. Mung bean albumin mainly consisted of four bands (Ⅰ-Ⅳ) with molecular weights of 61.56, 48.99, 29.88 and 20.42 kD, respectively. During the germination process, the relative content of Band I decreased from 18.4% at 0 h to 16.4% at 60 h, and disappeared at 72 h after germination. Although the Band II existed during the whole germination, the relative content of Band II was decreased continuously from 51.1% to 27.0%. Bands Ⅲ and Ⅳ decreased continuously with the germination, and disappeared after 72 h of germination. What’s more, the relative contents of subunit bands with a molecular weight of 18-25 kD increased at 24-60 h and disappeared after 72 h of germination. Mung bean globulin mainly consists of five bands (Ⅰ-Ⅴ) with molecular weights of 66, 61, 50, 32 and 26 kD, respectively. The relative content of subunit bands I and II were disappeared after 96 h of germination. While the relative content of band Ⅲ increased gradually from 34.4% to 41.8% during 0 to 60 h of early stage of germination. Then the band Ⅲ content decreased rapidly after 72 h of germination and measured only 10.8% at 96 h. In the meantime, the relative contents of subunit Band Ⅳ and Ⅴ was not observed after 84 h germination. Subunit bands with a molecular weight of 18-25 kD increased during 24 to 60 h of germination, and then degraded or even disappeared with the germination process.【Conclusion】Appropriate germination not only increase the content of mung bean proteins and promote the hydrolysis of macromolecular subunits, but also facilitates the formation of small molecule subunits or polypeptides.
mung bean; germination; protein component; subunit
10.3864/j.issn.0578-1752.2018.09.015
2017-11-10;
2018-01-04
国家现代农业(食用豆)产业技术体系建设专项(CARS-08-07B)
赵天瑶,E-mail:zhaotianyao123@163.com。
康玉凡,E-mail:yfkang@cau.edu.cn

