蓝塘猪和长白猪骨骼肌差异表达cis-NATs基因鉴定
许月园,齐晓龙,候晔,赵云霞,栾宇,周焕焕,赵书红,2,李新云,2,3
蓝塘猪和长白猪骨骼肌差异表达-NATs基因鉴定
许月园1,齐晓龙1,候晔1,赵云霞1,栾宇1,周焕焕1,赵书红1,2,李新云1,2,3
(1华中农业大学农业动物遗传育种与繁殖教育部重点实验室,武汉 430070;2生猪健康养殖协同创新中心,武汉 430070;3农业部猪健康养殖重点实验室,广西扬翔股份有限公司,广西贵港 537100)
【目的】通过分析蓝塘猪和长白猪生长发育过程中品种间骨骼肌组织差异表达基因及顺式天然反义转录本(-natural antisense transcripts,-NATs),并以此为基础进行整合分析,探索-NATs调控猪骨骼肌生长发育的分子机理。【方法】使用差异表达分析鉴定蓝塘猪和长白猪胚胎期35 d至出生后180 d共10个时间点品种间差异表达基因及-NATs(|log2FC|≥1且 FDR<0.01);然后通过功能富集分析注释出差异表达基因及-NATs对应的正义基因主要参与的GO生物学过程(<0.01)及KEGG通路(<0.05);再根据与-NATs相关表达的基因数目筛选出-NATs主要参与的GO生物学过程和KEGG通路,并根据通路间的相同基因数目对所有KEGG通路进行整合;最后基于通路内-NATs及其正义基因在品种间的差异表达倍数进行通路可视化分析。【结果】在蓝塘和长白猪骨骼肌发育的10个时间点共鉴定出5 350个品种间差异表达基因和738个差异表达-NATs;GO分析结果显示品种间骨骼肌组织差异表达-NATs主要与肌肉发育及能量代谢等GO生物学过程中的基因相关表达;KEGG通路整合分析发现能量代谢通路之间关联性最强;其中线粒体三羧酸循环通路中基因及其相关表达的-NATs在仔猪出生后早期表达量较高;通路可视化分析发现在肌纤维生长的两个关键时间点即胚胎期49 d和77 d,蓝塘猪能量代谢相关通路中基因及其相关表达的-NATs显著高表达于长白猪,而出生后品种间表达模式的变化则主要集中在出生后2—90 d的出生后早期阶段。【结论】在蓝塘猪和长白猪骨骼肌发育的10个时间点,共鉴定出738个品种间差异表达的NATs,功能注释结果表明这些-NATs主要通过与能量代谢通路中的基因相关表达从而参与影响蓝塘猪和长白猪品种间骨骼肌纤维发育差异。
蓝塘猪;长白猪;顺势天然反义转录本;差异表达;能量代谢
0 引言
【研究意义】天然反义转录本(natural antisense transcripts,NATs)是一类内源性转录的可以与其他RNA转录本互补配对的RNA[1],它既可以是编码蛋白的RNA,也可以是非编码的RNA。NATs根据其转录来源可以分为顺式NATs(-NATs)和反式NATs(trans-NATs)[2]。-NATs转录自基因的互补链而trans-NATs从基因组其他位置转录。研究表明NATs在人、鼠、猪、酵母和拟南芥等真核生物组织中均广泛存在[3-4]。由此可见-NATs是基因表达调控的重要因素,本研究的意义在于通过对不同品种猪背最长肌组织中-NATs的研究进一步解析猪骨骼肌生长发育的分子机理。【前人研究进展】骨骼肌占哺乳动物总体重的50%左右[5]。研究发现骨骼肌发育过程中的多个关键基因都存在-NATs。Braunschweig等研究指出与其-NATs在猪的肌肉组织中协同表达[6]。Sun等在猪的肌肉和肝脏等多个组织中均检测到了的天然反义转录基因,在肌纤维的生长发育过程中两者呈相反表达[7]。Pandorf等发现大鼠MHC基因簇的-NATs分别与1和2协同表达和相反表达[8],从而影响骨骼肌的肌纤维类型。Chen等在全基因组水平上对猪的-NATs进行了研究,该研究表明猪骨骼肌中约30%的转录本具有-NATs[4]。NATs主要参与其正义基因转录水平和转录后水平的调控,目前已报道的调控机制主要包括:转录干扰[9]、RNA封闭[10]、RNA编辑[11]、RNA干扰[12]、染色质重塑[13-14]和兼并异染色质机制[15]。【本研究切入点】猪骨骼肌的生长发育与其生长速度和瘦肉率息息相关,直接关系着生猪养殖的生产效益。中外猪种在生长速度和瘦肉率性状上具有明显的遗传差异,长白猪作为高度选育的瘦肉型外国猪种,具有生长快,瘦肉率高等特点,而中国地方猪种蓝塘猪的胴体瘦肉率相对较低,生长速度也相对较慢[16]。因此,以蓝塘猪和长白猪作为试验对象来探索-NATs与不同猪品种骨骼肌发育差异的关系,有助于进一步了解瘦肉型猪和肥胖型猪之间骨骼肌生长发育遗传差异的分子机制。虽然多项研究成果表明-NATs广泛存在于猪的骨骼肌中,但是-NATs在中外猪种骨骼肌生长发育过程中是否存在差异以及其所参与的生物学过程和代谢通路仍有待于研究。【拟解决的关键问题】运用生物信息学分析手段,系统比较多个时间点蓝塘猪和长白猪骨骼肌组织中差异表达-NATs,并以此为基础利用- NATs与相关表达的正义基因进行功能聚类分析,探索-NATs参与蓝塘猪和长白猪生长发育过程中品种间骨骼肌发育差异的分子机理。
1 材料与方法
试验于2017年5—8月在华中农业大学农业动物遗传育种与繁殖教育部重点实验室、生猪健康养殖协同创新中心进行。
1.1 试验材料
本试验中表达谱及-NATs数据[17-18]来自于笔者已发表的长白猪和蓝塘猪的背最长肌组织基因表达谱及-NATs表达谱数据。该套数据共有10个发育时期,分别为胚胎期35 d、胚胎期49 d、胚胎期63 d、胚胎期77 d、胚胎期91 d、生后期2 d、生后期28 d、生后期90 d、生后期120 d及生后期180 d。本研究基于本实验室前期已发表的已注释基因表达、-NATs表达及相关数据,进一步探索了品种间基因表达及-NATs差异及相关功能。
1.2 试验方法
1.2.1 差异表达分析 本研究使用edger R语言包[19]鉴定蓝塘猪和长白猪两品种间差异表达的-NATs及基因,差异表达的阈值为|log2FC|≥1且FDR<0.01。
1.2.2 功能注释分析 为了解析两品种间差异表达-NATs的生物学功能,我们首先运用DAVID[20]对两品种的差异表达基因及差异表达-NATs对应的正义基因进行了GO分析和KEGG分析。筛选GO生物学过程和KEGG通路的阈值分别为<0.01和<0.05。然后,利用-NATs与其对应的正义基因表达相关(|R|>0.70且FDR<0.05)进一步筛选-NATs显著富集(-NATs个数大于10个)的GO生物学过程。同时,运用Cytoscape[21]对显著富集的KEGG通路(<0.05)进行整合分析,根据每个通路所包含的有相关表达的-NATs的基因数目填充节点颜色,以通路间共有的基因数目填充线的宽度,最后结合节点的颜色和线的宽度将代谢通路进行归类。
1.2.3 通路可视化分析 根据 KEGG通路整合分析对联系最紧密的模块进行了通路可视化分析,并用Cystoscape软件进行了绘图。首先,过滤掉通路中没有表达量的基因节点;然后根据各通路间的连接节点合并通路;进一步根据表达相关添加-NATs节点;用表达差异倍数填充节点颜色。
2 结果
2.1 猪骨骼肌生长发育过程中共有5 350个基因和738个cis-NATs在蓝塘猪与长白猪两品种间差异表达
根据10个时间点猪骨骼肌组织基因和-NATs表达谱,在蓝塘猪与长白猪两品种间进行差异表达分析,共鉴定出5 350个差异表达基因和738个差异表达-NATs(| log2FC |≥1,FDR<0.01)。各个时间点差异表达基因及-NATs数目如表1所示;出生后早期2—90 d,蓝塘猪和长白猪之间的差异表达基因及-NATs数目相对出生前明显下降(表1);MAplot显示品种间-NATs差异表达倍数分布类似于正义基因的差异表达倍数分布(图1)。各时间点差异倍数前十(5个蓝塘猪上调表达和5个蓝塘猪下调表达)的差异表达基因及-NATs如表2所示。

图1 蓝塘猪和长白猪差异表达基因及差异表达cis-NATs MAplot图
2.2 品种间骨骼肌组织差异表达cis-NATs主要富集在骨骼肌发育及能量代谢的GO生物学过程中
利用DAVID功能注释平台对差异表达-NATs及相关正义基因进行功能注释分析,结合表达相关性分析结果发现包含10个以上差异表达-NATs的正义基因的GO生物学过程有两类,第一类是肌肉发育,包含肌肉收缩(muscle contraction)、肌肉器官发育(muscle organ development)、骨骼肌细胞分化(skeletal muscle cell differentiation)和横纹肌收缩(striated muscle contraction)等11个GO生物学过程;第二类是能量代谢,主要包括糖酵解过程(glycolytic process)、糖异生(gluconeogenesis)、氢离子跨膜运输(hydrogen ion transmembrane transport)和ATP生物合成过程(ATP biosynthetic process)等6个GO生物学过程(表3)。
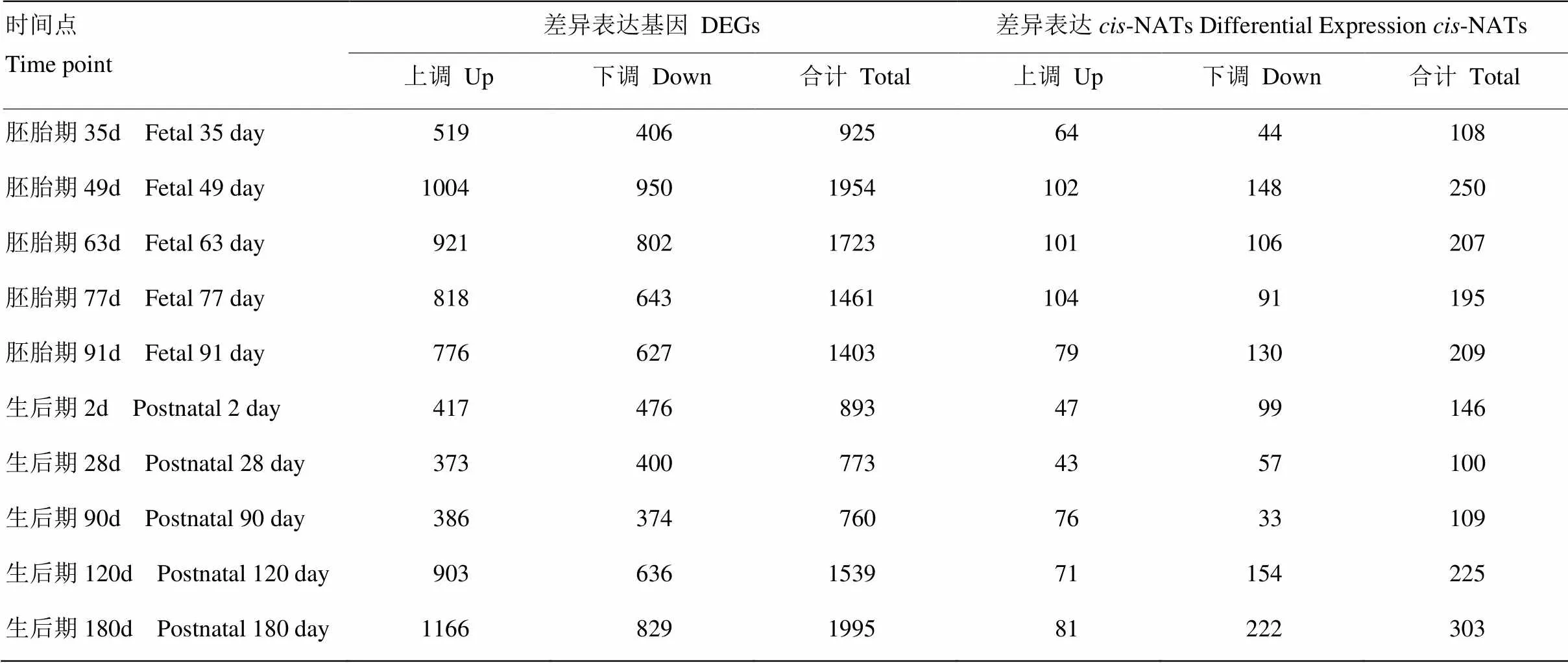
表1 蓝塘猪和长白猪差异表达基因及差异表达cis-NATs数目统计
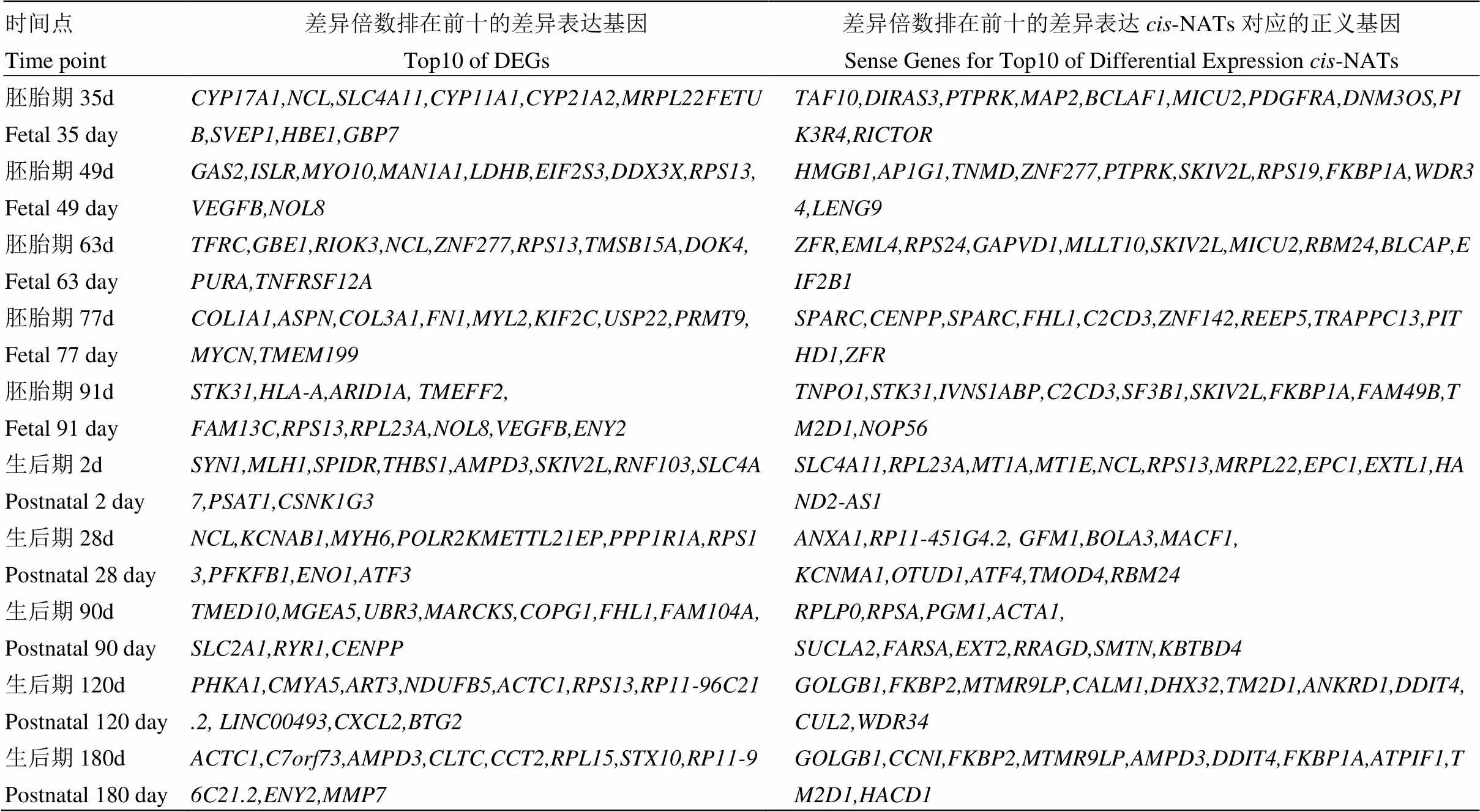
表2 骨骼肌发育过程中蓝塘猪与长白猪排在前10的差异表达基因及cis-NATs
2.3 KEGG通路整合分析发现能量代谢通路之间关联性最强
利用Cytoscape软件根据KEGG通路间相同基因的数目进行归类,最终将通路分为三大类:能量代谢相关通路、肌肉生长发育相关通路及其他。其中能量代谢相关通路包括糖酵解/糖异生、三羧酸循环及氧化磷酸化等,肌肉生长发育相关的通路则有心肌收缩、肥厚性心肌病及扩张型心肌病等(图2)。进一步分析显示能量代谢相关的通路之间相同数目基因较多,关系更紧密。
2.4 线粒体中三羧酸循环通路的cis-NATs及基因在仔猪出生后早期表达量更高
根据通路整合结果筛选出线粒体中三羧酸循环代谢通路的差异表达基因及其相关表达的-NATs,利用perl语言提取这些基因在长白猪和蓝塘猪10个时间点的表达量,使用R语言pheatmap包绘制热图(图3)。在胚胎期,蓝塘猪的线粒体中三羧酸循环通路的基因及-NATs表达量整体稍高于长白猪。仔猪出生后,基因及-NATs的表达量显著上升。在出生后2 d,长白猪的表达量普遍高于蓝塘猪。到第28天时大部分基因及-NATs表达量出现反转,蓝塘猪的表达量更高。在第90天时,蓝塘猪和长白猪的表达量都有所下降。第120天和180天两个时间点的差别不大,整体上都是蓝塘猪稍高于长白猪。

表3 包含10个以上差异表达cis-NATs的GO生物学过程
F代表胚胎期,P代表生后期 F means fetal stage, and P indicates postnatal stage

节点颜色的深浅代表通路中包含有相关表达的cis-NATs的基因数目;线的宽度代表节点间所含相同基因的数目;有相关表达的cis-NATs的基因数目小于3的通路用“”表示;其余则用“”表示

LD代表长白猪;LT代表蓝塘猪 LD means Landrace and LT means Lantang
2.5 通路可视化分析发现cis-NATs在品种间的差异表达具有时效性
根据不同KEGG通路之间的节点基因合并能量代谢相关通路,结合通路中的基因和-NATs的表达量以及两者在中外猪种间的差异表达倍数,绘制出生后不同时期的能量代谢通路。在胚胎期第49天和胚胎期第77天蓝塘猪的基因及-NATs的表达量显著高于长白猪,其中,胚胎期第49天蓝塘猪和长白猪能量代谢通路中相关基因及其-NATs的差异表达情况如图4-A所示。仔猪出生后第2天,蓝塘猪与能量代谢相关的通路中基因及-NATs的表达量显著低于长白猪(图4-B)。生后期28 d,蓝塘猪的表达量明显上升,大部分基因及-NATs的表达量高于长白猪(图5-A),而生后期90 d,蓝塘猪糖酵解通路及氧化磷酸化通路中基因及-NATs的表达量相对于长白猪显著下调(图5-B)。图4和图5说明-NATs在品种间的差异表达具有时效性,不同时间点上蓝塘猪和长白猪的差异表达情况有所不同。
3 讨论
3.1 cis-NATs差异表达分析
目前关于骨骼肌中-NATs的研究主要集中于鉴定、发育过程中表达模式及与其正义基因间表达关系等方面,不同猪种-NATs表达模式的比较却鲜有研究。因此品种间-NATs的差异表达模式是否影响猪骨骼肌生长发育过程仍有待于研究。长白猪和蓝塘猪在肌肉生长发育方面存在较大差异,前人研究发现两品种间肌纤维数目及横截面积都存在差异[17, 22],中外猪种肌纤维类型也有较大差异[23]。本研究通过对胚胎期至成年共10个时间点的长白猪和蓝塘猪骨骼肌组织中差异表达的-NATs进行分析,总共鉴定出738个差异表达-NATs。为了研究这些-NATs的生物学功能,本研究首先对差异表达的基因及-NATs对应的基因进行了功能聚类分析,并在此基础上筛选出包含有显著相关表达的-NATs的正义基因显著富集的GO生物学过程和KEGG通路,以此来推断猪骨骼肌生长发育过程中蓝塘猪和长白猪间差异表达-NATs参与的主要通路,解析-NATs调控品种间骨骼肌发育差异的分子机理。
3.2 功能注释及通路可视化
GO分析结果显示,蓝塘猪和长白猪的差异表达基因及其相关表达的-NATs富集在与肌肉生长发育及能量代谢相关的生物学过程中。由于能量代谢相关KEGG通路之间的关联性更为紧密(图2),因此本研究对蓝塘猪和长白猪之间能量代谢相关通路进行了进一步的比较及可视化分析。能量代谢通路可视化分析结果显示:胚胎期49 d和77 d时蓝塘猪的-NATs的表达量显著高于长白猪(图4-A)。已有研究显示猪在出生前肌纤维数量已经基本确定[24],胚胎期第49和77天分别处于猪初级肌管和次级肌管增殖的高峰期内,初级肌管和次级肌管分别发育成为初级肌纤维和次级肌纤维,研究表明长白猪的次级肌纤维数目多于蓝塘猪,长白猪在胚胎期生肌速度更快[17],这暗示-NATs可能参与猪胚胎期肌纤维的生长调控。此外,本研究统计结果显示:与能量代谢相关的生物学过程中差异表达的-NATs主要富集在生后期而胚胎期较少(表3),且三羧酸循环通路中的基因及-NATs在蓝塘猪和长白猪的生后期表达量也都显著高于胚胎期(图3),这可能与仔猪在出生后能量代谢较为旺盛有关。
猪在出生后骨骼肌发育主要是肌纤维类型的转变,肌纤维根据收缩功能和所含酶系及活性可以划分为四种类型:慢收缩氧化型(I型)、快收缩氧化型(IIa型)、中间型(IIx型)和快收缩酵解型(IIb型)[25]。I型肌纤维富含线粒体,有氧代谢的酶系活性很高,主要通过有氧代谢供能,纤维细小、收缩慢而持久;IIb型肌纤维含少量线粒体,糖酵解酶系和ATP酶活性较高,主要进行厌氧代谢,纤维粗大、收缩快但不持久;IIa型和IIx型肌纤维的特征介于I 型和IIb型之间[26]。刚出生的仔猪肌纤维类型是氧化型,有氧代谢占主导[27]。猪骨骼肌肌纤维类型的分化主要发生在出生后早期,从出生开始部分氧化型(I型)肌纤维逐渐转化成酵解型(II型)肌纤维,即I型肌纤维数目开始下降,II型肌纤维开始出现并逐渐增加[28]。在出生后早期这一转化就会完成,且肌纤维类型比例基本确定[29-31]。本研究发现在出生后早期,蓝塘猪和长白猪的差异表达模式在28 d和90 d发生了两次转变:在生后期2 d,蓝塘猪与能量代谢相关的通路中基因及其相关表达的-NATs的表达量显著低于长白猪(图4-B),到生后期28 d发生转变(图5-A)。而生后期90 d时再次发生反转,与生后期2 d类似,蓝塘猪的能量代谢相关通路中基因及其相关表达的-NATs相对于长白猪显著下调(图5-B)。研究表明长白猪较中国地方猪种拥有更多的酵解型肌纤维[23]。与本研究相对应的发育时间点的研究表明,长白猪能量代谢相关通路中的基因及其相关表达的-NATs在生后期2 d到28 d间发生剧烈下调并一直持续到90 d,而蓝塘猪类似的下调则晚于长白猪[18]。这表明长白猪的肌纤维类型转化可能早于蓝塘猪,并且这种差异与品种间差异表达的-NATs相关。因此推测蓝塘猪和长白猪出生后NATs的差异表达与两品种猪肌纤维类型的转变调控相关。

A. 胚胎期49 d时蓝塘猪长白猪的对比Fetal 49 day LT vs. LD;B. 生后期2 d时蓝塘猪与长白猪的对比Postnatal 2 day LT vs. LD

A.生后期28 d时蓝塘猪与长白猪的对比Postnatal 28 day LT vs. LD;B.生后期90 d时蓝塘猪与长白猪的对比Postnatal 90 day LT vs. LD
4 结论
在蓝塘猪和长白猪两品种背最长肌中总共筛选了5 350个差异表达基因和738个差异表达-NATs。功能分析结果表明品种间差异表达基因及-NATs主要富集到与肌肉生长发育和能量代谢相关的通路中。通过可视化分析结果显示-NATs参与猪骨骼肌组织中能量代谢相关基因的表达调控,这可能是导致品种间骨骼肌纤维数目及类型差异的原因之一。
[1] OSATO N, SUZUKI Y, IKEO K, GOJOBORI T. Transcriptional interferences in cis natural antisense transcripts of humans and mice., 2007, 176(2): 1299-1306. DOI: 10.1534/genetics.106. 069484.
[2] CHEN J, SUN M, KENT W J, HUANG X, XIE H, WANG W, ZHOU G, SHI R Z, ROWLEY J D. Over 20% of human transcripts might form sense-antisense pairs., 2004, 32(16): 4812-4820. DOI: 10.1093/nar/gkh818.
[3] VANHÉE-BROSSOLLET C, VAQUERO C. Do natural antisense transcripts make sense in eukaryotes., 1998, 211(1): 1-9.
[4] CHEN C, WEI R, QIAO R, REN J, YANG H, LIU C, HUANG L. A genome-wide investigation of expression characteristics of natural antisense transcripts in liver and muscle samples of pigs., 2012, 7(12): e52433. DOI: 10.1371/journal.pone.0052433.
[5] ZHANG J, ZHOU C, MA J, CHEN L, JIANG A, ZHU L, SHUAI S, WANG J, LI M, LI X. Breed, sex and anatomical location-specific gene expression profiling of the porcine skeletal muscles., 2013, 14:53. DOI: 10.1186/1471-2156-14-53.
[6] BRAUNSCHWEIG M H, VAN LAERE A S, BUYS N, ANDERSSON L, ANDERSSON G. IGF2 antisense transcript expression in porcine postnatal muscle is affected by a quantitative trait nucleotide in intron 3., 2004, 84(6): 1021-1029.
[7] SUN L, YU S, WANG H, FAN B, LIU B. NUDT6, the FGF-2's antisense gene, showed associations with fat deposition related traits in pigs., 2012, 39(4): 4119-4126. DOI: 10.1007/s11033-011-1194-3.
[8] PANDORF C E, HADDAD F, ROY R R, QIN A X, EDGERTON V R, BALDWIN K M. Dynamics of myosin heavy chain gene regulation in slow skeletal muscle: role of natural antisense RNA.2006, 281(50): 38330-42. DOI: 10.1074/jbc. M607249200.
[9] PRESCOTT E M, PROUDFOOT N J. Transcriptional collision between convergent genes in budding yeast., 2002, 99(13): 8796-8801. DOI: 10.1073/pnas.132270899.
[10] BELTRAN M, PUIG I, PENA C, GARCIA J M, ALVAREZ A B, PENA R, BONILLA F, DE HERREROS A G. A natural antisense transcript regulates Zeb2/Sip1 gene expression during Snail1-induced epithelial-mesenchymal transition., 2008, 22(6): 756-769. DOI: 10.1101/gad.455708.
[11] BASS B L. RNA editing by adenosine deaminases that act on RNA.2002, 71:817-846. DOI: 10.1146/ annurev.biochem.71.110601.135501.
[12] ROBB G B, CARSON A R, TAI S C, FISH J E, SINGH S, YAMADA T, SCHERER S W, NAKABAYASHI K, MARSDEN P A. Post-transcriptional regulation of endothelial nitric-oxide synthase by an overlapping antisense mRNA transcript., 2004, 279(36): 37982-37996. DOI: 10.1074/jbc.M400271200.
[13] SCHEELE C, PETROVIC N, FAGHIHI M A, LASSMANN T, FREDRIKSSON K, ROOYACKERS O, WAHLESTEDT C, GOOD L, TIMMONS J A. The human PINK1 locus is regulatedby a non-coding natural antisense RNA during modulation of mitochondrial function., 2007, 8:74. DOI:10.1186/1471-2164-8-74.
[14] OHHATA T, HOKI Y, SASAKI H, SADO T. Crucial role of antisense transcription across the Xist promoter in Tsix-mediated Xist chromatin modification., 2008, 135(2): 227-235. DOI:10.1242/dev. 008490.
[15] Li N, Joska T M, Ruesch C E, Coster S J, Belden W J.The frequency natural antisense transcript first promotes, then represses, frequency gene expression via facultative heterochromatin., 2015, 112(14): 4357-62. DOI: 10.1073/pnas.1406130112.
[16] 李加琪, 张豪, 刘小红, 高萍, 王翀, 吴秋豪, 张细权, 陈瑶生. 长白-蓝塘猪资源群第6号染色体的QTL检测. 中国农业科学, 2004, 37(1):130-135.
LI J Q, ZHANG H, LIU X H, GAO P, WANG C, WU Q H. QTL detection on chromosome 6 in Landrace-Lantang Pig resource population.2004, 37(1):130-135, (in Chinses)
[17] ZHAO X, MO D, LI A, GONG W, XIAO S, ZHANG Y, QIN L, NIU Y, GUO Y, LIU X, CONG P, HE Z, WANG C, LI J, CHEN Y. Comparative analyses by sequencing of transcriptomes during skeletal muscle development between pig breeds differing in muscle growth rate and fatness., 2011, 6(5): e19774. DOI: 10.1371/ journal.pone.0019774.
[18] ZHAO Y, HOU Y, ZHAO C, LIU F, LUAN Y, JING L, LI X, ZHU M, ZHAO S. Cis-natural antisense transcripts are mainly Co-expressed with their sense transcripts and primarily related to energy metabolic pathways during muscle development.2016, 12(8): 1010-1021. DOI: 10.7150/ijbs.14825.
[19] Robinson M D, McCarthy D J, Smyth G K.edgeR: a Bioconductor package for differential expression analysis of digital gene expression data., 2010, 26(1): 139-140. DOI: 10.1093/bioinformatics/ btp616.
[20] HUANG DA W, SHERMAN B T, LEMPICKI R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources.2009, 4(1): 44-57. DOI: 10.1038/nprot. 2008.211.
[21] SHANNON P, MARKIEL A, OZIER O, BALIGA N S, WANG J T, RAMAGE D, AMIN N, SCHWIKOWSKI B, IDEKER T. Cytoscape: a software environment for integrated models of biomolecular interaction networks., 2003, 13(11): 2498-504. DOI: 10.1101/gr.1239303.
[22] WANG X Q, YANG W J, YANG Z, SHU G, WANG S B, JIANG Q Y, YUAN L, WU T S. The differential proliferative ability of satellite cells in Lantang and Landrace pigs., 2012, 7(3): e32537. DOI: 10.1371/journal.pone.0032537.
[23] GUO J, SHAN T, WU T, ZHU L N, REN Y, AN S, WANG Y. Comparisons of different muscle metabolic enzymes and muscle fiber types in Jinhua and Landrace pigs., 2011, 89(1): 185-191. DOI: 10.2527/jas.2010-2983.
[24] TE PAS M F, DE WIT A A, PRIEM J, CAGNAZZO M, DAVOLI R, RUSSO V, POOL M H. Transcriptome expression profiles in prenatal pigs in relation to myogenesis.2005, 26(2-3): 157-165. DOI: 10.1007/s10974-005-7004-6.
[25] 李伯江, 李平华, 吴望军, 李齐发, 黄瑞华, 刘红林. 骨骼肌肌纤维形成机制的研究进展. 中国农业科学, 2014, 47(6): 1200-1207.
LI B J, LI P H, WU W J, LI Q F, HUANG R H, LIU H L. Progresses in research of the mechanisms of skeletal muscle fiber formation.2014, 47(6):1200-1207. (in Chinses)
[26] BERCHTOLD M W, BRINKMEIER H, MUNTENER M. Calcium ion in skeletal muscle: its crucial role for muscle function, plasticity, and disease., 2000, 80(3): 1215-1265. DOI: 10.1152/physrev.2000.80.3.1215.
[27] Lefaucheur L, Ecolan P, Lossec G, Gabillard J C, Butler-Browne G S, Herpin P. Influence of early postnatal cold exposure on myofiber maturation in pig skeletal muscle., 2001, 22(5): 439-452. DOI: 10.1023/A:1014591818870 .
[28] 赵晓, 莫德林, 张悦, 龚雯, 李安宁, 陈瑶生. 猪的骨骼肌生长发育研究进展.生命科学, 2011, 23(1): 37-44.
ZHAO X, MO D L, ZHANG Y, GONG W, LI A N, CHEN Y S. Progress in research on skeletal muscle growth and development in swine.2011, 23(1): 37-44. (in Chinses)
[29] PETTE D, STARON R S. Myosin isoforms, muscle fiber types, and transitions.2000, 50(6): 500-509. DOI:10.1002/1097-0029(20000915)50:6<500::AID-JEMT7>3.0.CO; 2-7.
[30] PICARD B, LEFAUCHEUR L, BERRI C, DUCLOS M J. Muscle fibre ontogenesis in farm animal species.2002, 42(5): 415-431. DOI: 10.1051/rnd: 2002035.
[31] WANK V, FISCHER M S, WALTER B, BAUER R. Muscle growth and fiber type composition in hind limb muscles during postnatal development in pigs., 2006, 182(3/4): 171-181. DOI: 10.1159/000093966.
(责任编辑 林鉴非)
Comparison Study of Differential Expression Genesand-NATs of Skeletal Muscle Between Lantang and Landrace Pig
XU Yueyuan1, QI Xiaolong1, HOU Ye1, ZHAO Yunxia1, LUAN Yu1, ZHOU Huanhuan1, ZHAO Shuhong1,2, LI Xinyun1,2,3
(1Key Laboratory of Agricultural Animal Genetics, Breeding and Reproduction (Huazhong Agricultural University), Ministry of Education, Wuhan 430070;2The Cooperative Innovation Center for Sustainable Pig Production,Wuhan 430070;3Key Laboratory of Pig Healthy Breeding, Ministry of Agriculture, Guangxi Yangxiang Co Ltd, Guigang 537100, Guangxi)
【Objective】 This study was designed to analyze the molecular mechanism of pig skeletal muscle development regulated by-natural antisense transcripts (-NATs) by comparing the differential expression genes and-NATs between Lantang and Landrace pig during their skeletal muscle development. 【Method】In this study, the following steps were adopted: (i) The differential expression genes (DEGs) and-NATs comparing Lantang (LT) and Landrace (LR) pig breeds at 10 time-points distributed from 35 days-post-coitus (dpc) to 180 days-post-natum (dpn) were identified (|log2FC|>1 and FDR<0.01). (ii) The significant biological process Gene Ontology (GO) terms (<0.01) and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathways (<0.05) of the DEGs and the sense gene of differential expression-NATs were enriched via function enrichment analysis. (iii) Then the significant biological process GO terms and KEGG pathways that-NATS participated were filtered by the number of related genes of-NATs, and KEGG pathways were integrated by the number of same genes between pathways. Finally, visual analyses was conducted based on fold change of differential expression-NATs and their sense gene between breeds within pathways.【Result】A total of 5 350 DEGs and 738 differential expression-NATs were identified between LT and LR at 10 time points in this study. GO analysis showed that the expression of differential expression-NATs between LT and LR in skeletal muscle was primarily concerned with genes in biological process, including muscle development and energy metabolism. The integrated analysis of KEGG pathways found that energy metabolism pathways were strongly related by DE genes and their correlated-NATs. Moreover the expression of genes and their correlated-NATs were higher in pig mitochondrial citrate cycle pathway during early stages of birth than adulthood. The visual analyses of KEGG pathways showed that the expression level of energy metabolism pathway involved genes and their correlated-NATs were higher in LT than LR at 49 dpc and 77 dpc, which were two critical points for muscle fibers growth. The differences of expression patterns between LT and LR primarily appear at the early postnatal stages of 2 dpn-90 dpn. 【Conclusion】In this study, 738 differential expression-NATs were identified by comparing between LT and LR at 10 time points of skeletal muscle development. Function enrichment analysis showed that-NATs played a role in developmental differences of skeletal muscle fibers between LT and LR by interacting with genes expressed in energy metabolism related pathways.
Lantang; Landrace; cis-natural antisense transcripts; differential expression; energy metabolism
10.3864/j.issn.0578-1752.2018.09.016
2017-09-01;
2018-02-02
国家自然科学基金项目(31672391,31601920)、国家“863”项目(2013AA102502)
许月园,E-mail:yyxu@webmail.hzau.edu.cn。
李新云,E-mail:xyli@mail.hzau.edu.cn

