中国蒽环类药物特性专家共识
石远凯 巴一 冯继锋 吕跃 许建萍 何小慧 张宇辉 张剑 张健 杨林 周利群 胡夕春侯健 蔡林 刘鹏 黄昱 姜时雨 孙燕
蒽环类药物是在肿瘤内科治疗发展历程中具有里程碑意义的药物,得到了广泛应用,即使在靶向治疗、免疫治疗等新疗法不断涌现的今天,仍然是很多实体肿瘤和血液系统恶性肿瘤治疗的基础性药物。为了进一步规范蒽环类药物在肿瘤治疗中的合理应用,中国抗癌协会肿瘤临床化疗专业委员会组织专家制定了系列《中国蒽环类药物治疗恶性肿瘤专家共识》,包括《中国蒽环类药物特性专家共识》、《中国蒽环类药物治疗淋巴瘤专家共识》、《中国蒽环类药物治疗白血病专家共识》、《中国蒽环类药物治疗乳腺癌专家共识》、《中国蒽环类药物治疗泌尿系统恶性肿瘤专家共识》与《中国蒽环类药物应用心脏毒性处理专家共识》等。这些专家共识将陆续发表,本文是《中国蒽环类药物特性专家共识》。
1 蒽环类药物的发展历程
蒽环类抗肿瘤抗生素(anthracycline anti-cancer antibiotics)或称蒽环糖苷类抗生素(anthracycline gly⁃coside antibiotics),于1950年由H.Brockmann所命名,指的是化学结构上具有7,8,9,10-四氢丁省醌-5.12(7,8,9,10-tetrahydrocenequinone-5,12)骨架的各类糖甙,四氢丁省醌部分即甙元(aglycone),又称为蒽环酮(anthracyclinone)。蒽环类药物,以阿霉素、表阿霉素和吡喃阿霉素为例,基本结构为蒽环与一个氨基糖以糖苷键相连(图1)[1]。
从化学结构分类,蒽环类药物属于抗肿瘤抗生素,是由微生物产生的具有抗肿瘤活性的化学物质。抗肿瘤抗生素的化学结构多种多样,作用机制不尽相同,大部分为抑制脱氧核糖核酸(deoxyribonucleic acid,DNA)、核糖核酸(ribonucleic acid,RNA)和蛋白质合成。
蒽环类药物包括:柔红霉素(daunorubicin,DNR)、阿霉素(adriamycin,ADM)又称多柔比星(doxorubicin)、表阿霉素(epirubicin,EPI)又称表柔比星、吡喃阿霉素(4'-0-tetrahydropyranyladriamycin,THP)又称吡柔比星(pyrarubicin)、米托蒽醌(mitoxantrone,MIT)和卡柔比星(carubicin)等。
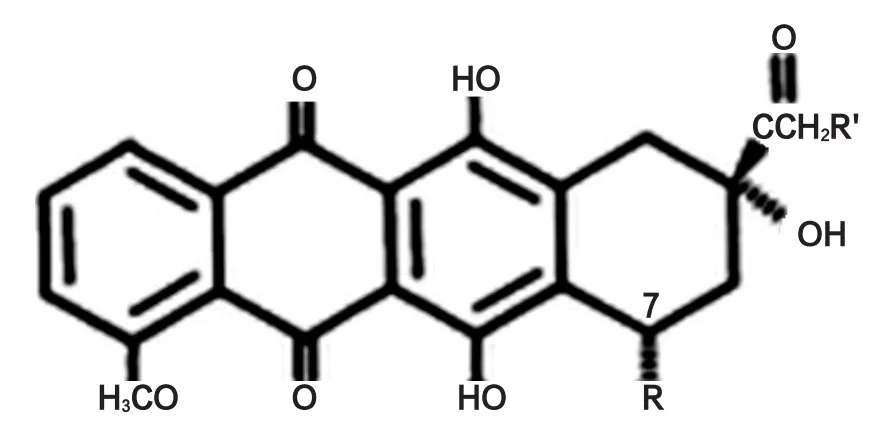
图1 蒽环类药物[1]
1963年,DNR首先被合成,立即被应用于血液系统恶性肿瘤等的治疗,至今仍发挥重要作用。1968年ADM问世,其具有同时抑制RNA与DNA合成作用,对RNA的抑制作用最强,抗瘤谱最广,对各种生长周期的肿瘤细胞均有效。THP、EPI与ADM相比,其疗效相当,心脏毒性更低,获得广泛应用;脂质体ADM的问世,使心脏毒性进一步降低,同时药物具有了某些肿瘤靶向性的特点。
蒽环类药物广谱、有效且广泛地用于治疗血液系统恶性肿瘤和实体肿瘤,包括急性白血病、淋巴瘤、乳腺癌、卵巢癌、胃癌及软组织肉瘤等。其不良反应主要表现为脱发、骨髓抑制、胃肠道反应和心脏毒性。
2 蒽环类药物特性
2.1 作用机制
蒽环的母核蒽醌环通过非特异性插入双链DNA的碱基对之间并与之平行,形成相对稳定的蒽环-DNA复合物。蒽环类药物的母核结构通常由1个多环稠合的疏水平面和1个氨基糖组成,中间由糖苷键相连。在生理条件下,该类化合物带有正电,与带有负电的DNA具有高度亲和性,有利于插入核酸与DNA结合。分子中的糖基增加了药物水溶性和细胞穿透性,提高了药效;分子中的醌结构易于参与电子转移反应并产生氧自由基。蒽环母核的长轴基本垂直于碱基对氢键方向,氨基糖部分的氨基则与DNA的磷酸基以离子键结合,这种嵌入作用使碱基对之间的距离发生变化,从而改变DNA的模板性质。
蒽环类药物的作用机制包括:嵌入DNA碱基对之间,干扰DNA转录、信使核糖核酸(messenger RNA,mRNA)合成;促使拓扑异构酶Ⅱ裂解DNA,破坏其3级结构;抑制DNA多聚酶Ⅰ,抑制DNA合成;产生氧自由基,破坏细胞膜功能,这与心脏毒性相关;主要由多药耐药基因(multidrug resistance gene 1,MDR1)介导耐药,部分药物之间有不完全交叉耐药;抑制RNA合成所需浓度仅为抑制DNA合成浓度的1/10~1/6;增殖期细胞对阿霉素的敏感性比静止期细胞约高出5倍。所以,作为细胞周期非特异性药物,蒽环类药物对于G1和S期细胞最为敏感。蒽环类药物在低浓度时,细胞先呈指数杀伤;高浓度时,杀伤能力与药物浓度呈正相关性。
蒽环类药物嵌入DNA分子,非特异性插入相邻碱基对之间,与核糖-磷酸骨架结合,导致DNA分子局部解螺旋,并可干扰拓扑异构酶Ⅱ重新连接断裂的DNA双链,从而阻碍DNA复制、转录和RNA合成过程。与细胞膜结合,影响与磷脂酰肌醇激活偶联的细胞运输过程。细胞色素P-450还原酶(cyto⁃chrome P-450 reductase)使氧分子变为超氧离子和过氧化氢,进而使DNA单链断裂。富含超氧化物歧化酶(superoxide dismutase,SOD)或谷胱甘肽过氧化物酶的组织可免受超氧离子的损伤,但肿瘤组织和心脏一般较少含有SOD。另外,心肌组织也缺乏过氧化氢酶,不能分解过氧化氢,这也与蒽环类药物的心脏毒性相关[2]。
2.2 临床药理学特点
蒽环类药物主要在肝脏代谢,经胆汁排泄。48 h内<10%的给药量由尿排出,4 d内40%的给药量由胆汁排出。对有肝转移和肝功能受损的患者,在血浆中的浓度维持时间延长,肾功能正常与否对该药物的药代动力学特性影响较小[3]。
蒽环类药物血浆半衰期为13~50 h不等,其中ADM的血浆半衰期为43 h,EPI体内代谢和排泄较ADM快,平均血浆半衰期约为40 h,THP、阿克拉霉素(aclacinomycin,ACR)为13~14 h,主要由肝脏代谢,胆汁排泄,部分代谢物也有抗肿瘤活性。除去甲氧柔红霉素(idarubicin,IDA)外,不能通过胃肠道吸收、不或不易透过血脑屏障。
2.3 药物不良反应及处理
蒽环类药物的不良反应主要表现为心脏毒性、骨髓抑制、胃肠道反应等,上述不良反应均具有剂量依赖性。
2.3.1 心脏毒性 心脏毒性是蒽环类药物最为严重的不良反应,蒽环类药物引起心脏毒性的主要机制为铁介导的活性氧簇(reactive oxygen species,ROS)的产生及促进心肌的氧化应激;蒽环类药物螯合铁离子后触发氧自由基,尤其是羟自由基的生成,导致心肌细胞膜脂质过氧化和心肌线粒体DNA的损伤。相对于其他细胞,蒽环类药物具有亲心肌特性,更易在心肌细胞停留,而心脏组织缺少过氧化氢酶,抗氧化活性较弱。另外,心肌细胞富含线粒体,也是产生ROS的根源;蒽环类药物对于心磷脂的亲和力较高,可进入线粒体,结合心磷脂从而抑制呼吸链,造成心脏损伤。临床研究和实践观察均显示蒽环类药物导致的心脏毒性多数呈进展性和不可逆性,特别是初次使用蒽环类药物就易造成心脏损伤。因此早期监测和积极预防蒽环类药物引起的心脏毒性显得尤为重要。
按照出现的时间进行分类,蒽环类药物导致的心脏毒性可以分为急性、慢性和迟发性。急性心脏毒性在给药后的几小时或几天内发生,常表现为心脏传导紊乱和心律失常,极少数病例表现为心包炎和急性左心衰。慢性心脏毒性在用药后1年内发生,表现为左心室功能障碍,最终可导致心衰。迟发性心脏毒性在用药后数年发生,可表现为心衰、心肌病及心律失常等。多数患者在蒽环类药物给药后可较快地发生心肌损伤,且随着时间的延长愈加明显。在给予蒽环类药物数年后,超过50%患者可发生左心室亚临床超声变化,如后负荷增加或收缩能力下降。蒽环类药物的慢性和迟发性心脏毒性与其累积剂量呈正相关。ADM的最大累积剂量为550 mg/m2,放射治疗或合并用药者<350~400 mg/m2;EPI为900~1 000 mg/m2,用过 ADM 者<800 mg/m2;THP 为950 mg/m2;DNR为550 mg/m2;MIT为160 mg/m2,用过ADM等药物者<120 mg/m2。
2.3.2 骨髓抑制 骨髓抑制是蒽环类药物常见的不良反应,可通过给予重组人粒细胞集落刺激因子(re⁃combinant human granulocyte colony-stimulating fac⁃tor,rhG-CSF)、重组人粒细胞-巨噬细胞集落刺激因子(recombinant human granulocyte-macrophage colony stimulating factor,rhGM-CSF)、促血小 板 生成素(thrombopoietin,TPO)和成分输血等治疗来解决。患者中性粒细胞低于1.0×109/L时应给予rhG-CSF,血小板数低于20×109/L时需静脉输注血小板,也可使用TPO等促进血小板恢复。在使用rhG-CSF、rhGMCSF时应在化疗结束后24~48 h开始使用,不在化疗前或化疗过程中使用。
2.3.3 消化道反应 可通过给予止吐药及肾上腺皮质激素来防治呕吐,常用药物包括恩丹司琼、格拉司琼、阿瑞匹坦等。
2.3.4 膀胱局部反应 膀胱癌患者接受蒽环类药物膀胱灌注时,蒽环类药物的膀胱黏膜渗透性较少,进入全身血液循环量少,因此不良反应主要以膀胱局部表现为主;膀胱灌注所致化学性膀胱炎的严重程度与灌注剂量、频率相关,少数患者可出现尿道狭窄或过敏反应。
2.3.5 药物外渗 蒽环类药物静脉或动脉输注时药物外渗或漏出可引起外周静脉炎、局部组织溃疡和坏死。蒽环类药物制剂pH值低,通常具有较为强烈的刺激性。在药物配置和使用中应注意:1)必须通过静脉或动脉给药,也可以膀胱内给药;2)常用配置溶液为氯化钠注射液、5%葡萄糖注射液或氯化钠葡萄糖注射液。THP仅能用5%葡萄糖注射液或注射用水配置,以免pH值的原因影响效价或产生浑浊;且配置后溶液室温下放置不得超过6 h;3)多数蒽环类药物配制后的溶液于室温正常光照下可保持稳定48 h,强烈光照下可至少保持稳定24 h,建议避光保存在2~8℃,并在24 h内使用;4)即使配置后药液也具有强烈刺激性,如在输液过程中出现外渗或漏出血管,应立即停止输液、尽量回抽药物,并应用1%次氯酸钠溶液处理局部,浸泡过夜最佳,然后用水冲洗。
2.3.6 脱发 蒽环类药物导致的脱发属于暂时性脱发。
专家组成员
顾问:
孙 燕 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
组长:
石远凯 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
委员:
巴 一 天津医科大学肿瘤医院
冯继锋 江苏省肿瘤医院
吕 跃 中山大学附属肿瘤医院
许建萍 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
何小慧 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
张宇辉 国家心血管病中心/中国医学科学院北京协和医学院阜外医院
张 剑 复旦大学附属肿瘤医院
张 健 国家心血管病中心/中国医学科学院北京协和医学院阜外医院
杨 林 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
周利群 北京大学第一医院
胡夕春 复旦大学附属肿瘤医院
侯 健 上海交通大学医学院附属仁济医院
蔡 林 北京大学第一医院
执笔人:
刘 鹏 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室石远凯 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室学术秘书:
黄 昱 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
姜时雨 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
[1]谢雪怡.蒽环类抗癌药研究进展[J].实用肿瘤学杂志,1987,(2):48-52.
[2]Wang HK,Morris SL,Lee Kh.Recent advance in the discovery and development of topoisomerase inhibitors as antitumor agents[J].Med Res Rev,1997,17(4):367-425.
[3]陈新谦,金有豫,汤光,主编.新编药物学[M].第17版.北京:人民卫生出版社,2011:1.

