列线图预测恶性肿瘤患者PICC导管相关血栓风险的研究*
张昊 谢欣 周章剑 郝楠
近年来,经外周中心静脉置管(peripherally inserted central catheters,PICC)在肠外营养、肿瘤化疗中的作用越来越受到临床医护人员的重视,虽然同期也可以应用传统的临时颈内静脉置管,或是植入式静脉输液港,但是PICC可以兼顾治疗的需求和较低的操作风险,并且具有良好的成本效益比,因此得以在临床中广泛开展[1]。随着应用范围以及应用数量的不断扩大,导管相关并发症也不断呈现,而其中临床医护人员最为关注的则是导管相关血栓的发生情况[2]。本文回顾性分析了286例行PICC置管的恶性肿瘤患者,并对其相关因素进行分析,以期得出恶性肿瘤患者PICC导管相关血栓发生的风险因素,并构建列线图模型,以判断不同患者的血栓形成风险。
1 材料与方法
1.1 临床资料
回顾性分析2014年12月至2015年12月就诊于西安交通大学第一附属医院的286例进行PICC置管的恶性肿瘤患者临床病理资料、人口学特征以及导管相关因素。所有患者均签署知情同意书。纳入标准:1)患者因临床需要行PICC置管;2)相关人口学特征、临床信息均可获得;3)在PICC置管后生存时间>30 d;4)年龄>18岁;5)无PICC置管相关禁忌证。
1.2 方法
所有PICC置管均遵照本中心静脉治疗小组置管流程,PICC置管后行胸部X线平片确认尖端位置,PICC相关血栓均经血管彩色多普勒超声确认。
1.3 统计学分析
采用R语言软件中“rms”和“glmnet”包进行统计学分析。计量数据采用x±s的方式表示,针对PICC相关血栓的潜在影响因素应用最小绝对收缩选择算子(least absolute shrinkage and selection operator,LASSO)回归分析,在选择最优Lambda值[3],纳入4个相关预后参数,进一步构建列线图。应用Harrell一致性指数(harrell concordance index,C-index)评估预后模型。P<0.05为差异具有统计学意义。
2 结果
286例符合入组条件的PICC置管患者,其中72例出现导管相关血栓,214例未出现导管相关血栓,患者的平均年龄分别为(53.26±13.88)岁和(55.4±12.66)岁,组间比较无显著性差异(P=0.251)。不同性别发生导管相关血栓的比例无显著性差异。77.4%患者选择经贵要静脉行PICC穿刺植入,几乎所有的患者选择了单腔非耐高压的PICC管道。在所有患者中,10例(3.5%)既往有PICC置入史,其中3例发生血栓性疾病。在置入PICC前,34例(11.9%)患者存在经外周静脉的化疗药物输注史。不同分组的临床特征见表1。
2.1 患者的临床特征

表1 PICC置管患者的人口学及临床特征

表1 PICC置管患者的人口学及临床特征(续表1)
2.2 相关血栓风险因素
本研究共纳入27个潜在的血栓相关危险因素,包括临床人口学特征、实验室检查特征以及导管相关特征。由于不同特征之间存在一定相关性,为进行降维处理,并筛选出最具代表性的血栓相关危险因素,对所有特征进行LASSO回归分析,在选择Lambda参数为最小值时(图1),经过10折交叉验证结果显示,进行外周血管穿刺时是否应用超声引导、患者既往是否接受过经外周静脉化疗、置管期间是否存在其他合并症(如静脉炎、导管相关血流感染等)以及置管时的血浆D-二聚体含量为影响PICC置管患者发生导管相关血栓的危险因素。进一步应用非参数检验验证上述参数,结果显示组间具有显著性差异(P值分别为0.006、0.007、0.015以及0.023)。当患者在置管时血浆D-二聚体较高、采用盲法进行穿刺操作、既往存在外周静脉化疗史、置管期间发生其他合并症时,其发生导管相关血栓的风险显著增加。而其中置管前血浆D-二聚体含量作为连续变量与导管相关血栓发生关系密切,显示其与预后相关的局部加权回归(locally weighted scatterplot smoothing,LOWESS)曲线见图2。
2.3 个体化血栓相关风险预测
将通过LASSO回归构建的4个风险因素纳入列线图模型,通过回归分析对每一个风险因素进行赋值,最终构建列线图(图3),将其与实际发生情况进行比对,经过200次自助重抽样后,C-index指数为0.688,显示其拟合曲线和校正后的拟合曲线均位于10%的误差范围内(图4)。

图1 PICC相关血栓风险因素LASSO回归分析
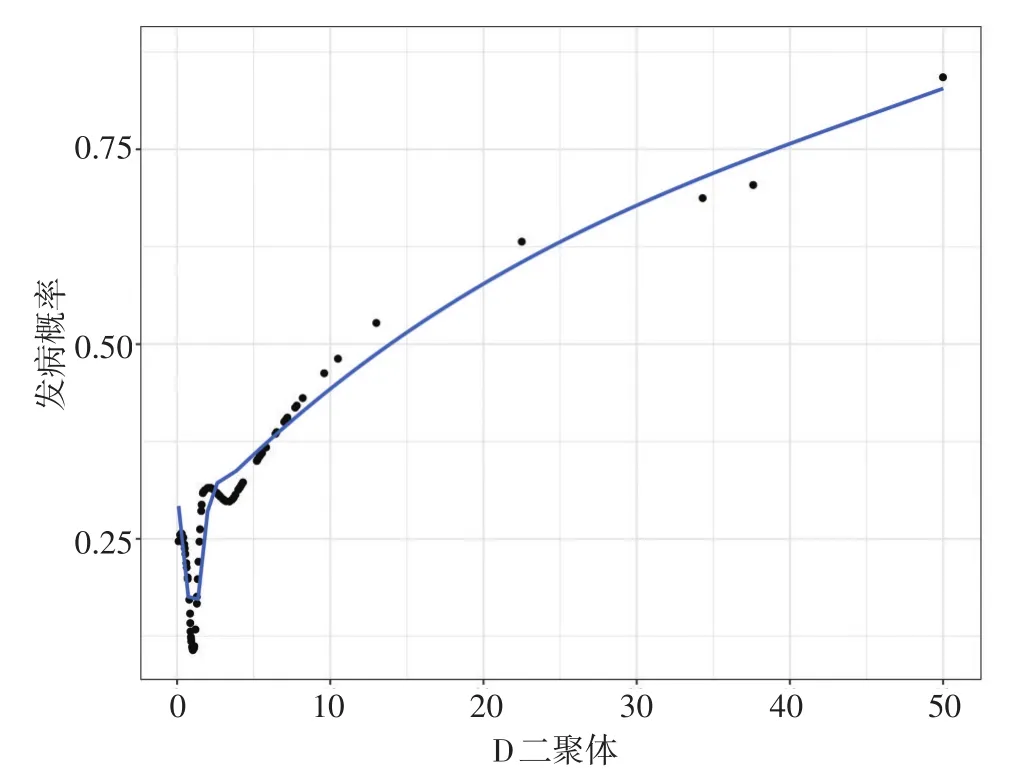
图2 血浆D-二聚体与PICC相关血栓风险的拟合曲线图
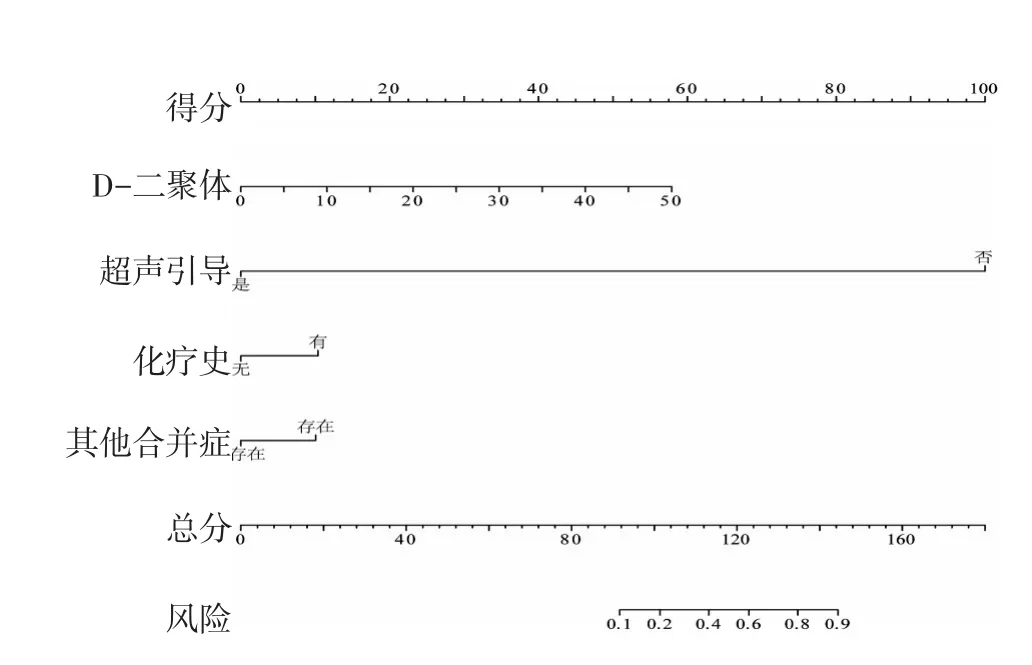
图3 列线图模型预测PICC相关血栓风险

图4 列线图模型预测PICC相关血栓风险与实际发生情况的拟合曲线
3 讨论
经外周静脉置入中心静脉导管在肿瘤患者中的应用越来越广泛。[4]与经中心静脉穿刺置管或静脉留置针相比,PICC具有操作方便、安全、血管损伤和血液感染风险低等优点。然而,导管相关静脉血栓形成仍是较为常见的合并症。此外,多数的血栓在形成之初是无症状的,因此其可能导致许多潜在的严重并发症,如肺栓塞。评估和管理PICC的使用,以及PICC相关血栓疾病的评估对患者预后至关重要[5-6]。
PICC导管相关血栓的形成受静脉血栓形成以及血管内膜相关损伤的影响。根据Virchow三合一理论形成血栓需要三个重要的组成部分:异常血流,血管内皮损伤和高凝状态[7]。因此研究PICC相关血栓形成应着重关注这三个方面的因素。本研究发现进行外周血管穿刺时是否应用超声引导、患者既往是否接受过经外周静脉化疗、置管期间是否存在其他合并症以及置管时的血浆D-二聚体含量为影响PICC置管患者发生导管相关血栓的危险因素[8]。
尽管在化疗中,局部药物的浓度可以通过PICC导管中快速的血流而稀释,但由于化疗药物的输入,依然会引起血管内皮损伤和局部炎症。因此,化疗通常被认为是血栓形成的关键危险因素。Lyman等[9]的研究表明,有经外周静脉化疗史的恶性肿瘤患者血栓形成风险可以增加6倍以上。化疗药物输注引起的慢性炎症可引起血管收缩并改变血流动力学,促进血栓形成和发展。此外,不同化疗方案的选择也可能改变血流局部pH值,这可直接影响静脉的血管内皮并促进血栓形成[10]。而对于肿瘤患者而言,在置管过程中,应用超声引导可以降低穿刺次数,减少对血管内皮的损伤。
D-二聚体是纤维蛋白的降解产物,因此被认为是纤维蛋白稳态的预测因子。有研究表明对于恶性肿瘤患者,D-二聚体含量升高,患者血栓形成的风险提高约4倍[11]。Arpaia等[12]的研究表明在恶性肿瘤患者化疗前的D-二聚体水平可以作为预测静脉血栓发生的独立危险因素。本研究发现作为非线性预测因子的D-二聚体,随着其含量的增加,PICC相关血栓形成的风险也逐渐增加。因此,认为D-二聚体是PICC相关血栓形成风险评估最具成本-效益比的预测因子[13]。
本研究应用4个PICC相关血栓形成的危险因素构建列线图,模型中的每个因素都被分配一个加权分值,以估计该因子对血栓形成的影响。在列线图模型中,越高的分数表明血栓形成的风险越高。进一步通过计算C-index指数评估模型的预测准确性和同质性,结果表明,列线图预测模型与实际血栓形成密切相关,C-index指数接近0.7[14-15],表明该列线图模型是一个可以对PICC相关血栓形成风险进行有效评估的预测系统。
综上所述,进行外周血管穿刺时是否应用超声引导、患者既往是否接受过经外周静脉化疗、置管期间是否存在其他合并症以及置管时的血浆D-二聚体含量为影响PICC置管患者发生导管相关血栓的危险因素,其所构建的列线图可以较准确的预测PICC相关血栓形成的风险,为临床诊疗工作的开展提供一定的理论基础和数据支持。
[1] 孙媛媛,高伟,崔英,等.肿瘤化疗患者应用植入式静脉输液港与PICC效果比较的系统评价[J].山东大学学报(医学版),2015,53(10): 73-81.
[2] 蒋青玉,张金桃.肿瘤患者PICC血栓形成的危险因素及防治进展[J].中国保健营养,2016,26(4):387-388.
[3] Archer KJ,Williams AA.L1 penalized continuation ratio models for ordinal response prediction using high-dimensional datasets[J].Stat Med,2012,31(14):1464-1474.
[4] 应丽,朱云霞.肿瘤患者PICC相关性上肢深静脉血栓影响因素研究进展[J].重庆医学,2017,46(9):1283-1285.
[5] Chopra V,Fallouh N,Mcguirk H,et al.Patterns,risk factors and treatment associated with PICC-DVT in hospitalized adults:A nested case-control study[J].Thromb Res,2015,135(5):829-834.
[6] Prandoni P,Polistena P,Bernardi E,et al.Upper-Extremity Deep Vein Thrombosis:Risk Factors,Diagnosis,and Complications[J]. Arch Intern Med,1997,157(1):57.
[7] Cervantes J,Rojas G.Virchow's Legacy:deep vein thrombosis and pulmonary embolism[J].World J Surge,2005,Suppl 1:S30-34.
[8] Nifong TP,Mcdevitt TJ.The effect of catheter to vein ratio on blood flow rates in a simulated model of peripherally inserted central venous catheters[J].Chest,2011,140(1):48-53.
[9] Lyman GH,Schabert VF,Philip PA,et al.Thromboembolic events(TE) among patients with metastatic pancreatic ductal adenocarcinoma (mPDA)after chemotherapy(Chemo)[J].J Clin Oncol,2017,35 (44_Suppl):280.
[10]Lyman GH,Bohlke K,Horana A,et al.Tromboembolism prophylaxis and treatment in patients with cancer:american society of clinical oncology clinical practice guideline update 2014[J].J Lin Ncol Oncol, 2015,33(6):654-656.
[11]Lee AY,Julian JA,Levine MN,et al.Clinical utility of a rapid whole-blood D-dimer assay in patients with cancer who present with suspected acute deep venous thrombosis[J].Ann Intern Med,1999,131(6):417-423.
[12]Arpaia G,Carpenedo M,Verga M,et al.D-dimer before chemotherapy might predict venous thromboembolism[J].Blood Coagul Fibrinolysis,2009,20(3):170-175.
[13]姚俊淑.血浆D-二聚体检测在下肢深静脉血栓诊断中的作用分析[J].吉林医学,2017,38(4):749-750.
[14]Pencina MJD,Agostino RB.Overall C as a measure of discrimination in survival analysis:model specific population value and confidence interval estimation[J].Statist Med,2010,23(13):2109-2123.
[15]Kang L,Chen W,Petrick NA,et al.Comparing two correlated C indices with right-censored survival outcome:a one-shot nonparametric approach[J].Statist Med,2015,34(4):685-703.

