基于液质联用法同时检测龟甲胶饮片中牛皮源、驴皮源及龟甲胶成分
郝刚,罗丹,钟水生
(1.苏州市药品检验检测研究中心,江苏 苏州 215104;2.浙江省人民医院药学部,浙江 杭州 310014)
龟甲胶作为常见的胶类药材,具有滋阴、养血、止血等功效,常用于阴虚潮热、骨蒸盗汗、腰膝酸软、血虚萎黄、崩漏带下等症状[1]。龟甲来源主要为龟科动物乌龟(Chinemys reevesii)的背甲及腹甲,然而目前市场上龟甲胶质量参差不齐,某些非法生产企业为追求经济效益,采用牛皮、驴皮等其他动物皮类制成龟甲胶,不仅为人民群众安全用药带来危害,也为传统药材的质量标准研究提出挑战[2-6]。本实验基于超高效液相色谱-串联四级杆质谱技术(UPLC-MS/MS)建立了同时检测龟甲胶饮片中牛皮源、驴皮源及龟甲胶等成分的测定方法,实现龟甲胶饮片中主成分鉴别与非法添加成分检查的同时测定。
1 材料
1.1 仪器
Waters公司超高效液相色谱-串联四级杆质谱(仪器型号:ACQUITY Xevo TQ-S);电喷雾离子源(ESI+),Masslynx 4.1数据处理系统;KQ-300DA型数控型超声波清洗器;Thermo低温离心机;MILLIPORE纯水仪。
1.2 样品与试剂
龟甲胶对照药材(批号:121693-201301),黄明胶对照药材(批号:121695-201301), 阿胶对照药材(批号:121274-201202)均购自中国食品药品检定研究院;序列分析级胰蛋白酶购自Sigma-Aldrich公司(批号规格:T1426-50 mg);实验用水为超纯水,其他试剂均为色谱纯。供试品龟甲胶饮片均来源于市场监督抽样。
2 方法与结果
2.1 质谱条件
电喷雾离子源(ESI);正离子扫描;毛细管电压3.0 kV;毛细管温度:200℃;脱溶剂气体流量:500 L/h;锥孔气流量:150 L/h;氩气为碰撞气;采用多反应检测模式(MRM)监测,以质荷比(m/z)631.3(双电荷)→546.4和(m/z)631.3(双电荷)→921.4作为龟甲胶特征肽段离子对;(m/z)641.3(双电荷)→726.2和(m/z)641.3(双电荷)→783.3作为牛皮源特征肽离子对;(m/z)539.8(双电荷)→612.4和(m/z)539.8(双电荷)→924.0作为驴皮源特征肽离子对。
2.2 色谱条件
BEH-C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相:以乙腈为流动相A,0.1%甲酸溶液为流动相B,按表1方法进行梯度洗脱;柱温:20℃;进样器温度:15℃;流速:0.3 mL/min;进样量:1 μL。梯度洗脱程序见表1。

表1 梯度洗脱程序
2.3 溶液制备
龟甲胶、黄明胶、阿胶对照药材溶液制备:分别取龟甲胶、黄明胶、阿胶对照药材0.1 g,置于50 mL容量瓶中,加1%碳酸氢铵溶液超声溶解并稀释至刻度。混合对照溶液制备:分别取黄明胶对照药材溶液、阿胶对照药材溶液5 mL,置100 mL容量瓶中,加龟甲胶对照药材溶液稀释至刻度,过0.22 μm滤膜,取续滤液100 μL,加胰蛋白酶溶液10 μL(取序列分析级胰蛋白酶,加1%碳酸氢铵溶液制成1 mg/mL的溶液,临用新配),摇匀,37℃恒温酶解12 h,进样分析。
供试品溶液制备:取龟甲胶饮片打粉,精密称定粉末0.1 g,置于50 mL容量瓶中,加1%碳酸氢铵溶液超声溶解并稀释至刻度,过0.22 μm滤膜,取续滤液100 μL,加胰蛋白酶溶液10 μL,摇匀,37℃恒温酶解12 h,进样分析。
2.4 方法专属性
按上述质谱方法和色谱条件检测龟甲胶、黄明胶、阿胶混合对照溶液,MRM质谱如图1所示,黄明胶对照品药材保留时间为3.6 min,阿胶对照药材保留时间为6.03 min,龟甲胶对照药材保留时间为8.24 min。空白基质溶液如图2所示,结果表明,空白基质溶液在龟甲胶、黄明胶、阿胶保留时间处无干扰。
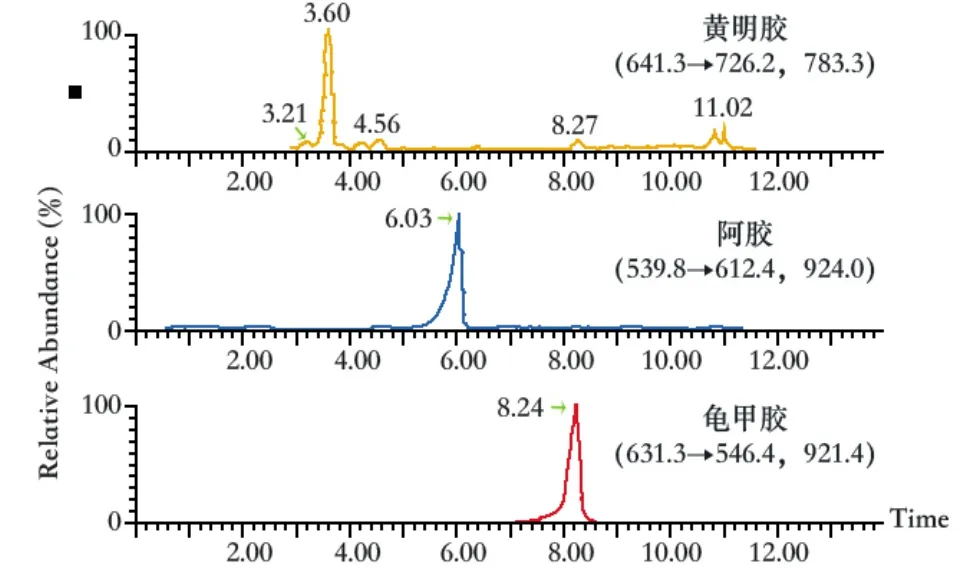
图1 黄明胶、阿胶、龟甲胶对照药材溶液特征离子色谱图
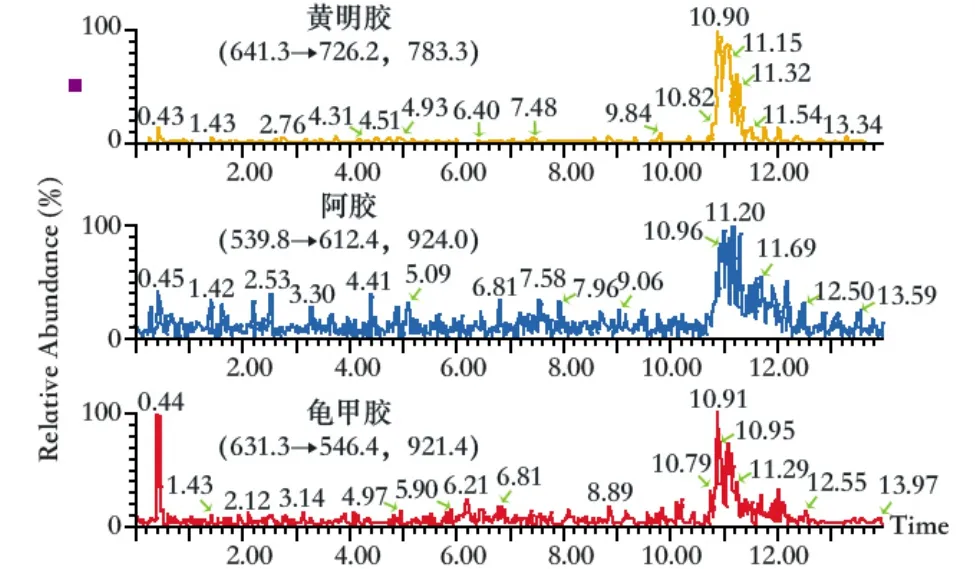
图2 空白基质溶液色谱图
龟甲胶(图3)、阿胶(图4)、黄明胶(图5)对照品药材溶液分别进样,实验结果表明,在所建方法中,任一对照药材对其他2种对照药材的检测均无干扰,3种对照药材的特征肽离子对专属性良好。
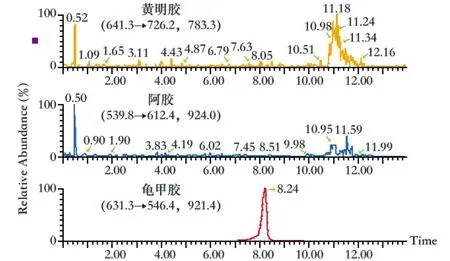
图3 龟甲胶对照药材溶液特征离子色谱图
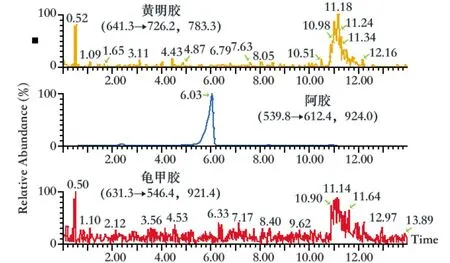
图4 阿胶对照药材溶液特征离子色谱图
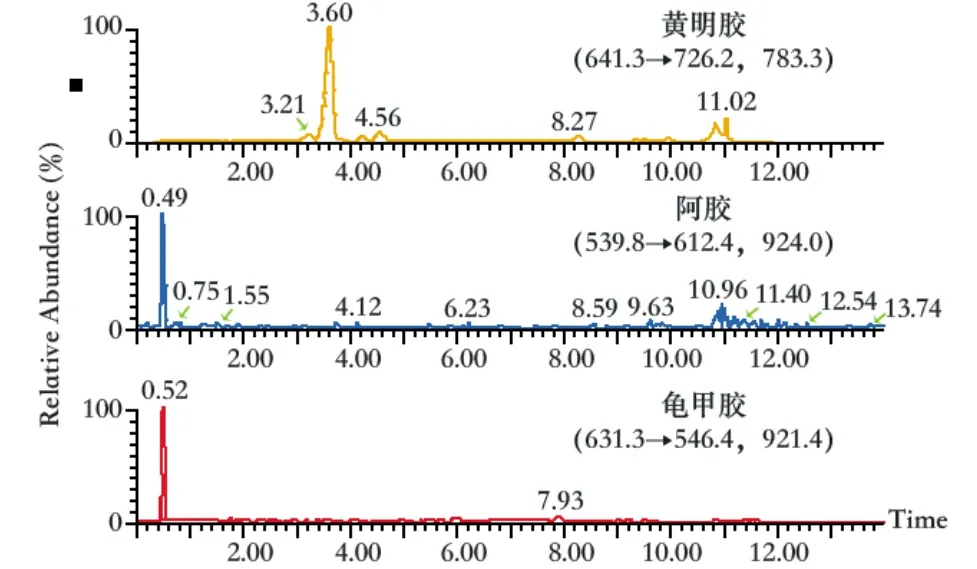
图5 黄明胶对照药材溶液特征离子色谱图
2.5 检测限
龟甲胶、黄明胶、阿胶对照药材溶液逐级稀释,以各自特征肽离子对色谱图信噪比3∶1计算检测限,结果表明,龟甲胶检测限浓度为0.5 mg/L,黄明胶检测限浓度为2.0 mg/L,阿胶检测限浓度为1.0 mg/L。
2.6 重复性
取龟甲胶、黄明胶、阿胶对照药材混合溶液6份,按所建方法进行检测,分别计算3种对照药材MRM色谱峰面积,龟甲胶峰面积RSD为3.8%,黄明胶峰面积RSD为4.5%,阿胶峰面积RSD为2.7%,结果表明所建方法重复性良好。
2.7 样品测定
收集市场常见品牌的龟甲胶饮片18批,按本实验所建方法对样品进行检测。检测结果表明,全部批次样品检出龟甲胶特征肽离子对,即符合《中华人民共和国药典》(2015年版)鉴别项下相应规定。其中3批样品检出牛皮源成分,全部样品未检出驴皮源成分(或低于检测限)。
3 讨论
UPLC-MS/MS具有分离能力强,分析时间短及高选择性、高灵敏度等优势,近年来被广泛应用于药品质量标准研究[7-9]。《中华人民共和国药典》(2015年版)首次将液质联用技术应用于胶类药材的标准检验,规定以质荷比(m/z)631.3(双电荷)→546.4和(m/z)631.3(双电荷)→921.4作为龟甲胶的特征肽段离子对,从而应用于龟甲胶的鉴别[1]。此外,国家食品药品监督管理总局于2014年7月17日发布了“龟甲胶中牛皮源与驴皮源成分检测”的补充检验方法(编号:2014013),规定龟甲胶中不得检出牛皮源特征肽离子对[(m/z)641.3→726.2和(m/z)641.3→783.3]及驴皮源特征肽离子对[(m/z)539.8→612.4和(m/z)539.8 → 923.8][10]。
本实验基于UPLC-MS/MS方法,建立了同时检测龟甲胶饮片中龟甲胶、牛皮源和驴皮源成分的测定方法,所建方法可专属性检测龟甲胶、黄明胶、阿胶的特征肽离子对,且互无干扰,3种对照药材的方法检测限均在0.5~2.0 mg/L范围内,方法灵敏度高,满足龟甲胶饮片中牛皮源、驴皮源成分的“掺假”检查。此外,所建方法将药典的龟甲胶鉴别方法与补充检验方法中驴皮源、牛皮源成分检查方法相结合,实现了龟甲胶、牛皮源、驴皮源等成分的同时测定,进一步缩短了分析时间,提高检测效率,且方法重复性好,可用于实际样品测定,为龟甲胶饮片的质量控制提供了实验依据。
参考文献
[1]国家药典委员会.中华人民共和国药典(2015年版)一部[S].北京:中国医药科技出版社,2015:181-182.
[2]程显隆,李文杰,魏锋,等.动物胶类药材的鉴别方法研究进展[J].亚太传统医药, 2011, 7(3):167-169.
[3]彭婷婷,江勋.超高效液相色谱-质谱联用法检测不同品种龟甲制龟甲胶的牛皮源成分[J].中国药业, 2016,25(10): 72-73.
[4]程显隆,李文杰,张小龙,等. UPLC-QTOF-MS结合主成分分析法用于龟甲胶、鹿角胶中添加牛皮源成分的检测研究[J].药物分析杂志, 2012, 32(6): 931-935.
[5]李明华,龙国友,程显隆,等.超高效液相色谱-三重四极杆质谱法用于中成药中胶类成分的检测研究[J].中国药学杂志, 2015, 50(24): 2151-2153.
[6]刘琳,张贵锋,查圣华,等.中药龟甲胶的质量控制方法研究[C].中国中药杂志编委会暨中药新产品创制与产业化发展战略研讨高端论坛,2011.
[7]李晓东,林琳,丁丽霞.液质联用技术在药品质量控制中的应用[J].中国药师, 2010, 13(5): 645-647.
[8]郝刚.液质联用技术在2015年版《中国药典》中药标准中的应用[J].中国药品标准, 2017, 18(3):171-174.
[9]范学海,朱颐申,陈兰婷,等.液质联用在多肽及蛋白质定性方面的研究进展[J].生物技术通报,2014,27(6):62-66.
[10]国家食品药品监督管理总局,药品检验补充检验方法和检验项目批准件2014013[S].北京,2014.

