大鼠肝脏细胞BRL-3A放射性损伤中没食子鞣质的保护作用实验研究
孙岩娜, 李 莉, 艾斯克尔·吐拉洪, 肖 蕾, 伊利亚尔·努如拉, 张月芬, 包永星, 张 仑, 张 华
(新疆医科大学1第一附属医院肿瘤中心二科, 乌鲁木齐 830054; 2附属肿瘤医院放射科, 乌鲁木齐 830011)
肝癌(hepatocellular carcinoma,HCC)是一种恶性肿瘤,其致死病因及发病率在全世界范畴内分别高居第三及第六位[1]。近年来基于精准放疗技术的迅猛发展,放射治疗技术成为一种有效无创伤治疗癌症的手段,但射线易导致放射性肝损伤(radiation induced liver damage,RILD),可严重制约放射治疗[2],具有高度致死性,就目前为止行之有效的药物治疗方案尚未发现。没食子(Turkish galls, MSZ)是没食子蜂(Cunips gallae-tinctoriae Oliv )的幼虫,均归属于没食子蜂科昆虫。本课题组前期研究发现其具有抗肿瘤和抗辐射作用[3-4],但对于放射性肝脏损伤的防治作用尚不明确,本研究通过体外培养大鼠肝脏细胞系BRL-3A,通过射线照射后利用不同浓度的没食子提取物进行干预,目的在于阐述没食子鞣质和它的有效提取物对放射性肝细胞的保护作用,现报道如下。
1 材料与方法
1.1主要材料和试剂BRL-3A品系大鼠肝细胞系(武汉普诺生命科技有限公司);胎牛血清、0.25%胰蛋白酶(GIBCO公司);MTT试剂、DMSO(Sigma公司);Trizol RNA试剂(北京乐博生物公司);逆转录试剂盒、PCR Master Mix(Roch公司);RIPA试剂(索莱宝生物);Caspase-3,Caspase-9单抗和兔抗鼠二抗(Cell Signaling公司)。
1.2细胞培养将冻存管中BRL-3A细胞置于37℃温水中迅速融化后置入离心机以1 000 rp转速离300 s,丢弃上清液。取含10%胎牛血清的DMED培养液,将离心产物入其中,搅拌混匀。将细胞接种于50 mL细胞培养瓶,置入37℃、5%CO2的细胞培养箱培养。根据实验设计,分为空白对照组、0 Gy假照射组、10 Gy照射组、10 Gy照射+MSZ组、MSZ组,每组6重复,其中MSZ浓度配置为0.1、0.3、0.5、1.0 mg/mL)。
1.3X射线参数设置使用6 MV X线照射,计量率为400 cGy/min,波源距100 cm,将1.0 cm的等效膜铺于培养皿,进而保证剂量相同,吸收剂量设置为10 Gy。
1.4制备没食子和有效提取物药液基于超声波甲醇技术。称取适量没食子药材粉碎,没食子粉末(过孔径250 μm筛),50 g经70%甲醇超声处理1 h,室温避光浸泡24 h,提取3次。减压浓缩滤液,真空抽吸并烘干得到浸膏。加入适量的水使其悬浮状态,然后用乙醚萃取,再用乙酸乙酯回收。先用蒸馏水将药物配成50 mg/mL的母液搁置冰箱(4℃)备用。
1.5检测各组细胞活力采用MTT的方法,可于96孔板上按照2×103个细胞/孔接种对数期细胞,以100 μL/孔体积为标准,后放于细胞培养箱内,参数定为饱和湿度37℃及5%CO2,设6个平行孔/组。将配成的5 mg/mL MTT溶液根据所需的量按10 μL/100 μL的比例与无血清DMEM混匀,分别于照射后24、48、72 h取离培养板,将孔内培养液丢弃掉,含MTT的培养液100 μL加入每孔中,37℃避光孵育4 h后丢弃,每孔加150 μL DMSO,震荡10 min后,可充分溶解蓝紫色结晶。于酶标仪上双波长490 nm和570 nm处分别测定每孔的吸光度(OD)值数。
1.6RT-PCR检测Caspase-3和Caspase-9的mRNA水平采用Trizol法,根据说明书提取各组细胞总RNA。RNA质检合格后逆转录合成cDNA。根据说明书在25 μL EP管中按如下20 μL反应体系进行逆转录,引物配置见表1(引物序列由上海生工合成,以ACTB为内参)。按引物说明书,加合适的ddH2O稀释引物配成母液(100 μmol),取10 μmol母液稀释10倍配成工作液。据RT-PCR反应试剂盒,在25 μL EP管中按如下20 μL 体系行Real-TimePCR反应。利用相对定量2-△△Ct法评估各组目的基因mRNA的表达水平,实验反复3次。
1.7统计学处理应用SPSS20.0软件进行统计学分析,两独立样本采用t检验,多组比较采用单因素方差分析。非正态性数据选用非参数检验,以P<0.05为差异具有统计学意义。

表1 引物配置
2 结果
2.1没食子鞣质和有效提取物在大鼠肝脏BRL-3A细胞增殖过程中的作用依据预实验的结果,将MSZ的浓度梯度限度分别设定为:0.1、0.3、0.5、1.0 mg/mL,以倒置显微镜10倍值数前提下,0 Gy假照射组细胞分裂较快,呈团分布,10 Gy射线照射后明显抑制BRL-3A的生长,细胞增殖速度减慢,边缘不清晰,核增大。10 Gy照射+MSZ组和10 Gy照射组比较,10 Gy照射+MSZ组各浓度下细胞数目均较10 Gy照射组增多,在0.5 mg/mL浓度下48 h最为明显,提示MSZ可能对细胞具有保护作用(图1-3)。
2.2MTT法检测MSZ对细胞的保护作用MTT结果显示,X射线照射48 h后抑制作用最大,72 h后差异逐渐减小;与此同时,MSZ的保护作用也在48 h最为明显,10 Gy照射+MSZ组各浓度与10 Gy照射组比较,差异均具有统计学意义(P<0.05)(表2)。
2.3RT-PCR检测Caspase-3及Caspase-9mRNA的表达在48个小时以后RT-PCR检测发现MSZ组各浓度下的Caspase-3以及Caspase-9的mRNA表达水平与空白对照组相比差异均无统计学意义(P>0.05);10 Gy照射+MSZ组各浓度下的Caspase-3、Caspase-9 mRNA表达水平与10 Gy照射组相比,差异均具有统计学意义(P<0.05)(表3)。

a: MSZ 0.1 mg/mL

b: MSZ 0.3 mg/mL

c: MSZ 0.5 mg/mL

d: MSZ 1.0 mg/mL
图10Gy照射组

a: MSZ 0.1 mg/mL

b: MSZ 0.3 mg/mL

c: MSZ 0.5 mg/mL

d: MSZ 1.0 mg/mL
图210Gy照射组

a: MSZ 0.1 mg/mL

b: MSZ 0.3 mg/mL

c: MSZ 0.5 mg/mL

d: MSZ 1.0 mg/mL

图3 10 Gy照射+MSZ组
注: 与10 Gy照射组比较,*P<0.05。
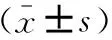
表3 Caspase-3、Caspase-9 mRNA表达水平对比
注: 与10 Gy照射组比较,*P<0.05。
3 讨论
肝细胞受到射线照射易产生RILD,该病临床表现起病隐匿,如若发生就会呈进行性演进,再而导致肝纤维化和功能衰竭。典型RILD发生于放疗后的4~8周,而部分报道阐明RILD最早可发生在放疗完成后的2周,最迟发生在放射结束后7月左右,以乏力、腹水、肝脏肿大、碱性磷酸酶和(或)转氨酶的明显升高为特点[5-8]。病理学变化以中央小静脉闭塞性改变为主要特点,示进行性肝纤维化过程[9]。
中医药在RILD治疗方面研究越来越多,大量文献表明,丹参素、番茄红素、表儿茶酸、人参提取物、积雪草苷等中草药成分能够通过消除氧自由基、抗氧化、保护射线导致的DNA损伤等途径减轻放射性损伤[10-13]。蜂胶是一种带有芬芳味道的胶状固体物质,因其清除氧自由基的功效被用来防治氧化损伤[14-15]。最近的研究表明,蜂胶中含有的一种叫咖啡酸苯乙酯的生物学活性成分,可保护对四氯化碳引起的小鼠的肝脏损伤[16],同时部分文献表明,咖啡酸苯乙酯能够通过抑制肝细胞凋亡、阻断炎症途径降低肿瘤坏死因子α的水平防治放射性肝脏损伤[17]。Song等[18]人发现低浓度的染料木黄酮能够减少射线导致的肝脏实质细胞的凋亡、基因的变异和染色体的损伤,促进DNA的修复。如上所述,中草药成分在RILD治疗方面的研究逐渐显现出较好的发展趋势,但仍需动物或临床实验进一步明确。
在早期,我们的研究人员对没食子鞣质及活性进行了研究,已发现其对于龋病的防治具有良好的效果,具有一定的抗肿瘤作用和抗辐射作用[3-5]。
在本研究中,我们采用体外培养的大鼠正常肝脏细胞系BRL-3A,给予单次10 Gy的照射,通过显微镜下观察细胞的增殖情况,发现X射线对细胞的抑制作用在48 h最为明显,72 h后差异逐渐减小;与此同时,MSZ的保护作用也在48 h最为明显,与10 Gy照射组比较,10 Gy照射+MSZ组差异均具有统计学意义。在48个小时以后发现MSZ细胞的Caspase-3以及Caspase-9的mRNA表达水平与空白对照组相比差异无统计学意义(P>0.05);10 Gy照射+MSZ组的Caspase-3、Caspase-9 mRNA表达水平与10 Gy照射组相比,差异均具有统计学意义(P<0.05)。提示MSZ提取物能够有效减少射线对细胞造成的损伤,具有促进细胞增殖的作用,同时也发现细胞凋亡的指标中Caspase-3、Caspase-9 mRNA表达量变化,初步说明MSZ促进细胞增殖可能和减少细胞凋亡相关,但仍需要深入研究进行后续验证。
综上所述,虽然目前尚未发现具有肯定作用的RILD的防护药物,但是经过不断寻找和探索,MSZ可能成为具有潜在辐射防护作用的药物。
参考文献:
[1] JEMAL A, BRAY F, CENTER M, et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[2] PETER F,ULRIKE S,ANDREA F,et al.A new xenobiotic-induced mouse model of sclerosing cholangitis and biliary fibrosis[J].Am J Pathol,2007,171(2):525-536.
[3] 李新尚,程春,赵今,等.没食子对牙釉质矿化作用的体外实验研究[J].中华实用诊断与治疗杂志,2011,25(10):947-952.
[4] 赵今,李新尚,林静,等.天然药物没食子对早期釉质龋再矿化作用的研究[J]. 实用口腔医学杂志,2011,27(4):469-473.
[5] CHENG J C,WU J K,HUANG C M,et al.Radiation-induced liver disease after three-dimensional conformal radiotherapy for patients with hepatocellular carcinoma:Dosimetric analysis and implication[J]. Int J Radiat Oncol Biol Phys,2002,54(1):156-162.
[6] LAWRENCE T S, ROBERTSON J M, ANSCHER M S, et al. Hepatic toxicity resulting from cancer treatment[J]. Int J Radiat Oncol Biol Phys, 1995,31(5):1237-1248.
[7] LAVRENCE T S,TENHAKEN R K,KESSLER M L,et al.The use of 3D dose-volume analysis to predict radiation hepatitis[J]. Int J Radiat Oncol Biol Phys,1992,21(4):781-788.
[8] BENSON R, MADAN R, KILAMBI R, et al. Radiation induced liver disease:A clinical update[J].J Egypt Natl Canc Inst,2016,28(1):7-11.
[9] GUO J,ZHANG Y,ZENG L,et al.Salvianic acid A protects L-02 cells against γ-irradiation-induced apoptosis via the scavenging of reactive oxygen species[J].Environ Toxicol Pharmacol,2013,35(1):117-130.
[10] EYDAN D M,URSEL B,BILGICI B,et al.Protective effect of lycopene against radiation-induced hepatic toxicity in rats[J]. J Int Med Res,2011,39(4):1239-1252.
[11] MAHUYA S,DIPESH K D,KRISHNENDU M,et al.Epicatechin ameliorates ionising radiation-induced oxidative stress in mouse liver[J]. Free Rad Res,2012,46(7):842-849.
[12] JANG S S, KIM H G, HAN J M, et al. Modulation of radiation-induced alterations in oxidative stress and cytokine expression in lung tissue by Panax ginseng extract[J].PLoS One,2014,9(5):e97599.
[13] JOY J,ALARIFI S,ALSUHAIBANI E,et al.Protection of DNA from ionizing radiation-induced lesions by asiaticoside[J].Phytother Res,2015,29(2):201-209.
[14] AGHEL S, POURAMIR M, MOGHADAMNIA A, et al. Effect of iranian propolis on salivary total antioxidant capacity in gamma-irradiated rats[J].J Dent Res Dent Clin Dent,2014,8(4):235-239.
[15] NORONHA V R,ARAUJO G S,GOMES R T,et al. Mucoadhesive propolis gel for prevention of radiation-induced oral mucositis[J].Curr Clin Pharmacol,2014,9(4):359-364.
[16] NERIMAN C,ILTER K,AYSEL K, et al.Protective effects of CAPE on liver injury induced by CCL4:an electron microscopy study[J]. Ultrastruct Pathol,2011,35(1):26-30.
[17] CHU J J,ZHANG X J,JIN L G, et al.Protective effects of caffeic acid phenethyl ester against acute radiation-induced hepatic injury in rats[J].Environ Toxicol Pharmacol,2015,39(2):683-689.
[18] SONG L H,MA L J,CONG F S,et al.Radioprotective effects of genistein on HL-7702 cells via the inhibition of apoptosis and DNA damage[J].Cancer Letters,2015,366(1):100-111.

