FKN浓度对人脐静脉内皮细胞中CX3CR1表达的影响
王 领, 赵一蔚, 任培乐, 刘蕾娜, 杨 盼, 李 静, 雷冬玉, 聂永梅
(新疆医科大学基础医学院生理学教研室, 乌鲁木齐 830011)
心血管病的病理基础主要是动脉粥样硬化(atherosclerosis,AS),严重危害人类健康[1-2]。AS的发病机制尚未完全明确。趋化因子在动脉粥样硬化早期的中心事件中起关键作用,即外周血单核细胞向损伤部位的动脉壁内膜迁移、聚集、粘附及活化[3]。趋化因子能够将免疫细胞吸引到特定位置,根据N尾部保守半胱氨酸的数目和位置,趋化因子可分为4个亚家族:CC,C,CXC和CX3C[4]。不规则趋化因子(Fractalkine,FKN)又称为CX3CL1,目前已知是CX3C亚家族的唯一成员[4],兼具有趋化和粘附的特征,主要表达在活化的内皮细胞,与多种炎症性疾病相关[2]。FKN的受体是CX3CR1,它是G-蛋白偶联受体家族中的成员。Wang等[3]的研究表明FKN主要在活化的内皮细胞上表达,活化的内皮细胞释放FKN与其受体CX3CR1结合后,加强自然条伤(NK)细胞的杀伤力,损伤血管内皮细胞,同时使血管内皮细胞趋化和黏附外周血中单核细胞、淋巴细胞,进而促使AS的形成[5]。本课题组前期研究发现,在低剪切应力作用下内皮细胞上CX3CR1表达增加,但在内皮细胞上FKN是如何影响CX3CR1的表达鲜见报道[6]。本研究拟用MTT、qRT-PCR和Western-blot的分子生物学实验方法,探讨FKN对内皮细胞CX3CR1表达的影响,进而为研究动脉粥样硬化性疾病的发病机制提供新的切入点。
1 材料和方法
1.1材料EAhy.926细胞株购置于中科院上海细胞库,重组人fractalkine(美国peprotech),胎牛血清(美国Gibco),0.25%胰酶、双抗、M199购置于美国Hyclone,MTT(四噻唑蓝)(武汉博士德),BSA蛋白定量试剂盒、RAPA裂解液购置于美国Thermo,兔抗人CX3CR1(美国Abcam),山羊抗兔IGg(武汉Elabscience)。
1.2方法
1.2.1 采用MTT方法挑选出FKN对人脐静脉内皮细胞的最佳药物作用浓度 选取不同浓度的FKN作用于人脐静脉内皮细胞株EAhy.926,根据细胞吸光度,从0、12.5、25、50、100ng/mL中挑选出人脐静脉内皮细胞的FKN最佳作用浓度。
1.2.2 不同浓度FKN 培养24 h 的人脐静脉内皮细胞中CX3CR1蛋白表达观察 取EAhy.926细胞(对数生长期),稀释细胞密度至4×105/mL,孔板中接种,细胞培养箱中培养12 h。饥饿12 h后,依次加入终浓度为0、12.5、25、50、100、200 ng/mL 的FKN 继续培养24 h[7],每组设3 个复孔,24 h后收集细胞至EP管中。每组加100 μL裂解液,冰上裂解10 min,混匀,重复3次,12 000 r/min 离心10 min,取上清,用12%的 SDS-PAGE 分离胶电泳,分离蛋白质,电泳后将PAGE 凝胶上的蛋白转至PVDF 膜上(100 V, 90 min)。取膜,8%脱脂奶粉封闭2 h,加入一抗4℃孵育10~12 h, TBST 洗3 次,加入二抗室温孵育2 h, TBST 洗3 次,ECL 法显色,内参为GAPDH。各组CX3CR1 表达量以CX3CR1条带灰度值与GAPDH 灰度值之比所做的柱形图表示,做3 次重复实验,取平均值。
1.2.3 25 ng/mL的FKN作用不同时间后人脐静脉内皮细胞中CX3CR1 mRNA 表达观察 根据“1.2.2”项的实验结果确定FKN作用浓度为25 ng/mL,加入25 ng/mL的FKN培养内皮细胞,培养0、2、4、8、12、16、24、48 h后,提RNA,反转录成cDNA,5倍稀释后,qRT-PCR检测CX3CR1 mRNA表达情况。CX3CR1上游引物:5′-ACATCGTGGTCTTTGGGACT-3′,CX3CR1下游引物:5′-GACACTCTTGGGCTTCTTGC-3′;β-actin上游引物:5′-TGGCACCCAGCACAATGAA-3′,β-actin下游引物:5′-CTAAGTCATAGTCCGCCTTAGAAGCA-3′,25 μL反应体系上机。PCR 的反应条件为:预热50℃,2 min;然后94℃,3 min;94℃,30 s;57℃,30 s;72℃,30 s ,40个循环。
1.2.4 25 ng/mL的FKN 作用不同时间后人脐静脉内皮细胞中CX3CR1蛋白表达观察 加入25 ng/mL的FKN培养内皮细胞0、2、4、8、12、24、48 h后,PBS洗3遍,提蛋白质,用Western-blot方法检测CX3CR1 蛋白表达情况。
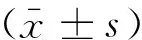
2 结果
2.1FKN对EAhy.926细胞增殖的影响分别用0、12.5、25、50、100 ng/mL 5个浓度的FKN刺激EAhy.926细胞,根据吸光度筛选出EAhy.926最佳药物浓度为25 ng/mL, 见图1。

(与0 ng/mL FKN浓度组比较, *P<0.05)
2.2FKN的不同浓度刺激内皮细胞24hCX3CR1蛋白表达量比较用不同浓度 FKN刺激内皮细胞24 h,Western-blot结果显示在25 ng/mL FKN刺激浓度时内皮细胞CX3CR1蛋白表达量最高,见图2。

(与0 ng/mL FKN浓度组比较, *P<0.05)
2.3FKN(25ng/mL)刺激EAhy.926细胞不同时间对CX3CR1mRNA表达量比较用25 ng/mL FKN连续刺激内皮细胞0、2、4、8、16、12、24、48 h,qRT-PCR结果显示25 ng/mL的FKN刺激内皮细胞8 h,内皮细胞 CX3CR1 mRNA表达升高,见图3。

(与0 h组比较, *P<0.05)
2.4FKN(25ng/mL)刺激EAhy.926细胞不同时间对CX3CR1蛋白表达量比较观察FKN作用时间对细胞的蛋白表达产生影响,因此用25 ng/mL FKN连续刺激内皮细胞 0、2、4、8、12、24、48 h, Western-blot结果显示25 ng/mL的FKN刺激内皮细胞2 h,内皮细胞CX3CR1蛋白表达升高,24 h达到高峰,见图4。

(与0 h组比较, *P<0.05)
3 讨论
FKN可分为膜结合型和分泌型2种分子形式,分别诱导外周血白细胞的游走和黏附[8]。可溶性FKN对表达CX3CR1的T细胞、单核细胞具有强效的趋化作用[8],并且膜结合型FKN可帮助血管壁黏附T细胞、单核细胞,因此FKN同时具有细胞间黏附分子和趋化因子的作用[9]。White等[10]用血清诱导健康捐献者的人单核细胞的自发凋亡,分别培养于FKN、无血清培养基和胎牛血清的环境中,只有FKN能以剂量依赖性方式促进单核细胞增殖。FKN在稳态和炎症条件下促进细胞增殖[11]。FKN在内皮细胞上少量表达,在活化的内皮细胞大量表达[4],同样可对内皮细胞的增殖产生影响。本研究表明,25 ng/mL的FKN作用于内皮细胞能有效促进细胞增殖。此外有研究表明,FKN/CX3CR1能促进胰腺癌细胞的增殖[12]。
受体和配体结合具有高度亲和力、饱和性、特异性的特点[13 ]。受体的最基本特点是特异性,它保证信号的正确转导[13 ]。CX3CR1是FKN的唯一受体,FKN则是CX3CR1的配体[3]。在apoE敲除的动脉粥样硬化的小鼠中阻断FKN/CX3CR1结合能有效抑制动脉粥样硬化的形成[14]。而将FKN cDNA 转染至内皮细胞中,结果发现NK 细胞对表达FKN的血管内皮细胞杀伤和黏附能力明显增加[15],用抗体或可溶性FKN阻断血管内皮细胞与NK 细胞的结合后,血管内皮细胞损伤受到抑制[15]。进一步研究证实CX3CR1可以介导单核细胞向损伤的内皮快速浸润[16],从而促进动脉粥样硬化斑块的形成。此外,在小鼠应用CX3CR1拮抗剂可以有效抑制动脉粥样硬化的形成[17]。上述研究表明FKN/CX3CR1在促进动脉粥样硬化的形成中的作用。但是CX3CR1 作为FKN的特异性受体[9]是如何受FKN的影响而促进动脉粥样硬化的形成鲜见报道。本研究观察25 ng/mL FKN作用于人脐静脉内皮细胞 24 h后,内皮细胞CX3CR1的蛋白表达最高,表明CX3CR1和FKN的结合在25 ng/mL的浓度点到达饱和。此外本研究用25 ng/mL FKN作用于人脐静脉内皮细胞不同时间,观察到内皮细胞CX3CR1蛋白的表达量在2 h明显增加,在24 h达顶峰,且呈时间依赖性,在48 h内皮细胞CX3CR1蛋白表达量开始下降,表明在时间点上,FKN和CX3CR1的结合同样有饱和性。同时,本研究结果说明CX3CR1受到FKN刺激8 h,mRNA表达达高峰,而蛋白表达在24 h时达高峰,CX3CR1的蛋白水平表达滞后于mRNA水平。综上所述,FKN能调控内皮细胞CX3CR1的表达,且由于 FKN 独特的结构和功能,因此深入探索FKN/CX3CR1 在内皮细胞炎症反应中的作用,将为治疗动脉粥样硬化性疾病提供新的靶点。
参考文献:
[1] BROWN A J, TENG Z, EVANS P C, et al. Role of biomechanical forces in the natural history of coronary atherosclerosis[J]. Nat Rev Cardiol, 2016, 13(4):210.
[2] 吴莹, 张小宁. 颈动脉粥样硬化斑块与脑梗死的相关关系[J]. 新疆医科大学学报, 2013, 36(5):715-716.
[3] WANG Y, CHEN H, FU Y, et al. MiR-195 inhibits proliferation and growth and induces apoptosis of endometrial stromal cells by targeting FKN[J].Int J Clin Exp Patho, 2013, 6(12):2824-2834.
[4] LI F Q, ZENG D K, JIA C L, et al. The effects of sodium tanshinone IIa sulfonate pretreatment on high glucose-induced expression of fractalkine and apoptosis in human umbilical vein endothelial cells.[J]. Int J Clin Exp Med, 2015, 8(4):5279-5286.
[5] 孙健,赵吉光,于凤秀. FKN影响动脉粥样硬化信号传导机制的研究及NF-κB在其中的作用[J].中国实验诊断学, 2008, 12(6):721-724.
[6] 赵一蔚.剪切应力作用强度及时间对内皮细胞CX3CR1表达水平的影响[D].新疆医科大学, 2017.
[7] ZANCHI C, ZOJA C, MORIGI M, et al. Fractalkine and CX3CR1 mediate leukocyte capture by endothelium in response to Shiga toxin[J]. J Immunol, 2008, 181(2):1460-1469.
[8] APOSTOLAKIS S, SPANDIDOS D. Chemokines and atherosclerosis: focus on the CX3CL1/CX3CR1 pathway[J]. Acta Pharmacol Sin,2013,34(10):1251-1256.
[9] FLIERL U, BAUERSACHS J, SCHAFER A. Modulation of platelet and monocyte function by the chemokine fractalkine (CX3CL1) in cardiovascular disease[J]. Eur J Clin Invest. 2015,45(6):624-633.
[10] WHITE G E, MCNEILL E, CHANNON K M, et al. Fractalkine promotes human monocyte survival via a reduction in oxidative stress[J]. Arterioscl Throm Vas Biol, 2014, 34(12):2554-2562.
[11] WHITE G E, GREAVES D R. Fractalkine: a survivor′s guide: chemokines as antiapoptoticmediators[J]. Arterioscler Thromb Vasc Biol,2012,32(3):589-594.
[12] WANG H, CAI J, DU S, et al.Fractalkine/CX3CR1 induces apoptosis resistance and proliferation through the activation of the AKT/NF-κB cascade in pancreatic cancer cells[J].Cell Biochem Funct,2017,35(6):315-326.
[13] 李佳虹,唐旗羚,郭纪全.基于受体配体结合技术研究酸枣仁镇静催眠活性成分[J].中国药理学通报, 2016,32(4):508-513.
[14] POUPEL L, BOISSONNAS A, HERMAND P, et al. Pharmacological inhibition of the chemokine receptor, CX3CR1, reduces atherosclerosis in mice.[J]. ArteriosclerThrombVascBiol, 2013, 33(10):2297-2305.
[15] 付晓霞,罗云梅,刘娟.淫羊藿苷对CX3CL1诱导的单核细胞向人脐静脉内皮细胞迁移和黏附的影响及机制研究[J].遵义医学院学报,2017,40(1):59-63.
[16] ALI M T, MARTIN K, KUMAR A H, et al. A novel CX3CR1 antagonist eluting stent reduces stenosis by targeting inflammation[J]. Biomaterials, 2015, 69:22-29.
[17] THOMAS G, TACKE R, HEDRICK C C, et al. Nonclassical patrolling monocyte function in the vasculature.[J]. ArteriosclerThrombVascBiol, 2015, 35(6):1306.

