性别对原发性高血压大鼠靶器官损伤及炎症因子的影响
邬利娅·伊明, 帕提古丽·阿布拉, 凯萨尔·力瓦依丁, 阿迪力·阿不都热合曼,周文婷, 艾尼瓦尔·吾买尔
(1新疆医科大学药学院药理学教研室, 乌鲁木齐 830011; 2新疆维吾尔医学专科学校, 新疆 和田 848000; 3新疆维吾尔自治区维吾尔医医院 ,乌鲁木齐 830049)
原发性高血压(EH)是一种最为常见的心血管疾病之一,是导致心脑血管疾病发病率和死亡率增加的危险因素之一[1]。EH的发病机制错综复杂,到目前为止仍在不断探索当中。近年来许多研究结果提示炎症因素在EH的发生、发展以及转归中扮演了非常重要的角色[2-4]。研究发现,高血压患者处于一种低度炎症状态,患者血清炎症分子含量明显增高[3-4]。大规模的前瞻性研究结果显示,患者在发展为高血压之前就处于低度炎症状态,提示炎症反应可能在高血压发生之前就存在,是导致高血压发病及预后的独立预测因素[5-6]。
肾素-血管紧张素系统(RAS)的过度激活是高血压发生发展的重要病理生理学机制之一,血管紧张素Ⅱ (AngⅡ) 是RAS中最重要的生物活性物质,主要通过与靶器官细胞膜上的AngⅡ 1型受体(AT1)结合而发挥其生理和病理效应,诸如收缩血管作用,激活交感神经系统,促进醛固酮、血管加压素分泌,血管平滑肌增殖,促进心肌细胞增殖等[7-8]。此外,AngⅡ有很强的促炎症反应作用,是一种具有较强的致炎作用的活性多肽,可参与炎症反应中的所有过程[9-10],它以血压依赖性和非血压依赖性机制诱导炎症反应[11],而引起器官损伤[12]。
已有研究显示,雌激素对炎症反应有一定的调节作用[13- 16],对RAS的激活也存在一定的性别差异[17-18]。本研究以6月龄原发性高血压大鼠(SHR)为研究对象,探讨SHR靶器官损伤及炎症因子的性别差异性,并以AngⅡ及内皮素(ET-1)与炎症因子做相关性分析,以确定导致高血压性炎症反应中的关键因素。
1 材料与方法
1.1实验动物6月龄健康无特定病原级(SPF)SHR100只,雌雄各半,购自上海第二军医大学实验动物中心。实验期间,保持动物房相对湿度70%左右,室温在22℃左右,自动照明(12 h明,12 h暗)。大鼠常规喂养。大鼠的使用及动物的处理,均符合第二军医大学动物伦理委员会的管理准则。
1.2实验仪器与试剂MPA-大鼠尾动脉无创测压系统(上海奥尔科特生物技术有限公司),SN-695B智能放免g测量仪(上海原子核研究所一厂),超高速低温离心机(Eppendorf公司),戊巴比妥钠(Sigma公司产品)。AngⅡ、ET-1浓度,血清白介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和雌二醇(E2)浓度放射免疫分析试剂盒由北京北方雅生物技术研究所提供。
1.3实验方法
1.3.1 血压的测定 以尾动脉血压测定仪测定大鼠清醒状态下的收缩压(SBP)。将大鼠置血压测定仪的恒温箱内加热至37℃,以尾套置于尾根部,将压力传感器置于尾部下方,记录大鼠尾动脉的搏动曲线。大鼠在此环境中稳定30 min,待尾动脉搏动明显时开始测定。通过气囊充气阻断尾血流,使尾动脉搏动曲线逐渐变小至消失,搏动曲线刚刚消失那一点的压力即为动物的血压值。连续测定6次取均数,连续测定3 d。第一天为动物的训练测定,可不计结果,第二、三天为正式试验,以2 d测定值的均数为该动物的血压值。
1.3.2 血清及血浆的制备 经尾动脉测压SBP>150 mmHg的SHR大鼠,腹腔注射3%戊巴比妥钠45 mg/kg麻醉,颈动脉插管取血2 mL注入试管中,在室温放置2 h待凝固, 4℃3 000 rpm/min离心5 min,分离血清-20℃保存;取血2 mL,迅速注入放在冰水冷却的含酶抑制剂3.0 mmol/L EDTA-Na220 μL、3.4 mmol/L 8-轻基哇琳20 μL及3.2 mmol/L二疏基丙醇10 μL的试管中,摇匀后迅速放回冰水中冷却,4℃1 000 rpm/min离心15 min,分离血浆-20℃保存用于测定AngⅡ;取血1 mL,迅速注入放在冰水冷却的含酶抑制剂7.5%EDTA-Na215 μL及抑肽酶20 μL的抗凝管中,摇匀后迅速放回冰水中冷却,4℃3 000 rpm/min离心10 min,分离血浆放入-20℃保存用于测定ET-1。
1.3.3 靶器官指数的测定 大鼠麻醉取血后,迅速打开胸腔和腹腔,依次取出心脏、胸主动脉和肾脏。用预冷的磷酸盐缓冲液(PBS)冲净血液后放入,将心脏以滤纸吸干水分后称重,分离出左、右心室,分别称重计算计算心室及左心室指数即心室重和体质量比(VW/BW)及左心室重和体质量比(LVW/BW)。取右肾吸干水分,称重计算肾指数即右肾重和体质量比(RKW/BW)。取胸主动脉,去除其粘附的脂肪组织和结缔组织,滤纸吸干水分并称重,用游标卡尺测量其长度,计算血管指数即胸主动脉重和长度之比(AW/L),观察靶器官损伤程度。
1.3.4 血浆AngⅡ与ET-1及血清炎症因子的测定 用放免试剂盒测定血清TNF-α、IL-1β及IL-6 的含量及血浆AngⅡ和ET的含量,测定方法按试剂盒说明书操作。
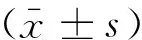
2 结果
2.1性别对SHR的收缩压及靶器官损伤的影响雄性SHR(SHR-M)组的SBP和体质量高于雌性SHR(SHR-F)组(P<0.01)。SHR-F组的VW/BW和LVW/BW大于SHR-M组(P<0.01),LVW/RVW和AW/length小于SHR-M组(P<0.01), RKW/BW和RCT/RMT性别差异无统计学意义,见表1。

表1 性别对SHR血压及器官损伤参数
注: 与SHR-F组比较,*P<0.05,**P<0.01。
2.2SHR的AngⅡ、ET、E2及炎症因子的性别差异SHR-F组血浆AngⅡ的含量低于SHR-M组(P<0.05),血浆ET的含量高于SHR-M组(P<0.01);SHR-F组血清IL-1β的含量高于SHR-M组(P<0.01),IL-6的含量低于SHR-M组(P<0.05),血清TNF-α性别差异无统计学意义(P>0.05),见表2。

表2 性别对血中AngⅡ、ET-1、E2和炎症因子的含量的影响
注: 与SHR-F组比较,*P<0.05,**P<0.01。
2.3AngⅡ、ET-1与E2及炎症因子的相关性对血清炎症因子与血浆AngⅡ及ET进行线性相关分析结果表明:SHR-F组血浆AngⅡ的含量与血清E2含量呈正相关(P<0.05),见图1;血浆AngⅡ的含量与炎症因子IL-1β及IL-6血浆的含量呈正相关(P<0.05),见图2、3;血浆AngⅡ的含量与TNF-α无相关性,ET与各炎症因子无相关性;SHR-M组血浆AngⅡ与炎症因子IL-1β及IL-6之间呈正相关(P<0.05),见图4、5;ET-1与IL-6呈正相关,但差异无统计学意义,与其他炎症因子无相关性。
3 讨论
本研究以SHR为研究对象,是原发性高血压动物模型,其高血压的发病机制属于混合型。为了避免高血压以外的因素对炎症因子水平的干扰,采用无创尾动脉测压检测方法测定大鼠的血压,动脉压>150 mmHg作为高血压形成的标准。测定血清炎症因子和雌二醇,血浆AngⅡ和ET-1水平,并侧测定心脏、胸主动脉和肾脏的器官指数,评价靶器官的损伤程度。本研究发现,成年雌性自发性高血压大鼠的收缩压低于雄性大鼠(P<0.05),雄性大鼠组的AW/L也高于雌性组(P<0.05),而LVW/BW反而是雌性组大于雄性组(P<0.05),而LVW/RVW却是雄性组大于雌性组(P<0.05)。这表明去掉BW的影响后,实际上雄性大鼠的心室肥厚程度仍然是雄性组比较严重。同龄的雌性大鼠和雄性大鼠的体重有较大的差异,会干扰LVW/BW值。雌性组血浆AngⅡ水平低于雄性组(P<0.05),提示性别差异可影响AngⅡ的生成,高血压的大鼠的血压和靶器官损失的性别差异与肾素血管紧张素系统的激活有关。雌性组血浆ET-I水平高于雄性组(P<0.05)。关于雌性自发性高血压大鼠血浆ET-I水平高的原因不清,推测除了雌激素的作用外,可能还有其他影响的因素存在,详细机制有待于进一步研究。

图1雌性SHR的血浆AngⅡ与血清E2的相关性

图2雌性SHR的血浆AngⅡ与血清IL-1β的相关性

图3雌性SHR的血浆AngⅡ与血清IL-6的相关性


促炎性细胞因子的主要生物学功能就是激活炎性细胞、促进炎症细胞的聚集并增加其它炎性因子的表达,参与炎性反应和免疫应答。在心血管系统,促炎性细胞因子可导致血管内皮功能不全、诱导趋化因子在心血管系统的表达,进而引起单核细胞和T淋巴细胞的聚集和浸润,导致炎性损伤[19]。本研究显示:原发性高血压大鼠血清中IL-6的浓度雄性组高于雌性组(P<0.05),雌激素呈现了一定的抗炎作用;血清TNF-α的浓度性别差异无统计学意义;血清IL-1β的浓度却表现为雌性组高于雄性组(P<0.05),雌激素有可能促进IL-1β的产生。关于雌激素和IL-1β的关系的研究结果有一定争议[20-21]。雌激素和IL-1β之间的内在关系有待于进一步研究发现。
本研究结果显示:不论是雌性组还是雄性组,IL-1β和IL-6均与AngⅡ呈正相关(P<0.05);炎症因子与ET-1无显著相关性,提示这2种促炎细胞因子的产生可能主要与体内AngⅡ水平有关,提示肾素血管紧张素系统的激活是引起高血压性炎症反应的主要原因;雌二醇与AngⅡ呈正相关(P<0.05),提示在雌性SHR中雌激素可能促进循环中AngⅡ的生成。
综上所述,自发性高血压大鼠的血压水平、靶器官的损伤及炎症因子存在一定的性别差异性,AngⅡ是诱发高血压大鼠炎症反应的关键因素,在雌性高血压大鼠中雌二醇水平高可增加AngⅡ的产生。
参考文献:
[1] XIE H H, MIAO C Y, JIANG Y Y, et al. Synergism of atenolol and nitrendipine on hemodynamic amelioration and organ protection in hypertensive rats[J]. J Hypertens, 2005, 23(1):193-201.
[2] MESSERLI F H, WILLIAMS B, RITZ E. Essential hypertension[J]. Lancet, 2007, 81(2):165-180.
[3] JASTRZEBSKI M I, CZARNECKA D, RAJZER M, Increased levels of inflammatory markers in hypertensives with target organ damage[J]. Kardiol Pol, 2006, 64(8):802-809.
[4] TSOUNIS D, BOURAS G, GIANNOPOULOS G, et al. Inflammation markers in essential hypertension[J]. Med Chem,2014,10(7):672-681.
[5] ENGSTROM G, LIND P, HEDBLAD B, et al. Long-term effects of inflammation-sensitive plasma proteins and systolic blood pressure on incidence of stroke[J]. Stroke, 2002, 33(12):2744-2749.
[6] NISKANEN L, LAAKSONEN D E, NYYSSÖNEN K, et al. Inflammation, abdominal obesity, and smoking as predictors of hypertension[J]. Hypertens, 2004 ,44(10):859-865.
[7] SIRAGY H M. AT1 and AT-2 receptor in the kidney:Role in disease and treatment[J]. Am J Kidney Dis, 2000, 36 (3 Suppl 1):S4-S9.
[8] TE RIET L, VAN ESCH J H, ROKS A J, et al. Hypertension:renin-angiotensin- aldosterone system alterations[J]. Circ Res,2015, 116(6):960-975.
[9] LI L, YI-MING W, LI Z Z, et al. Local RAS and inflammatory factors are involved in cardiovascular hypertrophy in spontaneously hypertensive rats[J]. Pharmacol Res, 2008, 58(3-4):196-201.
[10] TOUYZ R M. Molecular and cellular mechanisms in vascular injury in hypertension:role of angiotensin II[J]. Curr Opin Nephrol Hypertens,2005, 14(2):125-131.
[11] MERVAALA E, MULLER D N, SCHMIDT F, et al. Blood pressure-independent effects in rats with human renin and angiotensinogen genes[J]. Hypertens, 2000, 35(2):587-594.
[12] 孔丽娟, 江丹娜. 高血压与炎症因子关系研究[J]. 现代实用医学, 2008, 20(12):988-989.
[13] 吴婷, 宗刚军. 高血压病与炎症反应相关性研究[J]. 心脏杂志, 2013(5):606-608.
[14] YLIKORKALA O, ORPANA A, PUOLAKKA J, et al. Postmenopausal hormonal replacement decreases plasma levels of endothelin-1[J]. J Clin Endocrinol Metab, 1995, 80(11):3384-3387.
[15] HAYNES M P, LI L, SINHA D, et al. Src kinase mediates phosphatidylinositol 3-kinase/ Akt-dependent rapid endothelial nitric-oxide synthase activation by estrogen[J]. J Biol Chem, 2003, 278(4):2118-2123.
[16] SHANTHA G P, KUMAR A A, BHARADHI M K, et al. Role of gender in the associations of microalbuminuria with inflammatory markers in hypertensive subjects:a cross-sectional study[J]. Kidney Blood Press Res, 2009, 32(6):434-439.
[17] AL-GBURI S, DEUSSEN A J, GALLI R, et al. Sex-specific differences in age-dependent progression of aortic dysfunction and related cardiac remodeling in spontaneously hypertensive rats[J]. Am J Physiol Regul Int Comp Physiol, 2017, 12(5):R835-R849.
[18] DADAM F M, CISTERNAS C D, MACCHIONE A F, et al. Sex chromosome complement involvement in angiotensin receptor sexual dimorphism[J]. Mol Cell Endocrinol, 2017, 447(5):98-105.
[19] 张岚, 戴小华. IL-6、TNF-α参与高血压肾损伤研究进展[J]. 中医药临床杂志,2014, 26(1):78-80.
[20] SAKAZAKI F, UENO H, NAKAMURO K. 17bata-Estradiol enhances expression of inflammtory cytokines and inducible nitric oxide synthase in mouse contact hypersenitivity[J]. Int Immunopharmacol, 2008, 8(5):654-660.
[21] CHOI J S, KIM S J, LEE K E, et al. Effects of estrogen on temporal of IL-1pata and IL-1ra in rat organotypic hippocampal slices exposed to oxygen-glucose deprivation[J]. Neurosci Lett, 2008, 438(2):233-237.

