基于介孔二氧化硅的纳米药物输送系统构建
梁旭华,任素娟,吴美妮
(商洛学院生物医药与食品工程学院,陕西商洛 726000)
近年来,纳米药物输送系统由于能够将药物靶向输送至病灶部位,调节药物释放,有效提高药物的生物利用度,降低毒副作用,因此引起了研究者的广泛关注。据报道,粒径为几十到100 nm的纳米粒子可以通过高通透性和滞留效应(EPR效应)富集于肿瘤部位[1-2]。因此,当纳米粒子载药以后可以实现将药物靶向输送至肿瘤部位,增强肿瘤治疗效果、降低毒副作用。介孔二氧化硅纳米颗粒(Mesoporous silica nanoparticles,MSNs)是利用有机分子作为模板,形成的多孔纳米材料[3]。MSNs不仅具有介孔材料的特性,而且也具有纳米材料的特性,例如:均一的孔径、规则的孔道、表面易被修饰、良好的生物相容性、比表面积大等特点,因此在生物医药、环境保护、传感器、工业催化等方面有很大的应用前景[4]。本研究以十六烷基三甲基溴化铵(CTAB)为模板,正硅酸乙酯(TEOS)为硅源,采用水热合成法、酸液萃取法制备介孔二氧化硅纳米颗粒(MSNs),重点对其内部孔道结构、药物载带与释放性能进行了研究,为介孔二氧化硅纳米材料的进一步开发利用提供一定参考。
1 材料与方法
1.1 实验材料与仪器
姜黄素标准品购自上海晶纯生化科技股份有限公司,实验用水为本实验室自制,其他所有试剂均为分析纯级别,购自国药集团化学试剂有限公司,磷酸盐缓冲液(PBS)为实验现配。
实验仪器:分析天平、pH计、磁力搅拌器、水热反应釜、电子恒温水浴锅、电子恒温鼓风干燥箱、超声波清洗仪、高速离心机、真空干燥箱、傅里叶变换红外光谱仪、Micromeritics ASAP 2020M型全自动比表面和孔隙分析仪、紫外分光光度计。
1.2 方法
1.2.1 介孔二氧化硅纳米载体(MSNs)的制备
1)称取0.8 g十六烷基三甲基溴化铵(CTAB)溶入到150 g去离子水中,随后加入20 mL丙三醇(GL)和40 mL氨水溶液(25%),于50℃水浴锅中搅拌0.5 h使其充分溶解,缓慢逐滴加入2 mL的正硅酸乙酯(TEOS)。该混合体系继续在50℃下搅拌2 h,移至水热反应釜中于100℃烘箱中处理24 h,待自然冷却后12000 r·min-1离心30 min,用乙醇和去离子水分别洗涤3次,最后于60℃真空干燥18 h备用。
2)称取1.3 g上述样品加入到120 mL无水乙醇和15 mL浓盐酸中回流2 h,此操作方法重复两次,然后 12000 r·min-1离心样品 30 min,用大量无水乙醇和去离子水重复洗涤3次,最后于60℃干燥即可得到MSNs。
3)在其他试剂加入量及实验条件不变的情况下,改变TEOS和氨水的用量,得到五组MSNs样品,各组样品所用TEOS和氨水的量,如表1所示。
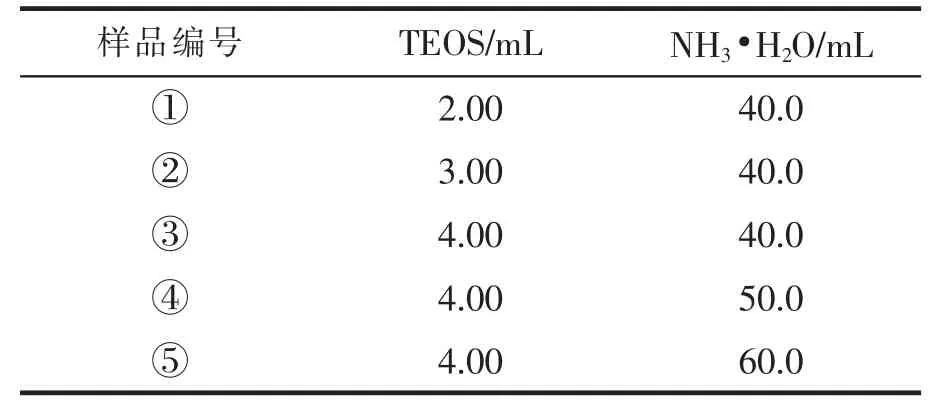
表1 样品中TEOS和NH3·H2O用量
1.2.2 载体的表征
采用ASAP 2020M型比表面及孔径分析仪分析样品的比表面积及孔道结构特性;采用红外光谱法测定样品表面官能团;采用紫外-可见分光光度计测量药物的吸收光谱。
1.2.3 姜黄素(Curcumin,Cur)载带实验
取0.5 g MSNs样品加入一定量的去离子水,磁力搅拌使其分散,转移至250 mL容量瓶中定容,得2 mg·mL-1的载体水分散液。各取20 mL于5个小烧杯中,分别滴加精密配制的不同浓度(1、2、3、4、5 mg·mL-1)的姜黄素乙醇溶液 1 mL,然后在常温下磁力搅拌24 h达到平衡,离心分离,用95%的乙醇反复洗涤3次,收集上清液,沉淀于60℃干燥12 h,即可得到载带Cur的样品,记为Cur@MSNs。
1.2.4 载药率(DLC)和包封率(EE)的测定
标准曲线的绘制:精密称量干燥的Cur 10 mg,通过无水乙醇溶解并置于100 mL容量瓶中,加无水乙醇定容至刻度配制成储备液。取5个10 mL容量瓶, 精密吸取 0.1、0.2、0.3、0.4、0.5 mL 储备液,加无水乙醇定容至刻度,分别配制成1、2、3、4、5 μg·mL-1的 Cur标准溶液, 利用紫外分光光度计于425 nm处测定吸光度。以吸光度对浓度进行线性回归得到Cur的标准曲线。如图1所示,所得Cur的标准曲线为:A=0.153C+0.0408(R2=0.9987,1≤C≤5)。
其中,A为Cur的吸光度值,C为Cur的浓度,μg·mL-1。

图1 姜黄素的标准曲线
利用紫外分光光度计在425 nm波长处测定Cur的吸光度,从而计算Cur的浓度和质量。该载体的药物载药率和包封率计算公式为[5]:

1.2.5 药物累积释放量的测定
将所制备的Cur@MSNs分别超声分散于pH=5.0和pH=7.4的PBS中37℃恒温连续搅拌(100 r·min-1),每隔 20 min 取出 5 mL 溶液测定,并且及时补充等量释药介质,将取出的样品离心后采用紫外分光光度计测定吸光度,计算姜黄素的累计释放量的计算公式为[6]:
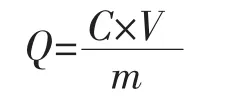
其中:Q为药物累积释放量(%);C为测定液中姜黄素的浓度(μg·mL-1);V 为稀释体积(mL)
2 结果与分析
2.1 粒度分析
本研究采用CTAB为模板剂,通过水热合成法、酸液萃取法制备出不含模板剂的MSNs,表2为各组MSNs的相关参数。从表2可知:当控制TEOS量不变的情况下,增加氨水的量,制备出的纳米材料粒径依次增大;当控制氨水量不变的情况下,增加TEOS的量,制备出的纳米材料粒径明显增大,与氨水相对比,所制备出的纳米材料变化的幅度较大。由此可见,增加TEOS的加入量对MSNs粒度影响更为显著。因此,通过改变TEOS和氨水的加入量可以更有效地控制MSNs的粒径大小。

表2 MSNs样品参数及粒径
2.2 孔道结构分析
众所周知,纳米材料的比表面积和孔隙结构是影响药物载带能力的重要因素。本研究采用氮气吸附—脱附法考察了所得纳米载体的比表面积及孔道性质,如图2所示。从图2可以看出,五个样品的氮气吸附—脱附曲线均表现出典型的IV吸附等温线特征,并带有一个典型的H1型迟滞环,说明所合成的MSNs载体均为介孔结构。当增加TEOS的用量而其他条件不变时,迟滞环发生了较小的变形,当只增加氨水的量时,迟滞环发生了较严重的变形,其形状变得更为扁平,并往低压方向移动,说明此时N2的吸附量下降,MSNs的孔道结构发生了变化[7]。同时由图3可以看出,介孔二氧化硅纳米颗粒具有较窄的孔径分布,且孔径约为10 nm,适合于药物载带。

图2 MSNs的氮气吸附-脱附曲线
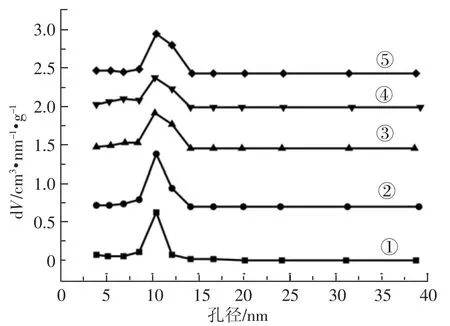
图3 MSNs的孔径分布
2.3 傅里叶变换红外光谱(FT-IR)分析
本研究进一步采用FT-IR光谱法分析了所得MSNs的表面功能基团,如图4所示。1630 cm-1归属于H-O-H键的弯曲振动,1070 cm-1归属为Si-O-Si键的不对称伸缩振动吸收峰,950 cm-1左右归属为Si-O键的伸缩振动峰,780 cm-1左右归属为Si-O-Si键的弯曲振动峰。这些特征峰的出现说明本研究成功制备得到介孔二氧化硅材料,与氮气吸附—脱附曲线相吻合。
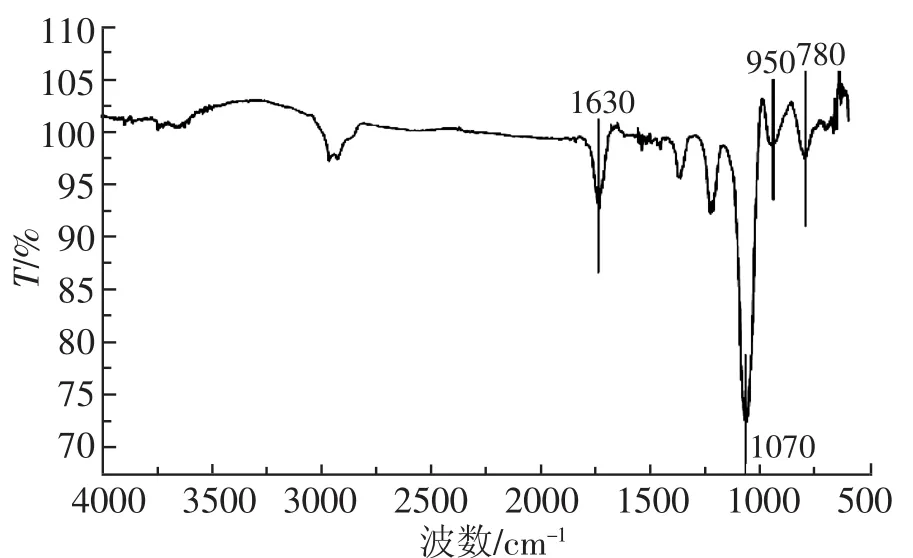
图4 MSNs的红外谱图
2.4 紫外分光光度法测定载药率和包封率
载药率(DLC)和包封率(EE)是评价纳米药物载体优劣的两个重要指标,本文以Cur为模型药物研究了MSNs的药物载带与缓释控释性能。通过测定MSNs负载姜黄素前后乙醇溶液的浓度来确定溶液中姜Cur含量,由此计算Cur的载药量,结果如表3和表4所示。结果表明:在Cur@MSNs载药实验中,当控制纳米材料粒径不变的情况下,载药量随着Cur浓度的增大而增大,包封率相反;当控制Cur浓度不变的情况下,纳米材料的粒径不断增大,其载药量也相应增大。因此,Cur浓度和介孔二氧化硅纳米材料粒径的增大都可以增加其载药量。
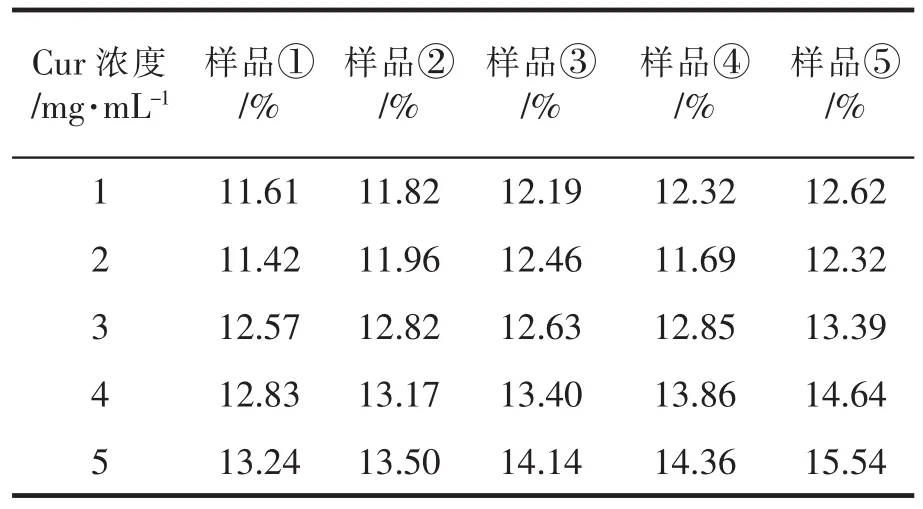
表3 各组MSNs样品的载药率

表4 各组MSNs样品的包封率
2.5 MSNs的药物释放性能
研究表明,正常人体血液循环过程的pH值为7.4左右,而肿瘤组织由于细胞繁殖过快,氧气供应不足导致产生大量酸性代谢产物,大大降低了周围微环境的pH值[8]。因此,可以利用肿瘤组织的该特征设计纳米载药系统,使其在酸性环境中快速释放药物而在生理pH条件下则释放非常缓慢[9]。表5和表6给出了Cur@MSNs在pH为7.4和5.0时的体外药物释放数据。对比表5和表6可以看出Cur@MSNs具有优良的药物缓释性能。当pH=7.4时,姜黄素释放非常缓慢,可以有效降低姜黄素对正常细胞的毒副作用;当pH=5.0时,姜黄素的释放速率大大加快,120 min后的药物累积释放量可以达到37%左右。这说明在药物释放过程中,随着pH值的降低,Cur@MSNs的释放速率变快。主要原因有以下两方面:一是随着pH值的降低,Cur@MSNs的壳越来越变得松软,有时候甚至会脱落,因此使得纳米材料孔径变得越来越大,随之药物也更容易释放出来;二是在酸性环境中,Cur与MSNs的相互作用力遭到破坏,从而促使Cur快速释放。因此,Cur@MSNs是一种非常优良的纳米药物输送体系,可有效将Cur靶向至肿瘤组织,实现癌症的靶向治疗。
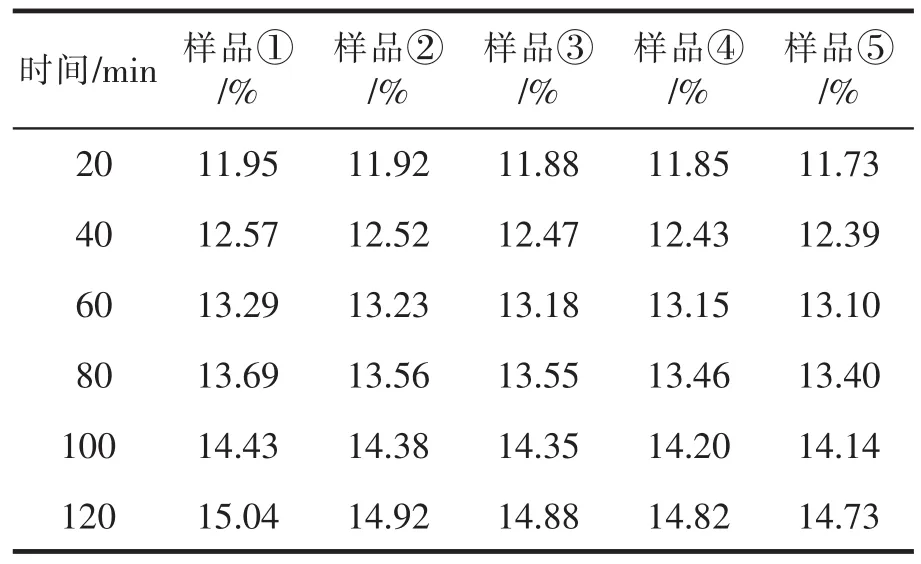
表5 pH=7.4时各组Cur@MSNs的累积药物释放率
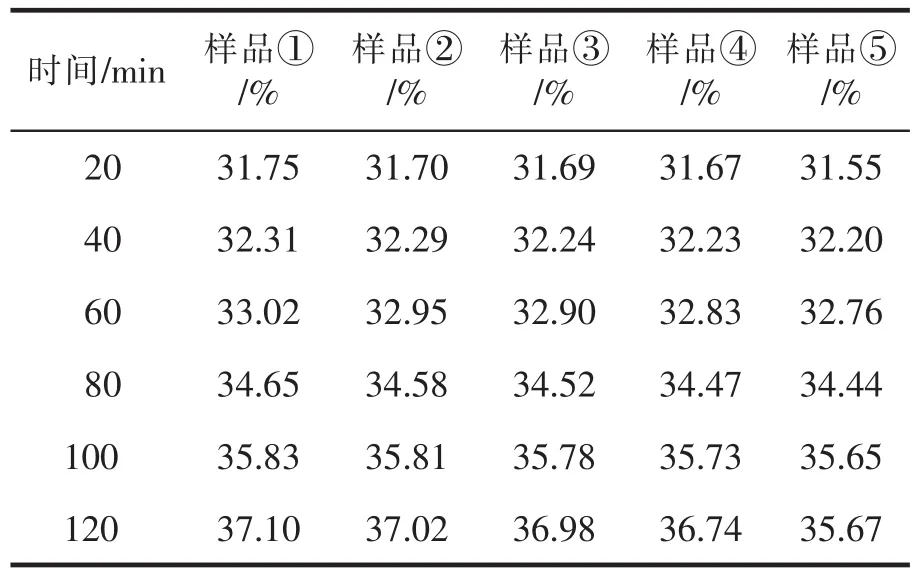
表6 pH=5.0时各组Cur@MSNs的累积药物释放率
3 结论
本文围绕介孔二氧化硅纳米材料的制备、表征、载药、体外药物释放等展开研究,实验结果发现,在不改变TEOS和氨水加入量的情况下,采用水热合成法所得介孔二氧化硅纳米材料孔径平均在50 nm左右,其中采用酸液萃取法去除表面活性剂CTAB,效果显著。孔隙结构分析可知,所制备的MSNs载体均为介孔结构,孔径分布均匀,适合于药物载带。药物载带与释放实验表明,所制备的Cur@MSNs为典型的pH响应药物载体,在生理pH条件下药物的包封率和载药率较高,而在肿瘤组织微环境中则使药物快速释放,为一种非常优良的缓控释药物载体。
参考文献:
[1]GLICKMAN M S,SAWYERS C L.Converting cancer therapies into cures:lessons from infectious diseases[J].Cell,2012,148:1089-1098.
[2]王婷婷.基于介孔二氧化硅的多功能纳米材料的制备及其在药物输送和荧光成像领域的应用[D].长春:东北师范大学,2011:1-29.
[3]郝晓红,张翠妙,刘小龙,等.基于介孔二氧化硅的多功能纳米药物输送体系研究进展[J].生物化学与生物物理进展,2013,40(10):1014-1022.
[4]贺利贞.功能化介孔二氧化硅纳米载药体系在肿瘤诊疗中的应用与机制研究[D].广州:暨南大学,2016:9-12.
[5]SHEN Z Y,LI Y,KOHAMA K,et al.Improved drug targeting of cancer cells by utilizing actively targetable folic acid-conjugated albumin nanospheres[J].Pharmacological Research,2011,63:51-58.
[6]梁旭华,樊君,孙洋,等.叶酸修饰麦角甾酮脂质体的制备及体外评价和药动学研究[J].中国药学杂志,2012,47(12):979-983.
[7]廖素婵.介孔二氧化硅纳米载体介导南蛇藤素抗喉癌作用的研究[D].长春:吉林大学,2016:20-35.
[8]SHEN Z Y,MA G H,DOBASHI T,et al.Preparation and characterization of thermo-responsive albumin nanospheres[J].International Journal of Pharmaceutics,2008,346:133-142.
[9]梁旭华.新型结构稀土上转换发光纳米材料的制备及其载药研究[D].西安:西北大学,2015:39-58.

