异烟肼对肝细胞CYP2E1和GSTP1表达的影响*
李莹淑,李金凤,张一杨,崇英之,杜 莹,李玉红,郑国颖,韩铁生,冯福民
(华北理工大学公共卫生学院 /河北省煤矿卫生与安全重点实验室,河北唐山 063000)
异烟肼(isoniazid,INH)作为抗结核治疗方案中不可替代的首选药物具有一定的肝毒性,能够引起抗结核药物性肝损伤(anti-tuberclosis drug-induced liver injury,ADLI)[1]。异烟肼通过Ⅰ相代谢酶细胞色素P450(CYP450)与Ⅱ相代谢酶谷胱甘肽(GSH)解毒,当毒性代谢产物大量生成就会耗竭肝内GSH,产生亲电子基、自由基。研究表明过量的亲电子基、自由基会激活JNK通路,造成凋亡指标JNK、Bax增加,抗凋亡指标Bcl2减少,导致细胞凋亡[2]。所以药物毒性代谢产物的积累和解毒过程取决于Ⅰ相、Ⅱ相酶之间的平衡[3]。已有研究证明CYP2E1、GSTP1基因CpG岛甲基化和基因多态性与抗结核药物性肝损伤有关,从遗传学和表观遗传学两方面说明CYP2E1、GSTP1两个基因与ADLI有关[4-6]。组蛋白乙酰化属于表观遗传学的研究范围,研究表明异烟肼给药3 d后大鼠肝脏HAT活性降低,HDAC活性升高[7]。本实验旨在研究异烟肼、乙酰化酶抑制剂Garcinol及去乙酰化酶抑制剂TSA引起的肝细胞组蛋白乙酰化水平改变对药物代谢酶CYP2E1、GSTP1表达的影响,为有效预防及治疗ADLI提供新的参考。
1 材料与方法
1.1实验材料 人正常肝细胞HL-7702购自上海中科院。用含90%RPMI 1640(CORNING)、10%胎牛血清(CLARK)、1%双抗的培养液作为HL-7702细胞的培养基,细胞放置于5%CO2、37 ℃细胞培养箱中进行培养。
1.2仪器与试剂 异烟肼(日本TCI公司),Garcinol(Cayman公司),TSA(TCI公司),二甲基亚砜(DMSO,TCI公司),TRI Pure Reagent 总RNA抽提试剂盒(北京百泰克公司),Prime ScriptTMRT Master Mix试剂盒、SYBR®Premix Ex TaqTMⅡ PCR试剂盒(大连TaKaRa公司),丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)试剂盒(南京建成生物工程研究所),HAT酶活性试剂盒、HDAC酶活性试剂盒、CYP2E1蛋白含量试剂盒、GSTP1蛋白含量试剂盒(北京绿源大德生物科技有限公司)。Heraeus高速冷冻离心机(德国Thermo Scientific公司)C1000PCR扩增仪(美国BIO-RAD公司),荧光定量PCR仪(美国Applied Biosystems 公司),CA94089型连续光谱酶标仪(美国Molecular Devices分子仪器公司)。
1.3方法
1.3.1细胞培养 取对数生长期细胞,调整细胞浓度为1×105/mL,接种于6孔板上,每孔2 mL,分为6组,分别为对照组、INH组、INH+Garcinol组、Garcinol组、INH+TSA组、TSA组,每组6个副孔于6孔板中培养24 h后分别加入药物和抑制剂,药物浓度为800 g/L,Garcinol浓度为5 μmol/L,TSA浓度为1 μmol/L。3 h后收集细胞及细胞培养液进行检测。
1.3.2肝功能指标ALT、AST水平的检测 收集细胞培养上清液,严格按照ALT、AST检测试剂盒说明书操作,测定各指标水平。
1.3.3肝细胞HAT、HDAC酶活性检测 收集细胞离心后弃上清液,加入细胞裂解液4 ℃震荡20 min,14 000 r/min离心15 min取上清液,严格按照ELISA试剂盒说明书检测HAT、HDAC活性。
1.3.4肝细胞CYP2E1、GSTP1、JNK、Bax、Bcl-2 mRNA检测 收集细胞,常规 TRIzol法提取总RNA,反转录和实时荧光定量 PCR严格按照试剂盒说明书进行操作。以GAPDH为内参,用 来表示各RNA的相对表达量。引物均由上海生工合成,其序列见表1,反转录反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 1 min;定量PCR反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。
1.3.5肝细胞CYP2E1、GSTP1蛋白检测 收集细胞离心弃上清液,加入细胞裂解液4 ℃震荡20 min,14 000 r/min离心15 min取上清液,CYP2E1 和GSTP1 蛋白含量采用酶联免疫吸附试剂盒进行检测,严格按照试剂盒说明书操作。


表1 扩增基因和引物序列
2 结 果
2.1INH、Garcinol及TSA对肝细胞ALT、AST的影响 INH组与对照组相比ALT、AST酶活性增加(P<0.05),Garcinol组、TSA组分别与对照组ALT、AST酶活差异无统计学意义(P>0.05),提示异烟肼造成肝细胞损伤,Garcinol与TSA对肝细胞无影响;INH+Garcinol与INH组相比ALT、AST酶活性降低(P<0.05);INH+TSA与INH组相比ALT、AST酶活性降低(P<0.05),见图1。
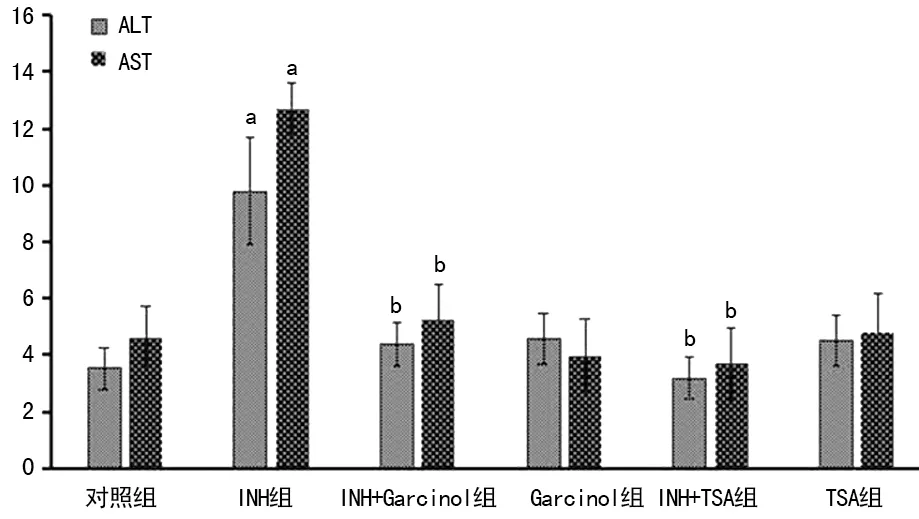
a:P<0.05,与对照组比较;b:P<0.05,与INH组比较
图1各组细胞上清液中ALT、AST含量比较
2.2INH及抑制剂对肝细胞HAT活性和HDAC活性的影响 与对照组相比INH组肝细胞HAT活性降低(P<0.05),Garcinol组肝细胞HAT活性降低(P<0.05)(图2A),与对照组相比INH组肝细胞HDAC活性增加(P<0.05),TSA组HDAC活性降低(P<0.05)(图2B),提示INH影响肝细胞乙酰化的平衡,且Garcinol与TSA对HAT、HDAC分别有抑制作用;INH+Garcinol组与INH组比HAT活性降低(P<0.05)(图2A)。INH+TSA组与INH组比HDAC活性降低(P<0.05)(图2B)。

A:各组细胞HAT活性比较;B:各组细胞HDAC活性比较;a:P<0.05,与对照组比较;b:P<0.05,与INH组相比
图2各组细胞上清液中HAT、HDAC酶活性比较
2.3INH及抑制剂对肝细胞CYP2E1、GSTP1 mRNA和蛋白含量的影响 INH组与对照组比较CYP2E1 mRNA和蛋白表达量均增加(P<0.05),GSTP1 mRNA和蛋白表达量均减少(P<0.05),INH+Garcinol组与INH组比CYP2E1 mRNA和蛋白表达量都减少(P<0.05),GSTP1 mRNA和蛋白表达量均减少(P<0.05)其他组与对照组比较差异无统计学意义(P>0.05)。INH+TSA组与INH组比CYP2E1mRNA和蛋白表达量均增加(P<0.05),GSTP1 mRNA和蛋白表达量均增加(P<0.05),TSA能逆转INH导致的GSTP1降低,但也使INH导致升高的CYP2E1继续增加,见图3。
2.4INH、Garcinol及TSA对肝细胞JNK、Bax、Bcl2 mRNA的影响 INH组与对照组相比JNK mRNA、
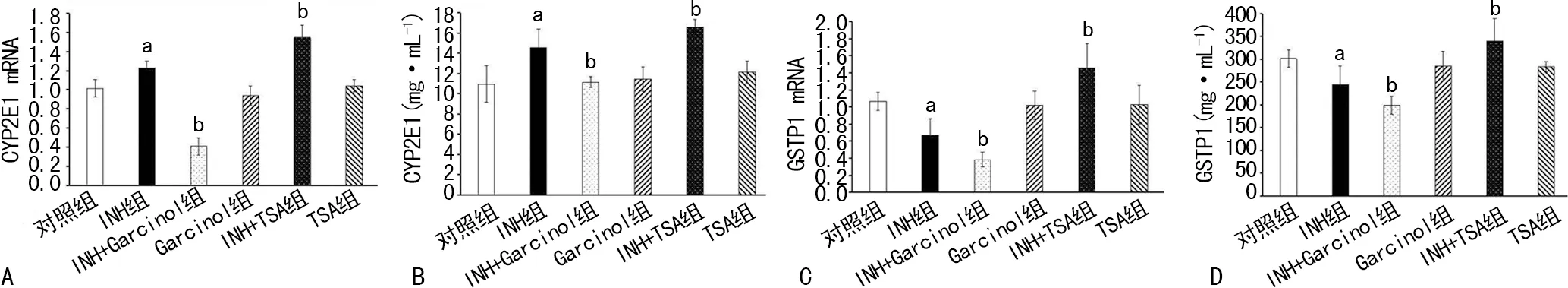
A:CYP2E1;B:CYP2E1 mRNA;C:GSTP1;D:GSTP1 mRNA;a:P<0.05,与对照组比较;b:P<0.05,与INH组比较
图3各组CYP2E1 mRNA、CYP2E1蛋白、GSTP1 mRNA、GSTP1蛋白比较
Bax mRNA增加,Bcl2 mRNA减少(P<0.05),INH+Garcinol组与INH+TSA组分别与INH组相比JNK mRNA、Bax mRNA减少(P<0.05),Bcl2 mRNA增加(P<0.05),见图4。

a:P<0.05,与对照组比较;b:P<0.05,与INH组相比。
图4各组JNK mRNA、Baxm RNA、Bcl-2 mRNA水平比较
3 讨 论
组蛋白乙酰化修饰是动态可逆的,HAT和HDAC共同调节,HAT通过将乙酰辅酶A上的乙酰基转移到组蛋白氨基端特定的赖氨酸残基上完成乙酰化修饰[8-10]。在药物性肝损伤的研究中,组蛋白乙酰化被证实参与到肝损伤的发生过程中[11]。本研究发现INH作用肝细胞3 h后肝损伤指标ALT、AST增加,同时HAT活性降低HDAC活性增加,这与本团队之前在大鼠实验中的出的结论一致。研究报道Garcinol对 LPS/D-Gal 诱导的肝损伤具有保护作用,这一保护效应不伴随有肝内炎症因子的表达降低,可能通过抑制 p53 的乙酰化修饰、降低其活性,从而下调促凋亡蛋白Bax、抑制肝细胞凋亡[12]。TSA是一种组蛋白去乙酰化酶抑制剂,能使肝癌细胞CYP2E1表达增加促进肝癌细胞凋亡[13]。本实验中Garcinol与TSA分别对HAT与HDAC活性有抑制作用。
CYP2E1和GSTP1为Ⅰ、Ⅱ相药物代谢酶CYP450和GST家族的重要成员,研究已发现,其基因多态性与ADLI有关,可以作为疾病诊断及预后的潜在分子生物标志物。CYP2E1在人肝脏中含量最为丰富[4-6],并且富集于肝小叶中心区域,人类CYP2E1是细胞色素P450超家族中的重要成员之一,约占P450总量的7%左右[14-15],参与多种药物的代谢,大约有60%的药物是由通过CYP450的作用清除的。GSTP1为体内Ⅱ相物质代谢酶,催化GSH与亲电子物质结合,将之转化为亲水性物质,经尿液或胆汁排出体外,这一过程为解毒反应。本研究中INH致肝细胞CYP2E1 mRNA及蛋白增加,GSTP1 mRNA及蛋白减少,说明INH可能改变Ⅰ、Ⅱ相药物代谢酶的表达和翻译,HAT活性降低HDAC活性增加可以抑制基因表达,本实验中INH导致GSTP1降低,但CYP2E1表达增加,由于乙酰化酶家族和去乙酰化家族包括很多酶,本实验检测的总的HAT活性的变化是降低的,当抑制HAT活性后CYP2E1的表达会降低,笔者推断可能作用在CYP2E1基因启动子区的某种乙酰酶是升高的。
CYP450在抗结核药物代谢肝脏解毒过程中发挥重要作用,研究报道CYP2E1可以通过其代谢产物自由基激活JNK通路导致凋亡进而引起肝损伤[2]。本研究中INH组与对照组相比凋亡指标JNK、Bax表达增加,抗凋亡指标Bcl2表达减少说明肝细胞发生了凋亡。INH+Garcinol组与INH+TSA组分别与INH组相比JNK、Bax表达减少,抗凋亡指标Bcl2表达增加,说明Garcinol与TSA均能逆转凋亡。出现此变化可能由于Carcinol使CYP2E1和GSTP1表达均减少,降低INH代谢产生的毒性代谢产物;而TSA使CYP2E1和GSTP1表达均增加,促进毒性代谢产物的代谢而解毒。
综上所述,INH致肝损伤的原因可能是HAT与HDAC活性改变进而影响药物代谢酶CYP2E1、GSTP1的转录和表达的改变。对于组蛋白乙酰化是如何具体调控CYP2E1、GSTP1表达的机制仍需深入研究,为ADLI的预防和治疗提供更详尽的证据。
[1]JASWAL A,SINHA N,BHADAURIA M,et al.Therapeutic potential of thymoquinone against anti-tuberculosis drugs induced liver damage[J].Environ Toxicol Pharmacol,2013,36(3):779-786.
[3]YEW W W,LEUNG C C.Antituberculosis drugs and hepatotoxicity[J].Respirology,2006,11(6):699-707.
[2]SCHATTENBERG J M,CZAJA M J.Regulation of the effects of CYP2E1-induced oxidative stress by JNK signaling[J].Redox Biol,2014(3):7-15.
[4]ZHANG J,ZHU X,LI Y,et al.Correlation of CpG island methylation of the cytochrome P450 2E1/2D6 genes with liver injury induced by Anti-Tuberculosis drugs:a nested Case-Control study[J].Int J Environ Res Public Health,2016,13(8):776.
[5]HE L,GAO L,SHI Z,et al.Involvement of cytochrome P450 1A1 and glutathione S-transferase P1 polymorphisms and promoter hypermethylation in the progression of anti-tuberculosis drug-induced liver injury:a case-control study[J].PLoS One,2015,10(3):e0119481.
[6]陈怡,郭梅,李世明,等.细胞色素P450 2E1基因多态性与抗结核药致肝损伤的关系[J].中华传染病杂志,2010,28(12):748-752.
[7]朱凌妍,李玉红,任琦,等.异烟肼致大鼠肝损伤使组蛋白H4低乙酰化[J].中国药理学与毒理学杂志,2016,30(11):1192-1197.
[8]GRAEFF J,TSAI L H.Histone acetylation:molecular mnemonics on the chromatin[J].Nat Rev Neurosci,2013,14(2):97-111.
[9]YUN M Y,WU J,WORKMAN J L,et al.Readers of histone modifications[J].Cell Res,2011,21(4):564-578.
[10]LI B,CAREY M,WORKMAN J L.The role of chromatin during transcription[J].Cell,2007,128(4):707-719.
[11]MURATA K,HAMADA M,SUGIMOTO K,et al.A novel mechanism for drug-induced liver failure:inhibition of histone acetylation by hydralazine derivatives[J].J Hepatol,2007,46(2):322-329.
[12]JING Y,AI Q,LIN L,et al.Protective effects of garcinol in mice with lipopolysaccharide/D-galactosamine-induced apoptotic liver injury[J].Int Immunopharmacol,2014,19(2):373-380.
[13]YANG H,NIE Y,LI Y,et al.Histone modification-mediated CYP2E1 gene expression and apoptosis of HepG2 cells[J].Exp Biol Med (Maywood),2010,235(1):32-39.
[14]TAO N N,ZHOU H Z,TANG H,et al.Sirtuin 3 enhanced drug sensitivity of human hepatoma cells through glutathione S-transferase pi 1/JNK signaling pathway[J].Oncotarget,2016,7(31):50117-50130.
[15]JORGENSEN R A,CLUSTER P D,ENGLISH J,et al.Chalcone synthase cosuppression phenotypes in petunia flowers:comparison of sense vs.antisense constructs and single-copy vs.complex T-DNA sequences[J].Plant Mol Biol,1996,31(5):957-973.

