系统性红斑狼疮合并间质性肺炎的临床特征及相关危险因素分析*
陈晓芳,杨 敏△,赵进军,赖伟男,郝 鹏
(南方医科大学南方医院:1.风湿免疫科;2.影像中心,广州 510515)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多系统、多器官且有多种自身抗体出现的自身免疫疾病,肺脏是较常见的受累器官,SLE出现肺部病变主要有狼疮肺炎、亚急性间质性肺炎、慢性间质性肺炎及血管炎等[1]。间质性肺炎是SLE常见的合并症,是SLE患者预后不良的重要因素之一[2]。间质性肺炎的主要病理学改变是肺泡、肺间质及支气管周围组织不同程度的炎性反应和纤维化,最终可导致有效肺通气单位的减少甚至呼吸衰竭,严重影响患者的生存质量。早期启动免疫抑制剂的治疗,可明显改善SLE患者的预后。因此,早期诊断间质性肺炎或早期诊断预后不良的间质性肺炎,对于干预或改善患者的预后十分重要。本研究旨在探讨SLE合并间质性肺炎(SLE-IP)的临床特征及相关危险因素,以便疾病的早期诊断和治疗。
1 资料与方法
1.1一般资料 选取2013年1月至2016年1月本院明确诊断并住院治疗的40例SLE-IP患者为间质性肺炎组,并选择年龄、性别等相匹配的40例SLE未合并间质性肺炎的患者作为对照组。比较两组患者的临床表现、常规检查、生化检查和免疫学检查结果,分析SLE-IP发生的危险因素。间质性肺炎组中女34例,男6例,年龄15~67岁,平均(35.45±13.40)岁;对照组中女33例,男7例,年龄17~64岁,平均(37.85±16.65)岁。
1.2纳入标准 80例SLE患者均符合1997年美国风湿病学会(ACR)修订的分类诊断标准[3]。间质性肺炎需结合临床症状、影像学、肺功能、病理综合诊断,参照2013年美国胸科学会、欧洲呼吸学会(ATS-ERS)共同发布的特发性肺纤维化的分类标准[4]:(1)静息或者活动后气促;(2)干咳或者肺部听诊闻及Velcro啰音;(3)与临床症状相符的肺间质病变影像学表现,如双肺外周出现磨玻璃样阴影、蜂窝影、小叶间隔增厚或者多种表现混合;(4)肺功能检查显示限制性通气和(或)肺换气功能障碍;(5)肺脏病理符合2002年欧洲学会制定的肺间质病变的病理表现。符合以上5项中3项或者3项以上者可诊断为间质性肺炎。
1.3排除标准 (1)排除由职业、环境、药物、遗传等其他因素引起的间质性肺炎。(2)排除合并经临床或者实验室确诊的其他结缔组织病。(3)排除合并其他心肺疾病,如肺部肿瘤、肺结核、慢性阻塞性肺气肿、肺动脉高压、先天性心脏病、左心衰竭等。(4)排除重型SLE,包括:①冠状动脉血管受累,Libman-Sacks心内膜炎,心肌炎,心包填塞,恶性高血压;②肺动脉高压,肺出血,肺炎,肺梗死,肺萎缩等;③肠系膜血管炎,急性胰腺炎;④溶血性贫血,粒细胞减少,血小板减少(<50×109/L),血栓性血小板减少性紫癜,动静脉血栓形成;⑤肾小球肾炎持续不缓解,急进性肾小球肾炎,肾病综合征;⑥抽搐,急性意识障碍,昏迷,脑卒中,横贯性脊髓炎,单神经炎/多神经炎,精神性发作,脱髓鞘综合征;⑦皮肤血管炎,弥漫性严重的皮损、溃疡、大疱,肌炎,非感染性高热有衰竭表现等。(5)排除狼疮危象,即指急性的危及生命的重症SLE,包括急进性狼疮性肾炎、严重的中枢神经系统损害、严重的溶血性贫血、血小板减少性紫癜、粒细胞缺乏症、严重的心脏损害、严重的狼疮性肺炎、严重的狼疮性肝炎、严重的血管炎等。
1.4研究方法 (1)临床表现及实验室检查:记录SLE患者的相关临床表现,包括发热、皮疹、口腔溃疡、关节炎、雷诺现象、干咳、胸闷/气短、湿啰音等。实验室检测指标包括血常规、肝功能、肾功能、血脂、红细胞沉降率(ESR)、C反应蛋白(CRP)、24 h尿蛋白定量测定(24 h UP)、自身免疫抗体定性[抗核抗体(ANA)、双链DNA抗体(ds-DNA)、Sm抗体、SSA抗体、SSB抗体、U1-nRNP抗体、核糖体P蛋白抗体、心磷脂抗体(ACA)]、C3、C4等检验。(2)高分辨CT(HRCT)检查:80例SLE患者均采用德国西门子双源CT扫描方式完成图像数据的采集,扫描范围从肺尖至膈下,分别以主动脉弓层、气管分叉层、横膈上层为中下肺野的代表层面,由经验丰富的放射科医师选取各层面观察肺部间质性病变,对有肺部病变者由风湿科医师结合临床进行复读合议。根据2013年ATS-ERS对特发性间质性肺炎共同颁发的新分类,本研究中40例SLE-IP患者的HRCT表现可见寻常型间质性肺炎(UIP)、非特异性间质性肺炎(NSIP)和未定型3型。

2 结 果
2.1间质性肺炎组HRCT表现及分型 本研究中40例SLE-IP患者,NSIP型16例,UIP型9例,未定型15例。NSIP HRCT表现为两肺磨玻璃样阴影,常为两侧胸膜下对称性,患者中约1/3的人群仅表出两肺磨玻璃样阴影。UIP HRCT常表现为胸膜下及双肺基底部出现病变,网格状影、蜂窝影多见。SLE-IP影像学分型以NSIP多见,UIP次之。间质性肺炎改变最常见的是磨玻璃样阴影,其次是网格状影和小结节影,蜂窝影最少见(表1)。从分布上看,磨玻璃样阴影均匀出现在肺部上、中、下肺野和内外带,网格状影、蜂窝影多分布于肺部下野和外带,这与NSIP型、UIP型的分布特点相似(表2)。

表1 40例SLE-IP患者的HRCT影像学分型(n)
2.2间质性肺炎组与对照组的一般情况对比 两组患者的性别、年龄、病程(<1年)、吸烟史、SLE疾病活动指数(SLEDAI)评分差异无统计学意义(P>0.05),见表3。
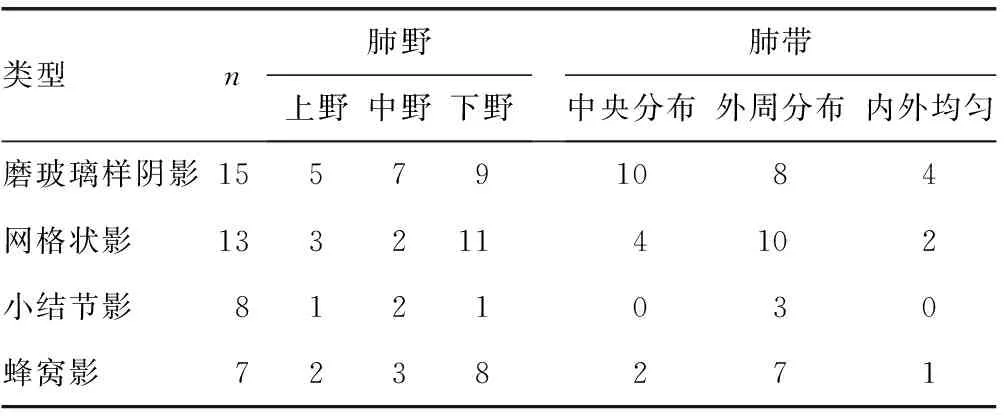
表2 40例SLE患者肺部间质性改变的分布情况(n)
上、中、下肺野:分别为主动脉弓水平、气管分叉水平及横膈上方水平;中央分布:接近肺门的1/3区域;外周分布:病变累及近侧胸壁与胸膜的1/3区域
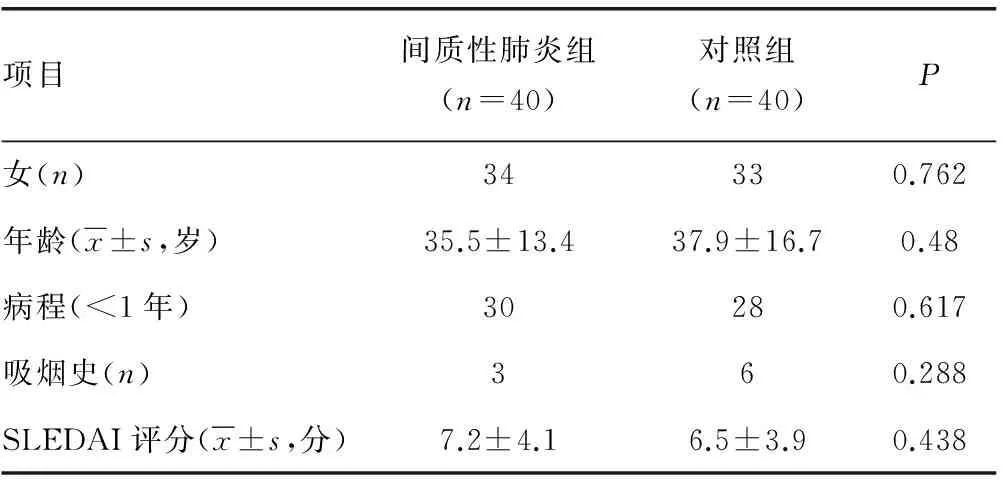
表3 两组一般情况及SLEDAI评分的比较
2.3间质性肺炎组与对照组的临床症状和体征比较 与对照组相比,间质性肺炎组患者干咳、胸闷/气短、雷诺现象、湿啰音出现的比例更高,差异有统计学意义(P<0.05),发热、皮疹、关节炎、口腔溃疡、光过敏比较差异无统计学意义(P>0.05),见表4。
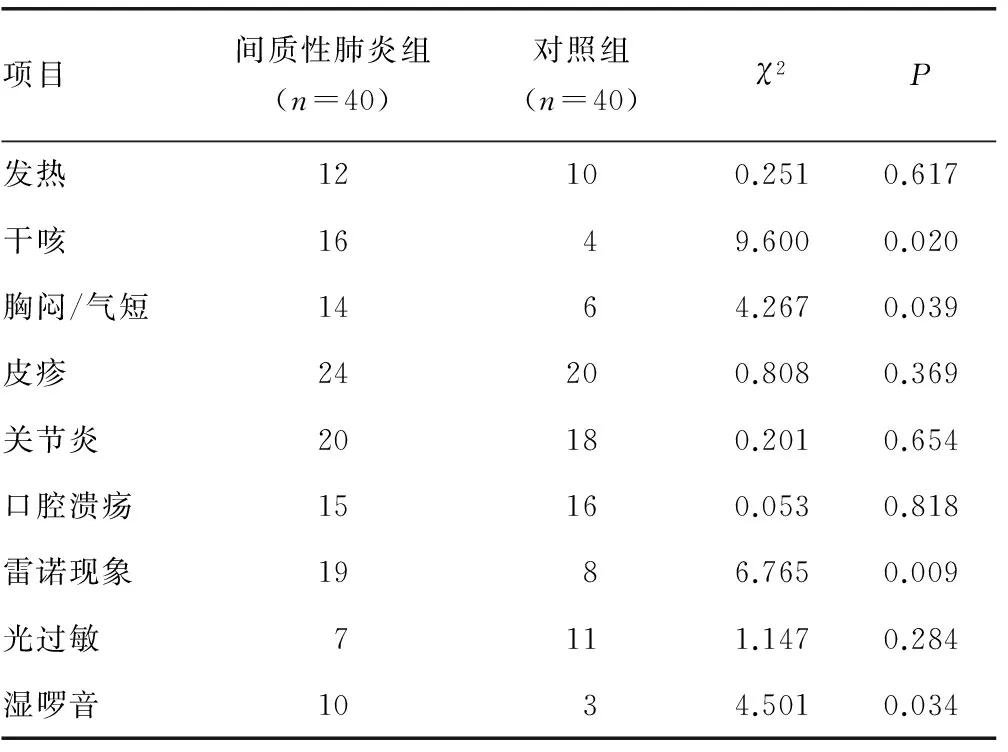
表4 两组临床症状和体征比较(n)
2.4间质性肺炎组与对照组的实验室指标比较 间质性肺炎组与对照组相比,三酰甘油升高、Sm抗体阳性率、U1-nRNP抗体阳性率差异有统计学意义(P<0.05)。白细胞下降、血小板下降、血红蛋白下降、丙氨酸氨基转移酶(ALT)升高、天门冬氨酸氨基转移酶(AST)升高、清蛋白下降、尿酸升高、尿素氮升高、肌酐升高、低密度脂蛋白升高、高密度脂蛋白下降, 24 h尿蛋白定量升高、C3下降、 C4下降差异无统计学意义(P>0.05),见表5。
2.5SLE-IP影响因素的多因素Logistic回归分析 对于上述有统计学意义的指标进行多因素Logistic回归分析,结果显示:干咳(OR6.000;95%CI1.787~20.147;P=0.004)、胸闷/气短(OR3.651;95%CI1.032~9.022;P=0.044)、雷诺现象(OR3.619;95%CI1.341~9.765;P=0.011)、湿啰音(OR4.111 ;95%CI1.037~16.295;P=0.044)、三酰甘油升高(OR3.273;95%CI1.211~8.844 ;P=0.019)、U1-nRNP抗体阳性(OR3.444;95%CI1.310~9.508;P=0.012)、Sm抗体阳性(OR3.000;95%CI1.164~7.732;P=0.023)进入多元回归方程,是间质性肺炎发生的危险因素,见表6。
3 讨 论
SLE-IP的发病机制尚不清楚,文献[5]报道其可能与血管炎有关,血管壁的免疫复合物激活补体并释放中性粒细胞趋化因子,导致中性粒细胞在局部集聚并释放出大量胶原酶和自由基,逐渐破坏肺实质,导致肺泡炎和胶原广泛破坏,最终造成不可逆的肺间质纤维化。目前国内外尚无SLE-IP的统一诊断标准,2013年美国胸科协会和欧洲呼吸协会(ATS-ERS)重新修订了特发性间质性肺炎的分类标准,提高了特发性间质性肺炎的诊断水平,但是SLE-IP的早期临床表现较隐匿,影像学分型及病理分型复杂多变,且国内肺活检病理检查开展极少,不易完全依照上述标准分类。
HRCT检查灵敏度高达80%以上[6],能分辨各种间质性肺炎的征象,可以对病变进行随访和疗效评估。有研究证实,HRCT结果与肺活检病理结果一致[7]。本研究40例SLE-IP中NSIP型16例,UIP型9例,未定型15例。NSIP HRCT表现为肺磨玻璃样阴影,常为两侧胸膜下对称性,患者中约1/3的人群仅表出两肺磨玻璃样阴影。UIP HRCT常表现为胸膜下及双肺基底部出现病变,网格状影、蜂窝影多见。SLE-IP影像学分型以NSIP多见,UIP次之。分型与疾病的预后相关,间质性肺炎预后不良的最重要因素是纤维化的存在。UIP成纤维细胞灶较多,因而其预后较差,有文献报道类风湿关节炎相关的间质性肺炎,UIP最易出现急性加重,其临床、影像学与病理学的特征与特发性纤维化急性加重相似,预后很差[8];NSIP较UIP少有纤维化,其预后较好,5年生存率可达80%以上[9]。因此,HRCT检查对于早期间质性炎症的诊断具有重要意义,可指导治疗和评估预后,减少有创检查给患者带来的风险。
本研究发现间质性肺炎组患者病程中出现干咳、胸闷/气短、雷诺现象和湿啰音的比例高于对照组,差异有统计学意义,这说明详细认真地询问患者的病史和体格检查,对临床判断病情有着重要意义,提示临床医生对于SLE患者应注意详细搜集病史,并且完善相关体格检查,以便早期发现SLE相关间质性肺炎,减少漏诊或误诊。SLEDAI评分是临床上常用的SLE活动的评判标准。本研究发现SLE间质性肺炎组与对照组在SLEDAI评分上差异无统计学意义。
高脂血症是指空腹血清或者血浆中总胆固醇、三酰甘油、低密度脂蛋白单项或者多项超过正常范围,以上指标单个或者多个指标升高常常伴有高密度脂蛋白的降低。目前,我国高脂血症的发生率为18.6%,已不再被单纯看作心脑血管疾病的病理基础,其对机体各组织器官造成的损害和引起的复杂的并发症越来越受到重视。高脂血症对肺部的损伤主要为肺动脉病变(血管内皮损伤、肺重构等)及肺部炎症损伤(间质性肺炎、肺胆固醇性肉芽肿样改变肺炎等),这些改变可能跟氧化应激反应、自由基损伤、炎性反应、脂质过氧化及内皮损伤等有关。有文献报道大多数高脂血症家兔出现了间质性肺炎,少数则出现急性肺水肿。此外,杜兴贵等[10]通过观察40只高脂血症家兔的肺组织发现间质性肺炎23例(占57.5%)与胆固醇性肉芽肿性肺炎5例(占12.5%),认为高脂血症可诱发家兔的肺部炎症病变。在没有长期服用糖皮质激素的情况下,SLE患者可出现继发性血脂升高,表现为代谢综合征[11-12]。本研究中三酰甘油在两组患者中的差异有统计学意义。相关研究发现高脂血症能够引起家兔肺组织损伤,主要表现为间质性肺炎和血管病变,这可能与脂质过氧化和一氧化氮合酶(NOS)、血管紧张素Ⅱ(AngⅡ)异常表达有关[13-14]。高脂血症不但可以引起心血管系统、肾脏、肝脏等脏器的病变,还可以导致间质性肺炎、肺动脉粥样硬化、肺重构等[15-17]。这些病变若长期发展下去,有增加其他各种严重并发症的风险,如肺动脉高压、肺纤维化、右心室肥大等。因此,在临床诊疗中,应早期筛查血脂4项,针对高脂血症患者及时纠正血脂水平,合理使用激素,对于降低间质性肺炎的发生率有重要意义。
Sm抗体是诊断SLE的标志性抗体,特异度可达90%,敏感性较低,有助于SLE早期或者不典型患者的诊断。Sm抗体跟狼疮活动无相关性,可能有预后上的价值。U1-nRNP抗体在SLE患者中阳性率为30%~40%。林俊等[18]报道,以雷诺现象为首发症状的SLE患者出现浆膜炎、Sm抗体、U1-nRNP抗体阳性的比例明显高于非雷诺现象首发者。雷诺现象不但可以发生在肢体末端,而且可以出现在内脏血管,例如肺脏、心脏,肺小血管反复痉挛是造成肺部缺血、肺纤维化的原因之一。国内李结华等[19]报道,Sm抗体阳性组的U1-nRNP抗体阳性率达67.75%,二者有较好的相关性。通过Logistic回归分析,本研究发现干咳、胸闷/气短,雷诺现象、湿啰音、三酰甘油升高、Sm抗体阳性、U1-nRNP抗体阳性是发生SLE-IP的危险因素,提示合并这些危险因素的SLE患者更容易发生间质性肺炎,临床医生应警惕其间质性肺炎的发生,尤其是病变早期。SLE-IP在早期诊断上存在困难,其容易与肺部感染相混淆,因此,充分掌握SLE-IP的临床表现、影像学表现及相关危险因素等,明确其诊断标准,对于早期诊断、早期治疗及改善患者预后具有重要意义。
[1]菅向东,潘正论.系统性红斑狼疮相关肺间质病变[J].山东医药,1994,47(32):51-52.
[2]SAKETKOO L A,MATTESON E L,BROWN K K,et al.Developing disease activity and response criteria in connective tissue disease-related interstitial lung disease[J].J Rheumatol,2011,38(7):1514-1518.
[3]HOCHBERG M C.Updating the American college of rheumatology revised criteria for the classification of systemic lupus erythematosus[J].Arthritis Rheum,1997,40(9):1725.
[4]TRAVIS W D,COSTABEL U,HANSELL D M,et al.An official American Thoracic Society/European Respiratory Society statement:Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias[J].Am J Respir Crit Care Med,2013,188(6):733-748.
[5]黄文群,陈顺乐.100例系统性红斑狼疮患者的肺间质病变初探[J].上海医学,1994,23(5):51-52.
[6]WALSH S L,HABSELL D M.High-resolution CT of interstitial lung disease:a continuous evolution[J].Semin Respir Crit Care Med,2014,35(1):129-144.
[7]HUNNINGHAKE G W,LYNCH D A,GALVIN J R,et al.Radiologic findings are strongly associated with a pathologic diagnosis of usual interstitial pneumonia[J].Chest,2003,124(4):1215-1223.
[8]张德平,康健.结缔组织病相关性间质性肺炎与特发性间质性肺炎的鉴别[J].中华结核和呼吸杂志,2009,32(7):532-534.
[9]POVYSIL C.Histopathological classification of idiopathic interstitial pneumonias[J].Cesk Patol,2010,46(1):3-7.
[10]杜兴贵,王勤.实验性家兔肺动脉粥样硬化的病理组织学观察[J].湖北医药学院学报,1997,16(3):121-123.
[11]STRWN W B,FERRARIO C M.Mechanisms linking angiotensin Ⅱ and atherogenesis[J].Curr Opin Lipidol,2002,13(5):505-512.
[12]COOK S.Coronary artery disease,nitric oxide and oxidative stress:the "Yin-Yang" effect--a Chinese concept for a worldwide pandemic[J].Swiss Medical Weekly,2006,136(7/8):103-113.
[13]周建红.脂质异常家兔抗氧化能力与血管细胞黏附因子-1的变化以及血脂康对其影响[J].天津药学,2010,22(1):1-3.
[14]刘和亮,赵金垣.氧化应激和肺损伤[J].中国职业医学,2002,29(5):49-51.
[15]刘晓华,成守珍,张瑞芳.健康体检人群高脂血症相关知识调查分析[J].中华护理杂志,2006,41(9):852-854.
[16]朱一堂.脂肪肝发生与高脂血症的相关性调查[J].检验医学,2006,21(4):352-354.
[17]陈秀华.心脑血管疾病的一级二级预防[J].基层医学论坛,2009,13(29):943-944.
[18]林俊,刘湘源,黄次波,等.伴雷诺现象的系统性红斑狼疮42例分析[J].中华皮肤科杂志,2001,34(1):12-14.
[19]李结华,叶冬青,杨世贵,等.Sm抗体阳性系统性红斑狼疮临床特征分析[J].实用医学杂志,2004,20(1):20-22.

