CM-Dil标记示踪间充质干细胞可行性的体外试验*
陈小莹,李欣然,王清,付霞霏
(南方医科大学珠江医院妇产科,广州 510282)
干细胞是一类能自我增殖、具有多向分化潜能的细胞,由于其临床应用的可行性及其生物学的重要特性,干细胞治疗成为现代医学研究领域的热点[1]。间充质干细胞(mesenchymal stem cells,MSCs)具有取材容易、可自身移植避免免疫排斥等优点,已被广泛应用于组织工程和细胞治疗的研究中[2]。而在深入进行细胞移植实验前应对移植的 MSCs 进行标记以起到体内示踪的作用。本试验采用细胞膜荧光染料氯苯甲酰氨-1,1′双十八烷基-3,3′,3′,3′-四甲基吲哚羰基花青高氯酸盐(CM-Dil)标记大鼠骨髓间充质干细胞,并进行体外传代培养,观察其标记情况,为进一步利用MSCs进行移植研究提供实验基础。
1 材料与方法
1.1实验动物 4周龄近交系SPF级Wistar雌性大鼠,体质量80 g,购自南方医科大学实验动物中心[许可证号:SYXK(粤)2011-0074]。
1.2材料 Wistar大鼠骨髓间充质干细胞及其完全培养基购自广州赛业生物科技有限公司、 PBS 缓冲液购自Hyclone公司、胰蛋白酶购自 Gibco 公 司、 CM-Dil标记液购自Thermo Fisher Scientific公司、细胞计数Kit-8(CCK8)试剂盒购自日本Dojindo公司。
1.3方法
1.3.1骨髓间充质干细胞的分离培养 无菌条件下分离大鼠双侧股骨及胫骨,用剪刀从中间剪断股骨及胫骨,用5 mL注射器抽取适量含 10%胎牛血清的专用培养基冲洗骨髓腔,将所得细胞悬液直接接种于T-25 cm2培养瓶中,细胞浓度约为1×109/L。置于37 ℃、5% CO2培养箱中常规培养。48 h后半量更换完全培养基。以后每2~3天全量更换新鲜培养基,待细胞融合约80%时可进行1∶2传代,用0.25%胰酶消化,以5×104/cm2细胞浓度传代扩增。用倒置显微镜观察细胞形态,取第3代细胞用于以下试验。
1.3.2骨髓间充质干细胞的鉴定 将贴壁细胞制成单细胞悬液,用流式细胞仪检测细胞表面标记CD34、CD29、CD45、CD44。
1.3.3CM-Dil标记骨髓间充质干细胞 试验分4组:MSC组、标记组1(1 μg/mL)、标记组2(2 μg/mL)、标记组3(4 μg/mL)。将细胞消化制成细胞浓度约为1×106/mL的细胞悬液,标记组1~3分别加入适量1 mg/L的 CM-Dil存储液,使其最终浓度分别达1、2、4 μg/mL,随后置于培养箱37 ℃下孵育30 min,1 000 r/min 离心5 min,弃上清液,PBS冲洗2遍,用完全培养基重悬接种于培养瓶。
1.3.4CM-Dil标记率的观察 标记完成后15 min继续孵育24、48、72 h在荧光显微镜下观察各组细胞形态并检测骨髓间充质干细胞的CM-Dil阳性标记率,阳性标记率为随机取10个非重叠视野(×100),计算CM-Dil阳性细胞数占总细胞数的比例。细胞融合约80%时消化传代培养,每次传代后观察细胞形态及标记率。
1.3.5CM-Dil标记细胞增殖能力检测 细胞标记后直接以细胞浓度为1×104/mL接种于96孔板中,每组 35 孔细胞,每孔体积100 μL。每天08:00每组各取5孔细胞,加入 10 μL CCK8 孵育4 h后,用全自动酶标仪检测490 nm吸光度(OD)值,连续7 d,并绘制生长曲线。
1.3.6CM-Dil标记细胞周期检测 细胞标记后48 h制备成细胞悬液,利用PI-流式细胞仪技术检测细胞周期。

2 结 果
2.1骨髓间充质干细胞培养 采用全骨髓贴壁法分离培养大鼠骨髓间充质干细胞,刚分离接种时细胞为圆形、椭圆形,接种24 h后在倒置显微镜下观察发现,开始有少部分细胞贴附于瓶底。72 h后绝大部分细胞贴壁,呈梭形或多角形,呈集落样生长。培养5~7 d后,细胞达80%融合,可进行细胞的首次传代。传代后细胞较原代略大,经4~5 d即可达80%融合。经传3~4代后,细胞为长梭形,形态均一,排列有序(图1)。

A:原代MSCs第3天(×100);B:第3代MSCs(×100)
图1原代及第3代大鼠骨髓间充质干细胞
2.2MSCs鉴定 经流式细胞仪检测,90%以上细胞CD34和CD45表达阴性,CD44和CD29表达阳性。
2.3CM-Dil标记后细胞荧光表达情况及形态变化 CM-Dil浓度为1、2、4 μg/mL标记后15 min即见到红色荧光(图2),标记率分别为(31.60±1.25)%、(88.73±1.79)%、(96.89±1.31)%。4 μg/mL组标记率明显高于其他两组,经ANOVA分析,3组间差异有统计学意义(F=1 757.21,P=0.000)。采用SNK法进行两组间比较,1 μg/mL组与2、4 μg/mL组比较差异均具有统计学意义(P<0.05),2 μg/mL组与4 μg/mL组比较差异也具有统计学意义(P<0.05)。而各组染色后24、48、72 h的细胞标记率进行组内比较则差异无统计学意义(P>0.05)。细胞标记后传代至第6代时荧光表达仍较强,之后荧光强度开始衰减。标记的细胞在绿色荧光激发下呈现红色荧光,且细胞形状同未染色细胞大致相同。
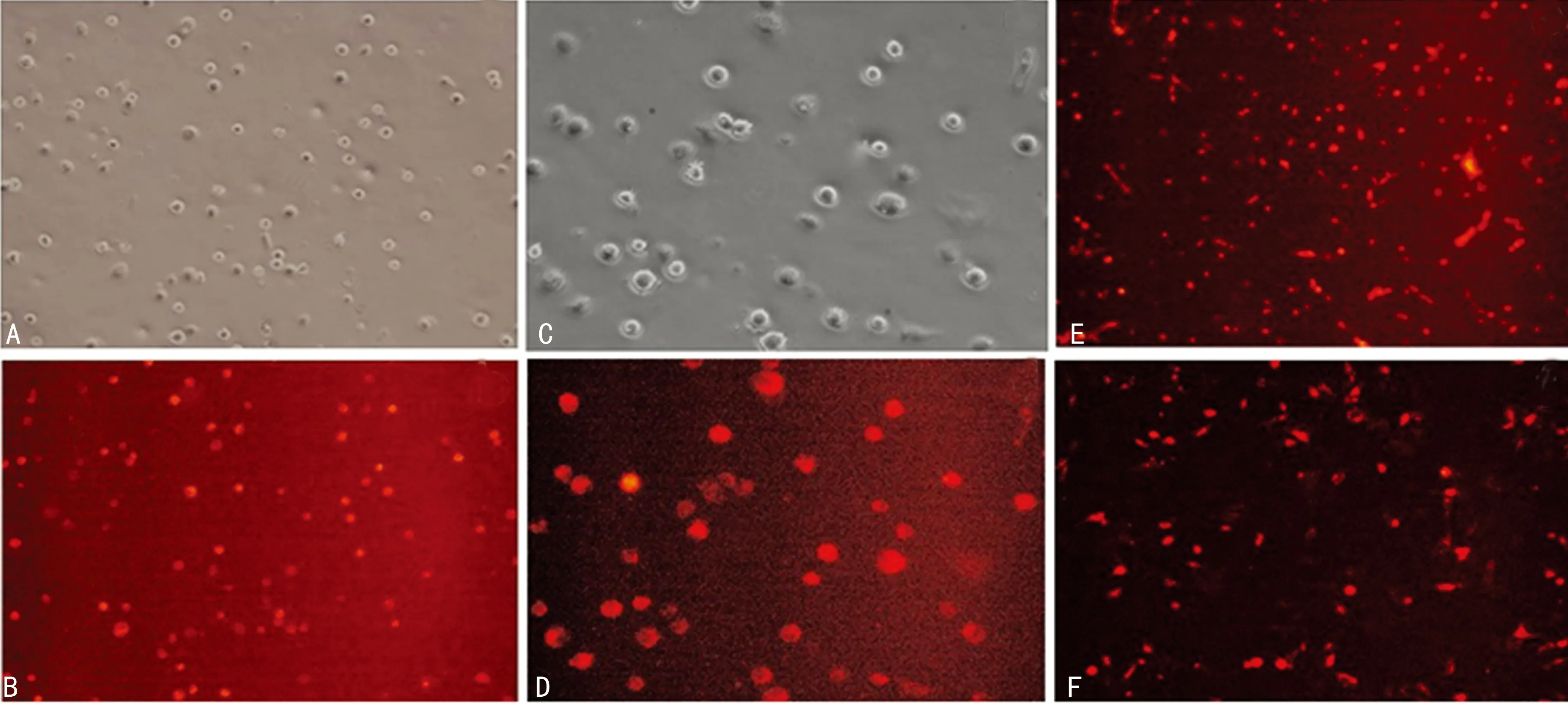
A:悬浮MSC 4 μg/mL CM-Dil标记15 min(白光×100); B:悬浮MSC 4 μg/mL CM-Dil标记15 min(荧光×100);C:悬浮状态4 μg/mL CM-Dil标记MSC第3代(白光×200);D:悬浮状态4 μg/mL CM-Dil标记MSC第3代(荧光×200);E:贴壁4 μg/mL CM-Dil标记MSC第6代(荧光×100);F:贴壁4 μg/mL CM-Dil标记MSC第8代(荧光×200)
图2 MSC用CM-Dil标记后的荧光表达情况
2.4标记细胞增殖能力的检测 4组MSCs的生长曲线如图3所示。细胞增殖能力的检测结果表明不同标记浓度组与未标记组的细胞生长趋势相似,表明CM-Dil标记后 MSCs的增殖不受影响。

图3 4组MSCs的生长曲线
2.5标记细胞细胞周期的检测 由表1可见,4组间细胞周期G1期、S期及G2/M期百分比比较差异无统计学意义(F=1.665,P=0.251;F=1.317,P=0.335;F=2.159,P=0.171),表明标记后细胞周期并没有改变,无细胞增殖阻滞,提示CM-Dil对MSCs无细胞毒性。

表1 4组细胞细胞周期比较%)
*:P>0.05,与MSC组比较
3 讨 论
骨髓间充质干细胞是一种成体干细胞,具有多向分化的潜能,在特定环境下可分化为神经系统细胞、成骨细胞、软骨细胞、脂肪细胞等,其应用前景不可估量。目前骨髓间充质干细胞的分离培养方法主要有:全骨髓贴壁分离法、密度梯度离心分离法等[3-4]。本试验采用全骨髓贴壁分离法成功分离大鼠骨髓间充质干细胞。全骨髓贴壁法不仅根据不同细胞的贴壁性来去除杂质细胞,而且还通过不同细胞所需的消化时间不同来达到纯化骨髓间充质干细胞的目的[5]。利用造血系细胞悬浮生长,而骨髓间充质干细胞贴壁生长的特性,每次换液去除造血系细胞;再根据骨髓间充质干细胞较成纤维细胞易脱落的特点,传代时严格掌握消化酶的量和消化时间,待细胞稍见回缩即终止消化,这样不仅能使骨髓间充质干细胞得到进一步纯化,还能保持细胞的活性。经数次传代,可获得平行状或辐射状的形态均一的梭形骨髓间充质干细胞。经流式细胞仪鉴定证实全骨髓贴壁法获得的大鼠骨髓间充质干细胞纯化程度高,且增殖能力活跃,具有骨髓间充质干细胞的一般生物学特性。
细胞标记在干细胞移植及分化研究中是必不可少的环节。这就需要一种尽可能操作简便、技术可靠、结果可信、便于检测的细胞标记示踪技术。至今为止已有多种细胞标记示踪方法,包括绿色荧光蛋白、5-溴脱氧尿嘧啶核苷、细胞膜或核染料等[6-8],它们各有优缺点。绿色荧光蛋白标记稳定性强,是目前被较为广泛接受的标记方法,但其标记程序复杂繁琐,而且延长组织固定时间荧光信号会受影响[9];4,6-联咪-2-苯基吲哚(DAPI)标记时间短,且标记后细胞停止增殖,不适合体内试验[10];而5-溴脱氧尿嘧啶核苷的移植细胞死亡后,其中的BrdU将会释放出来,并被邻近细胞摄取而导致出现假阳性[11]。
CM-Dil是一种亲脂性羰花青荧光膜染料,是目前较好的荧光染料。目前可用的亲脂性羰花青,包括Dil和Dio,PKH2及PKH26染料,在标记悬浮细胞过程中有时需要渗透压调节剂或去盐来避免在标记过程中形成染料沉淀。此外,Dil标记不能在常规组织固定过程中兼容而进行长期保存。与Dil不同,CM-Dil的CM基团能与多肽及蛋白上的巯基反应从而使该分子在醛类物质中保持稳定,因此标记后进行固定、脱水及石蜡包埋等操作并不影响其荧光效果。CM-Dil可在绿色荧光激发下,发射出波长为570 nm的红色荧光。本研究对CM-Dil标记后细胞进行显微镜下形态观察,发现标记后细胞与未标记细胞的形态无明显异常。另外,CM-Dil标记后细胞生长曲线的分析说明CM-Dil标记后细胞的增殖不受影响,而且细胞周期检测结果表明细胞标记后无细胞阻滞。研究结果提示低浓度CM-Dil对细胞没有毒性作用,与马慧雨等[12]的研究结果一致。此外,张雅妮等[13]的研究还显示,CM-Dil标记后对大鼠骨髓间充质干细胞的迁移能力并无明显影响。本试验通过比较不同浓度CM-Dil对MSCs的标记率,发现4 μg/mL CM-Dil浓度具有较高的标记率,标记率可达96%以上。标记后15 min在荧光显微镜下即可看到很强的荧光表达。传至第6代时荧光表达仍较强,之后荧光强度开始减弱。荧光强度衰减可能与操作过程中未能完全避光、细胞分裂膜染料减少等有关。
综上所述,本试验通过全骨髓贴壁法获得较高纯度、生物学特征稳定的大鼠骨髓间充质干细胞。全骨髓贴壁法分离培养骨髓间充质干细胞方法简单,成功率高,可作为分离、培养人类骨髓间充质干细胞的可借鉴方法之一,为日后临床应用骨髓间充质干细胞移植治疗疾病提供实验基础。利用4 μg/mL CM-Dil标记细胞,标记率高,方法简单可靠,荧光淬灭时间较长,检测方法简便,可直接在荧光显微镜下观察。CM-Dil标记作为一种高效稳定、用于一定时期内追踪间充质干细胞的标记方法,可用于追踪间充质干细胞体内移植后能否在靶器官定植及分化,在组织工程中有较好的应用前景。
[1]KOLAJA K.Stem cells and stem cell-derived tissues and their use in safety assessment[J].J Biol Chem,2014,289(8):4555-4561.
[2]BIANCO P."Mesenchymal" stem cells[J].Annu Rev Cell Dev Biol,2014(30):677-704.
[3]张猛,冯文磊,王艳杰,等.全骨髓贴壁法分离培养小鼠骨髓间充质干细胞[J].石河子大学学报(自然科学版),2015,33(2):164-167.
[4]王英慧,郑瑞,陈莉.密度梯度离心及贴壁分离筛选相结合分离培养大鼠骨髓间充质干细胞[J].中国组织工程研究,2014,18(28):4463-4468.
[5]卢宁,赵龙凤,李红,等.应用全骨髓贴壁法获取高纯度大鼠骨髓间充质干细胞的实验研究[J].山西医科大学学报,2010,41(3):277-280.
[6]付霞霏,何援利.重组腺病毒介导的绿色荧光蛋白基因转染大鼠间充质干细胞的实验研究[J].南方医科大学学报,2007,27(10):1517-1520.
[7]高黎,祝华,张荣,等.BrdU标记人脐带间充质干细胞及对细胞生物学行为影响的体外研究[J].重庆医科大学学报,2014,39(11):1617-1621.
[8]MOJCA J,TUBA B,MATIJA V,et al.The hazards of DAPI photoconversion:effects of dye,mounting media and fixative,and how to minimize the problem[J].Histochem Cell Biol,2013,139(1):195-204.
[9]邓超,黄大昉,宋福平.绿色荧光蛋白及其应用[J].中国生物工程杂志,2011,31(1):96-102.
[10]BECCIA M R,BIVER T,PARDINI A,et al.The fluorophore 4′,6-diamidino-2-phenylindole (DAPI)induces DNA folding in long double-stranded DNA[J].Chem Asian J,2012,7(8):1803-1810.
[11]PAWELCZYK E,JORDAN E K,BALAKUMARAN A,et al.In vivo transfer of intracellular labels from locally implanted bone marrow stromal cells to resident tissue macrophages[J].PLoS One,2009,4(8):e6712.
[12]马慧雨,肖苒,杜晓岩.荧光活性染料(CM-Dil)对人骨髓间充质干细胞增殖能力的影响[J].口腔颌面外科杂志,2011,21(4):251-255.
[13]张雅妮,于美娟,冯善伟,等.CM-Dil标记大鼠骨髓间充质干细胞的生物学特性探讨[J].中国组织工程研究,2016,20(45):6726-6732.

