结直肠息肉癌变的内镜与传统手术的疗效比较
刘凤玲,孙学国,薛会光,刘娜,刘希双
(青岛大学附属医院崂山院区 消化内科,山东 青岛 266101)
结直肠癌是目前全球人类的发病率排名前3的恶性肿瘤,每年全球有新发100万例的结直肠癌[1]。近年来,随着内镜治疗技术的迅速发展,很多新的内镜下治疗器械不断的开发应用,内镜下治疗早期消化道肿瘤作为一种微创治疗手段在日本和韩国等都得到了较为广泛的应用[2]。既可避免外科手术带来的风险,又能提高患者的生活质量。本文旨在探讨内镜与传统手术2种治疗方法的安全性、有效性以及费用的差异,现报道如下。
1 资料与方法
1.1 入选标准
①病历资料完整者,形态上为息肉,病理为腺瘤性息肉伴高级别上皮内瘤变或者癌;②结肠镜到达回盲部;③肠道准备良好,不影响黏膜的观察;④年龄>18岁。
1.2 排除标准
①遗传性非息肉性大肠癌;②家族性腺瘤性息肉病;③有炎症性肠病史,包括克罗恩病(Crohn's disease,CD)和溃疡性结肠炎;④病历资料不完整患者;⑤结肠镜未到达回盲部;⑥有结肠手术史;⑦肠道准备差,影响黏膜的观察;⑧年龄<18岁。
1.3 仪器设备
使用日本奥林巴斯公司260、290型系列电子结肠镜,活检钳。
1.4 方法
1.4.1 研究方法 选取2005年1月-2017年1月青岛大学附属医院崂山院区行结肠镜检查的患者131例,病理为腺瘤性息肉伴高级别上皮内瘤变或者癌。所有患者均符合2010年美国癌症联合会(AJCC)[3]消化道早癌及癌前病变的诊断标准。本文为回顾性研究,分为内镜组80例和外科组51例,统计两组的息肉直径、部位、形态及病理,同时对两组的治疗费用、住院及禁食时间、并发症情况进行比较。
1.4.2. 诊断标准 息肉直径按大小分别为:1~2 cm、2~3 cm及≥3 cm。息肉形态按山田分型:Ⅰ型呈平坦丘状,隆起的起始部较平滑;Ⅱ型呈半球状,隆起的起始部有明确的境界;Ⅲ型有亚蒂,隆起起始部略小,形成亚蒂;Ⅳ型有蒂,隆起的起始部有明显的蒂部。按息肉部位分为:近端结肠和远端结肠,近端结肠包括盲肠、升结肠、横结肠,脾曲以下结肠(包括脾曲)为远端结肠。按组织病理:分为腺瘤性息肉伴高级别上皮内瘤变或者癌。并由青岛大学附属医院病理科专家根据世界卫生组织结直肠肿瘤分类进行审阅[4]。
1.4.3 治疗方法 2005~2010年对早期结直肠癌多采用手术切除,2012~2017年多采用内镜下治疗。本组患者均由经验丰富的医师完成手术。早期结直肠癌及癌前病变内镜治疗的适应证:黏膜内癌为内镜下治疗的绝对适应证,向黏膜下层轻度浸润的SM1期(癌组织浸润黏膜下层1/3)癌为内镜下治疗的相对适应证。内镜下治疗方法包括:高频电圈套息肉切除术、内镜下黏膜切除术(endoscopic mucosal resection,EMR)、内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)、联合治疗[EMR+氩离子凝固术(argon plasma coagulation,APC)、EMR+热活检、高频电圈套器+APC]等。外科组采用常规外科手术切除病变。
1.5 统计学方法
数据分析采用SPSS 22.0统计软件,符合正态分布的计量资料以均数±标准差(±s)表示,采用t检验,计数资料采用例(%)表示,采用χ2检验或者Fisher确切概率法,等级资料采用秩和检验,采用Logistic回归方程进行多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 结直肠息肉直径大小比较
结直肠息肉直径较小者(1~2 cm)多选用内镜下治疗(37.5%),较大者(≥3 cm)多选用手术切除(56.9%),两组比较差异有统计学意义(P<0.05)。见表1。
2.2 结直肠息肉形态比较
广基息肉(Ⅰ、Ⅱ型)多采用外科手术切除(52.9%vs 32.6%),带蒂尤其是Ⅳ型息肉多采用内镜下治疗(21.3% vs 3.9%),两组比较差异有统计学意义(P<0.05)。见表 2。
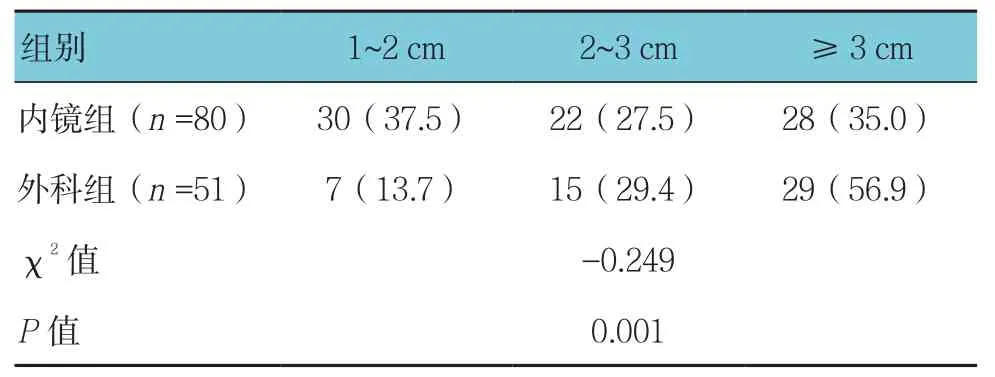
表1 两组结直肠息肉直径大小的比较 例(%)
2.3 结肠息肉部位比较
远端结肠较近端更多见(109例 vs 20例),但两组比较差异有统计学意义(P<0.05)。见表3。
2.4 结直肠息肉病理类型比较
癌前病变多采用内镜下治疗(53.8%),而结直肠癌变者则多采用手术切除(60.8%),但两组比较差异无统计学意义(P>0.05)。见表4。
2.5 治疗费用、住院时间及禁食时间的比较
两组患者的治疗费用、住院时间及禁食时间的比较,差异有统计学意义(P<0.05)。见表5。
2.6 并发症的比较
内镜组无术后出血穿孔等并发症,手术组有18例分别出现术中出血(4例)、感染(5例)、切口裂开(2例)、肠梗阻(2例)、气胸(3例)、输液反应(2例),分别给予对症处理后患者好转出院,两组比较差异有统计学意义(P<0.05)。见表6。
2.7 多因素Logistic回归分析
以息肉大小、息肉形态、治疗费用、住院时间、禁食时间及并发症为自变量,以内镜组与外科组为因变量,进行多因素Logistic回归方程分析,结果显示:内镜下治疗费用低、禁食时间短,较外科手术具有明显优势(=0.999 和 0.299,P<0.05)。见表 7。
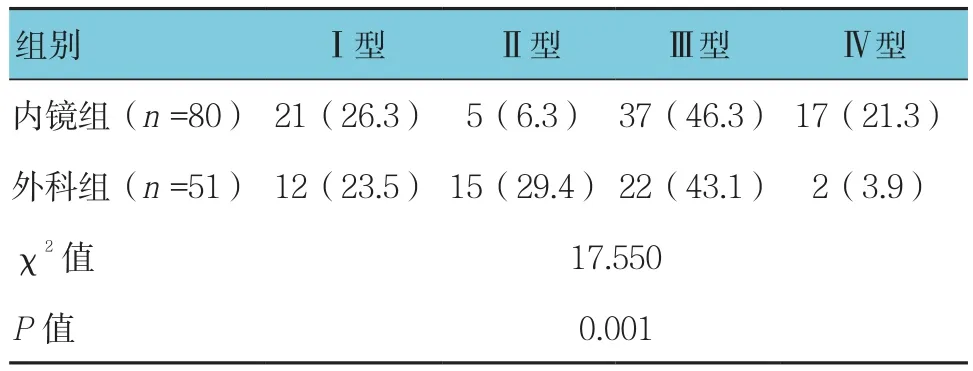
表2 两组结直肠息肉形态(山田分型)的比较 (%)

表3 两组结肠息肉部位的比较 例(%)
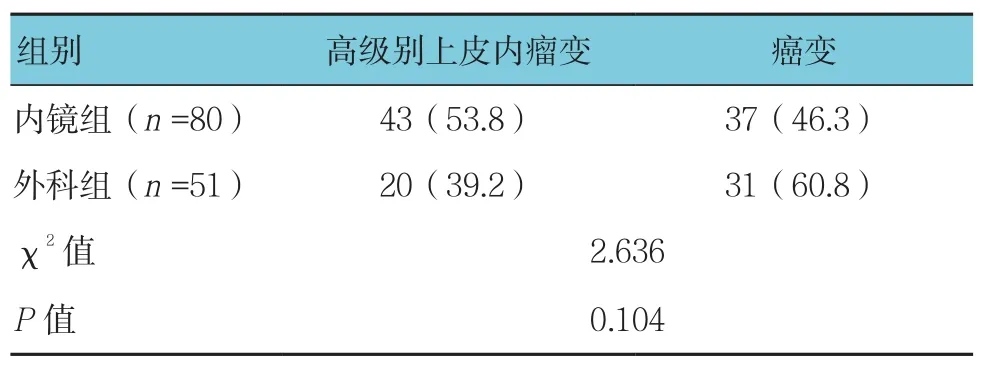
表4 两组结直肠息肉病理类型的比较 例(%)
表5 两组治疗费用、住院时间及禁食时间的比较 (±s)
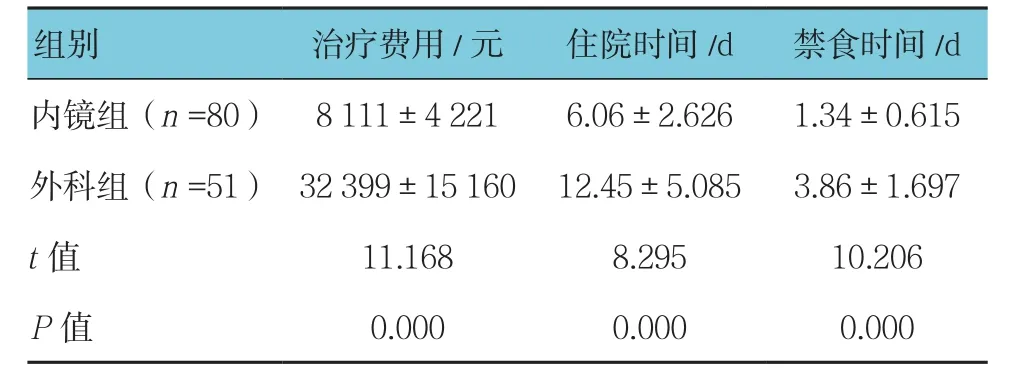
表5 两组治疗费用、住院时间及禁食时间的比较 (±s)
组别 治疗费用/元 住院时间/d 禁食时间/d内镜组(n =80) 8 111±4 221 6.06±2.626 1.34±0.615外科组(n =51) 32 399±15 160 12.45±5.085 3.86±1.697 t值 11.168 8.295 10.206 P值 0.000 0.000 0.000

表6 两组并发症的比较 (%)
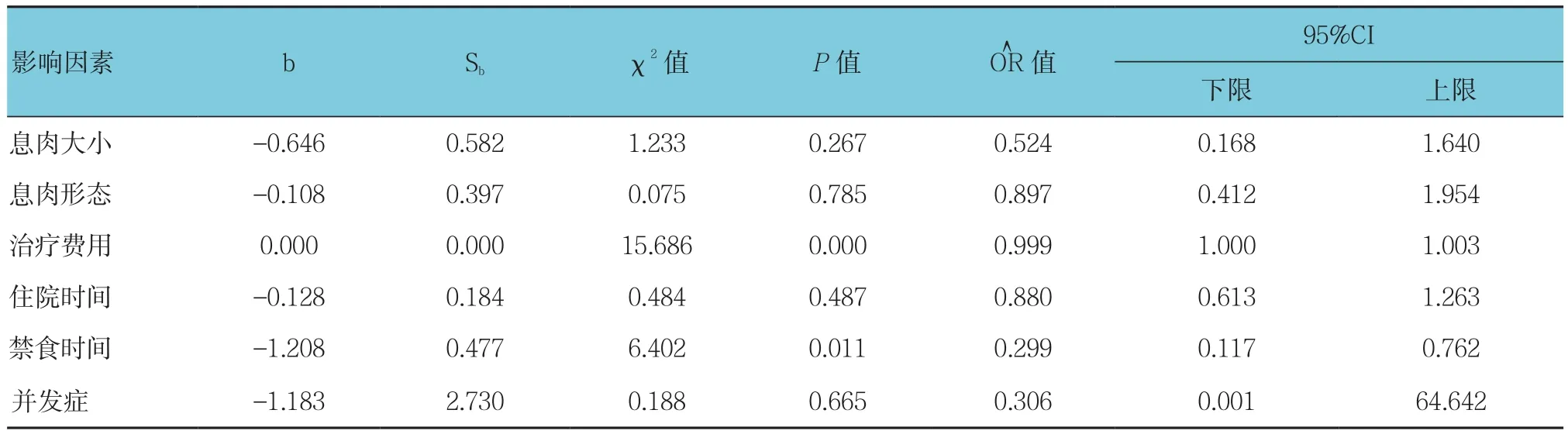
表7 Logistic回归分析影响因素
3 讨论
腺瘤性肠息肉占全部结直肠息肉的1/2~2/3,多数结直肠癌是由腺瘤性肠息肉癌变而来[5]。腺瘤的癌变率为1.4%~9.4%,由腺瘤发展到侵袭性结直肠癌需要7~10年[6]。因此,使得通过结肠镜检查和息肉摘除使预防结直肠癌成为可能。但进展期腺瘤[7](具备直径≥10 mm、有25%以上的绒毛成分、有高级别上皮内瘤变中的任一条即可)发展为浸润性癌的年转化率高达2.6%~5.7%[8],值得临床上高度重视。
本研究结果表明,息肉直径较小者(≤2 cm)、带蒂息肉及癌前病变者多选用内镜下治疗,而直径较大者(≥3 cm)、广基息肉及癌变者多选用外科手术切除,这可能与早期内镜技术治疗发展不够成熟,以致对较大息肉切除困难有关,对术前已经病理证实为癌变的息肉亦多选用外科手术。广基息肉大多数为肿瘤性息肉,癌变率比带蒂息肉明显增高,且当基底较宽时,完整切除率较低,故以往把>2 cm的广基息肉列为内镜下治疗的禁忌证[9]。2012年后随着ESD技术的开展,内镜下切除息肉的直径逐渐增大,对早期结直肠癌及SM1期癌的切除的应用也越来越广泛。目前限制内镜治疗的主要因素不再是息肉大小和是否癌变,而是癌变组织的浸润深度。癌前病变多采用内镜下治疗,而结直肠息肉癌变者则多采用外科手术切除。随着内镜技术治疗的发展,早期结直肠癌越来越多的采用内镜下治疗,但必须定期复查内镜,不能仅仅关注内镜下治疗创伤小,而却忽视肿瘤局部复发或者淋巴结转移等问题。到目前为止,还没有黏膜内癌发生淋巴结转移的报道,然而,黏膜下浸润性癌发生淋巴结转移的比率为6.8%~7.8%[10-12]。根据2014年JSCCR治疗结直肠癌[13]的指导方针,经内镜下治疗的黏膜内癌,若发生淋巴结转移(绝对适应证),必须追加手术切除。因此,提出针对浸润深度的判断可以减少不必要的手术切除。然而在实际临床工作中,很难对所有的样本进行病变浸润深度的测量。因此,对病变取活检时无法判断对肠壁全层的浸润深度,只能进行“全瘤”切除后,才能准确的评估,制定下一步治疗方案。
本研究中结肠息肉癌变均以远端结肠较近端多见,所占比例分别为(88.8%和74.5%),2种治疗方法相当,虽然近端进展期腺瘤的检出率在增高,但目前临床上的检出部位还是以远端结肠为主[14],与本组研究结果相符。这可能与近端结肠来源于胚胎的中肠组织,而远端结肠来源于胚胎的后肠组织,两者有着不同的临床、流行病学和分子遗传学特征有关。然而对存在弯曲的肠段或黏膜褶皱后面的病变,EMR可能无法成功切除[15]。有报道[16-18,1]2%~10%的病变是不能使用内镜切除的,是由于技术限制和某些类型的息肉,如较大或者平坦型,可能与增加结肠穿孔或出血的风险有关。
钛夹的应用使内镜切除后出血、穿孔等不良事件的发生率降低。本研究显示内镜下治疗无并发症,且一些研究表明,EMR治疗无出血或穿孔等并发症[19]。传统外科手术在治疗早癌及癌前病变具有一定的效果。但仍有学者指出[20],由于手术造成创伤较大、出血多且住院时间较长等原因,影响患者手术后恢复状况以及预后效果。同时,手术费用较高,给患者及其家庭带来较大的精神负担及经济负担,本研究显示,传统外科手术患者的住院时间长达(12.45±5.085)d,治疗总花费为(32 399±15 160)元,且传统手术后患者的并发症高达35.29%,患者预后效果较差,对患者的术后康复不利。研究表明[21]黏膜内癌经EMR治疗后预后较好,然而黏膜下癌易出现肿瘤浸润,因此,需要3年内内镜下定期随访。多因素分析显示,费用、禁食时间使内镜下治疗较外科手术具有明显区别。这可能与以下几点有关:内镜与手术治疗的收费标准不同;内镜切除术后肠道恢复时间快,静脉补液少,禁食时间短;内镜下治疗手术时间短,创伤小;内镜下治疗并发症少等。
综上所述,内镜下治疗早期结直肠癌较外科手术住院时间短,且术后肠道恢复时间快,费用低、禁食时间短,创伤小,并发症少,值得在临床上推广,对于早期结直肠癌的诊治具有一定意义。但是如果肿瘤发生黏膜下浸润,则手术切除的效果要优于内镜治疗。
参 考 文 献:
[1] MCGUIRE S. World Cancer Report 2014. Geneva, Switzerland:World Health Organization, International Agency for Research on Cancer, WHO Press, 2015[J]. Advances in Nutrition, 2016, 7(2):418-419.
[2] 周平红, 姚礼庆, 徐美东, 等. 内镜黏膜下剥离术治疗消化道黏膜下肿瘤[J]. 中国微创外科杂志, 2007, 7(11): 1063-1065.
[3] EDGE S B, COMPTON C C. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Annals of Surgical Oncology, 2010, 17(6):1471-1474.
[4] VAN K H, DE J V, SCHREUDERS E, et al. Awareness of postpolypectomy surveillance guidelines: a nationwide survey of colonoscopists in Canada[J]. Canadian Journal of Gastroenterology,2012, 26(2): 79-84.
[5] 苏便欣, 张学彦. 结肠镜检查肠息肉漏诊及其相关因素研究进展[J]. 胃肠病学, 2016, 21(2): 115-117.
[6] 房静远. 关注结直肠腺瘤的诊治研究[J]. 中华消化杂志, 2010,30(7): 433-435.
[7] WINAWER S, ZAUBER A, FLETCHER R, et al. Guidelines for colonoscopy surveillance after polypectomy[J]. Gastroenterology,2006, 130: 1872-1885.
[8] BRENNER H, HOFFMEISTER M, STEGMAIER C, et al. Risk of progression of advanced adenomas to colorectal cancer by age and sex:estimates based on 840 149 screening colonoscopies[J]. Gut,2007, 56(11): 1585-1589.
[9] 于恩达, 孟荣贵, 徐洪莲, 等. 内镜黏膜切除术治疗大肠广基大息肉[J]. 中华消化内镜杂志, 2005, 22(5): 299-303.
[10] WATANABE T, ITABASHI M, SHIMADA Y, et al. Japanese Society for Cancer of the Colon and Rectum (JSCCR) guidelines 2010 for the treatment of colorectal cancer[J]. International Journal of Clinical Oncology, 2015, 20(2): 207-239.
[11] SUH J H, HAN K S, KIM B C, et al. Predictors for lymph node metastasis in T1 colorectal cancer[J]. Endoscopy, 2012, 44(6):590-595.
[12] NAKADOI K, TANAKA S, KANAO H, et al. Management of T1 colorectal carcinoma with special reference to criteria for curative endoscopic resection[J]. Journal of Gastroenterology &Hepatology, 2012, 27(6): 1057-1062.
[13] DELANEY C P, CHAMPAGNE B J, MARKS J M, et al.Tissue apposition system:new technology to minimize surgery for endoscopically unresectable colonic polyps[J]. Surgical Endoscopy, 2010, 24(12): 3113-3118.
[14] 康海锋, 李海燕, 朱凌音, 等. 结肠进展期腺瘤的内镜下检出特点[J]. 中华消化内镜杂志, 2014, (9): 542-544.
[15] CRUZ R A, RAGUPATHI M, PEDRAZA R, et al. Minimally invasive approaches for the management of “difficult” colonic polyps[J]. Diagnostic and Therapeutic Endoscopy, 2011, (1070-3608): 682793.
[16] DELANEY C P, CHAMPAGNE B J, MARKS J M, et al.Tissue apposition system: new technology to minimize surgery for endoscopically unresectable colonic polyps[J]. Surgical Endoscopy, 2010, 24(12): 3113-3118.
[17] CHURCH J M. Avoiding surgery in patients with colorectal polyps[J]. Diseases of the Colon & Rectum, 2003, 46(11): 1513-1516.
[18] CIPOLLETTA L, BIANCO M A, ROTONDANO G, et al.Endoscopic mucosal resection for advanced non-polypoid colorectal adenoma and early stage carcinoma[J]. Surgical Endoscopy, 2003, 59(3): 475-479.
[19] SOETIKNO R, GOTODA T. Con: colonoscopic resection of large neoplastic lesions is appropriate and safe[J]. American Journal of Gastroenterology, 2009, 104(2): 272-275.
[20] 李红平, 唐波, 樊超强, 等. 内镜黏膜下剥离术治疗近环周早期食管癌及癌前病变的价值[J]. 第三军医大学学报, 2014,36(3): 278-282.
[21] KIM M N, KANG J M, YANG J I, et al. Clinical features and prognosis of early colorectal cancer treated by endoscopic mucosal resection[J]. Journal of Gastroenterology & Hepatology,2011, 26(11): 1619-1625.

