儿童EB病毒感染相关性肾损伤临床特点分析
杨琴,周太光
(西南医科大学附属医院 儿科,四川 泸州 646000)
EB病毒(Epstein-Barr virus,EBV)是Epstein和Barr于1964年在非洲恶性淋巴瘤儿童体外培养的淋巴瘤细胞中发现的一种嗜淋巴细胞的双链DNA病毒,属于疱疹病毒属γ亚科的一种[1]。EBV感染其临床表现多为无症状或不典型症状,如轻微的上呼吸道感染症状:发热、鼻塞、咽炎、浅表淋巴结肿大等,当患儿出现“发热、咽峡炎、淋巴结肿大”三联征,则为EB病毒感染(即传染性单核细胞增多症)的典型表现[2]。疾病累及肾脏时则多表现为血尿、蛋白尿、急性肾炎、肾病综合征、小管间质性肾炎、肾衰竭等[3]。国内外针对EBV感染相关性肾损伤的研究不多。本文通过对近2年来西南医科大学附属医院儿科收治237例EBV感染患儿资料进行回顾性分析,总结EBV感染相关性肾损伤的临床特点,现报道如下。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准 进行EBV抗体和/或EBV-DNA定量检测,以血EBV-DNA定量>400拷贝/ml和/或EBV-CA-IgM阳性为EBV急性感染标准[4-6]。参考中华医学会儿科学分会肾病学组2009年制定的指南(试行),血尿的诊断标准为肉眼血尿或镜下血尿,蛋白尿的诊断标准为:①1周之内3次尿常规蛋白阳性;②24 h之内尿蛋白定量>150 mg;③1周以内3次尿微量白蛋白高于正常值高限,满足以上任一项者诊断为蛋白尿。
1.1.2 排除标准 原发性肾脏疾病或合并有其他病毒感染的患儿。
1.2 一般资料

表1 不同性别及年龄与肾损伤发生的关系 例(%)
选取2014年1月-2016年1月该院确诊为EBV感染的237例患儿为研究对象。其中合并有肾损伤的57例患儿为肾损组,未合并肾损伤的180例患儿为非肾损组,两组患儿均征得其监护人同意并签署知情同意书。
1.3 方法
以患儿入院为观察起点,出院为观察终点,分析比较两组患儿在年龄、性别、病程、热程及实验室检查指标:丙氨酸氨基转移酶(alanine amiotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、 白 细 胞(white blood cell count,WBC)计数、淋巴细胞(Lymphocytes,LYM)数、中性粒细胞(Neutrophils,NEU)数、淋巴细胞百分比(lymphocyte percentage,LYM-R)、中性粒细胞百分比(neutrophilic granulocyte percentage,NEU-R)、异型淋巴细胞百分比(atypical lymphocyte,VLYM)、单核细胞百分比(monocyte percentage,MONO-R)、血红蛋白(Hemoglobin,HGB)、血小板(blood platelet count,PLT)计数、抗EB病毒抗体间的差异。
1.4 统计学方法
采用SPSS17.0软件进行统计分析,计量资料以均数±标准差(±s)表示,计数资料以率(%)表示,组间比较采用χ2检验,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
237例患儿中肾损伤57例(24.05%),其中镜下血尿18例(7.59%)、蛋白尿51例(21.52%)、血尿+蛋白尿10例(4.22%)。
2.1 不同性别及年龄与肾损伤发生的关系
肾损组共计57例,其中男性患儿36例(63.16%),女性患儿21例(36.84%);非肾损组共计180例,其中男性患儿112例(62.22%),女性患儿68例(37.78%);肾损组与非肾损组的性别构成比较,采用χ2检验,差异无统计学意义(χ2=0.001,P=0.899)。肾损组平均年龄为(4.95±2.76)岁,其中 <3岁 15例(26.32%),3~7岁32例(46.86%),>7岁10例(26.82%);非肾损组平均年龄为(4.33±2.48)岁,<3岁60例(33.33%),3~7岁97例(53.89%),>7岁23例(12.78%),肾损组与非肾损组的年龄构成比较,采用χ2检验,差异无统计学意义(χ2=0.422,P=0.492)。见表1。
2.2 两组不同实验室检查指标、病程、热程与肾损伤发生的关系
两组的 ALT(t=1.131,P=0.259)、AST(t=0.873,P=0.384)、WBC(t=0.554,P=0.580)、LYM(t=0.079,P=0.937)、NEU(t=0.262,P=0.793)、LYM-R(t=0.722,P=0.471)、NEU-R(t=0.310,P=0.757)、VLYM(t=1.619,P=0.107)、MONO-R(t=0.025,P=0.980)、HGB(t=0.005,P=0.926)、抗 EBV-CA-IgG的OD值(t=1.381,P=0.169)、抗EB-NA-IgA的 OD值(t=1.885,P=0.061)、病程(t=0.162,P=0.871)、热程(t=0.089,P=0.930)比较,采用t检验,差异无统计学意义;两组的PLT比较,采用t检验,差异有统计学意义(t=2.397,P=0.017),肾损组低于非肾损组;两组的抗EBV-CA-IgM的OD值比较,采用t检验,差异有统计学意义(t=3.400,P=0.001),肾损组高于非肾损组。见表2。
表2 不同实验室检查、病程、热程与肾损伤发生的关系 (±s)
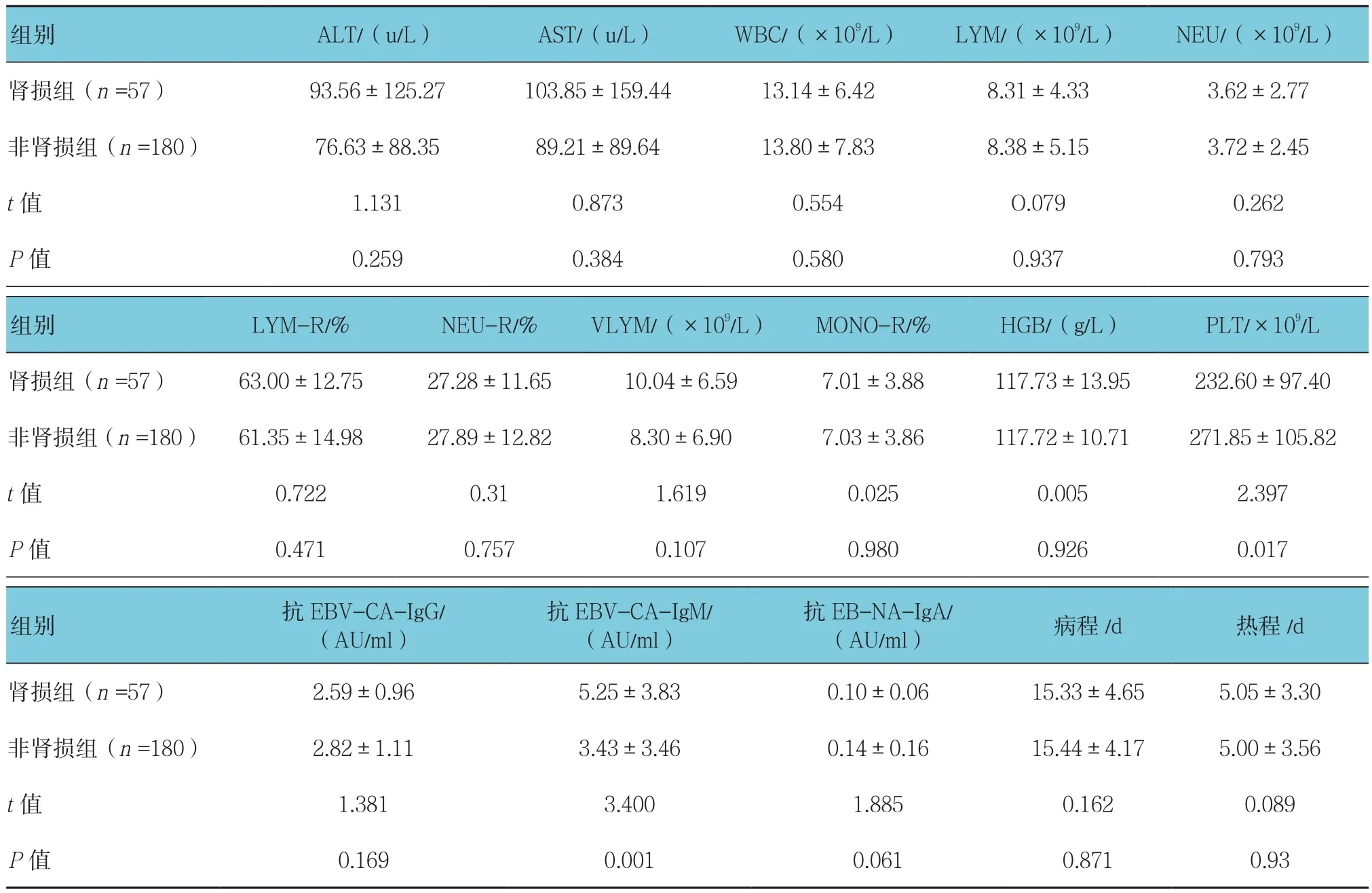
表2 不同实验室检查、病程、热程与肾损伤发生的关系 (±s)
组别 ALT/(u/L) AST/(u/L) WBC/(×109/L) LYM/(×109/L) NEU/(×109/L)肾损组(n =57) 93.56±125.27 103.85±159.44 13.14±6.42 8.31±4.33 3.62±2.77非肾损组(n =180) 76.63±88.35 89.21±89.64 13.80±7.83 8.38±5.15 3.72±2.45 t值 1.131 0.873 0.554 O.079 0.262 P值 0.259 0.384 0.580 0.937 0.793组别 LYM-R/% NEU-R/% VLYM/(×109/L) MONO-R/% HGB/(g/L) PLT/×109/L肾损组(n =57) 63.00±12.75 27.28±11.65 10.04±6.59 7.01±3.88 117.73±13.95 232.60±97.40非肾损组(n =180) 61.35±14.98 27.89±12.82 8.30±6.90 7.03±3.86 117.72±10.71 271.85±105.82 t值 0.722 0.31 1.619 0.025 0.005 2.397 P值 0.471 0.757 0.107 0.980 0.926 0.017组别 抗EBV-CA-IgG/(AU/ml)抗EBV-CA-IgM/(AU/ml)抗EB-NA-IgA/(AU/ml) 病程/d 热程/d肾损组(n =57) 2.59±0.96 5.25±3.83 0.10±0.06 15.33±4.65 5.05±3.30非肾损组(n =180) 2.82±1.11 3.43±3.46 0.14±0.16 15.44±4.17 5.00±3.56 t值 1.381 3.400 1.885 0.162 0.089 P值 0.169 0.001 0.061 0.871 0.93
3 讨论
EBV感染呈全球分布,成人抗病毒衣壳抗原(VCA)IgG阳性率高达90%~95%,在我国学龄前儿童VCAIgG阳性率可达90%[7],在张朝霞等[8]的研究中发现,GSTT1纯合缺失基因型可能是儿童传染性单核细胞增多症发生的危险因素。EB病毒主要是通过唾液传播,大多发生于幼儿,特别以低龄幼儿最易感染[9]。根据EBV感染时间和感染后产生的特异性抗体谱,可将EBV感染分为原发感染、潜伏感染和激活3种类型[10]。
目前关于EBV感染引起的肾脏损伤,迄今为止均为小样本或个案报道,没有确切的流行病学调查。而国内报道提示,EBV感染相关性肾损伤的致病率可达1.7%~15.7%[11],TSAI[12]的关于EBV感染报道则详细描述其肾损伤中血尿占10.9%,蛋白尿占14.0%,管型尿占2.3%,可见由EBV感染引起的肾脏损伤并不少见。OZGURHAN等[13]研究证实,幼儿期急性肾损伤的突然出现可能与EBV的感染有关。本研究发现EBV感染相关性肾损伤高达24.05%,与寻励等[14]报道相符。既往的文献报道显示EBV感染相关性肾损伤主要以血尿为主,而本研究中确诊为EBV感染237例患儿中蛋白尿51例(21.52%)、血尿18例(7.59%)、血尿+蛋白尿10例(4.22%),肾损伤则主要以蛋白尿为主,与寻励等[14]报道相符。在严建华等[15]报道中EBV感染发生肾损伤的危险因素与年龄、性别、热程及病程有关,而本研究这些因素在肾损组与非肾损组差异无统计学意义。VLYM是由细胞在病毒的作用下发生原始细胞化和幼稚细胞化而产生的,Downey按形态将其分为空泡型、幼稚型及不规则型3类[16]。在EBV感染中VLYM的出现是EBV通过病毒表面高度糖基化的包膜糖蛋白gp350/220与B细胞表面受体CR2结合使得病毒基因gp42能与B淋巴细胞表面的HLA-2类分子结合,从而启动膜的融合过程,协助病毒逃避免疫系统的识别并成功侵入B淋巴细胞,同时引起T淋巴细胞以及NK细胞释放大量细胞因子,刺激LYM发生细胞毒效应,导致VLYM及LYM反应性升高[17],所以VLYM增多绝非病情加重,而是感染后T淋巴细胞增生的结果。有资料[18]表明,VLYM增高程度与传染性单核细胞增多症病情及预后无关,其结果与本研究中VLYM在两组差异无统计学意义相符。但林应标的研究中[19]发现LYM及VLYM的比值与EBV-DNA载量或其疾病的严重程度密切相关,与本文结论相反,因此VLYM在EBV感染中的作用还需要进一步研究。EBV感染机体后主要侵犯LYM,使LYM大量增殖,因此外周血中WBC、LYM计数及比例均升高,但临床上亦发现一部分病例在EBV感染后WBC计数不但不升,反而下降至正常参考值以下,因此WBC计数能否成为判断疾病严重程度的指标,尚需进一步研究。本研究亦提示两组患儿的WBC计数差异并无统计学意义。在本研究中,同样证实LYM-R、NEU-R及MONO-R在两组差异均无统计学意义。EBV感染机体后PLT计数常见减少,可能与病毒直接损伤或免疫复合物作用有关,在本研究中肾损组的PLT计数低于非肾损组,其原因可能是肾损组受到病毒的损伤更重。现EBV可造成肝损害已经被大家认可,一般来说,EBV引起的肝损害为轻症或自限性,在急性原发性EB病毒感染中有80%~90%出现肝损伤,约5%患者合并黄疸,而有关于肝功能衰竭的报道很少[20],同时古雪等[21]发现EB病毒为非嗜肝病毒肝炎的常见病原体。肝功能损伤的可能机制,有文献[22]报道是EBV作为一种免疫启动因子而致的间接免疫损伤,EBV感染的CD8+T LYM可能选择性的被肝脏捕获,肝Kuppfer细胞表达可溶性分子,包括Fas配体、IFNγ和TNFα等从而导致肝脏免疫损伤,而不是EBV对肝脏的直接损伤。肝功能异常为患者死亡的危险因素[23]。在实验室检查中ALT及AST是反映其肝功能受损程度的重要指标,但至今为止并没有哪一个研究直接指出患儿体内的转氨酶水平与肾脏损伤有关,本实验中同样提示ALT和AST在两组患儿间差异无统计学意义。EB病毒感染后,B淋巴细胞激活并转化为浆细胞产生各种病毒抗体,临床主要以抗衣壳抗原抗体、抗早期抗原抗体及抗核心抗原抗体为主,袁利群[24]曾报道在比较抗EBV-CA-IgM、IgG、IgA 3种抗体在传染性单核细胞增多症中的诊断,以IgM的敏感性、特异性、预测值最高。有研究提示[25],抗EBV-CA-IgM主要是感染早期出现,同时随着EBV-CA-IgM的逐渐升高,LYM会逐渐增长。因此笔者推测抗EBV-CA-IgM越高,LYM升高越明显,引起的免疫反应越重,最终导致肾脏损伤;与本研究中肾损组的抗EBV-CA-IgM值高于非肾损组相符。虽然在EB病毒感染后首先合成的是EB病毒核抗原,其次才是早期抗原及衣壳抗原,但只有在B细胞被破坏后核抗原才能与免疫系统接触,因此患儿血清中的衣壳抗体及早期抗体均比核抗体检出要早[26],因此抗EB-NA-IgA与抗EBV-CA-IgG一样都是感染后期出现,由于病毒的结合以及宿主对异物的消除,LYM直接受到破坏,导致减少,而淋巴细胞数量的下降可能会降低免疫反应的程度,不能引起明显的肾脏损伤。本研究中,抗EB-NA-IgA与抗EBVCA-IgG在两组差异无统计学意义恰好能证实这一点。
EBV感染相关性肾损伤的原因包括横纹肌溶解、高尿酸血症、溶血、肾药物、脱水、休克、肝肾综合征、间质性肾炎[27],其最常见的病理学类型为间质性肾炎,其发病的原因主要是由于近端肾小管上皮细胞存在CD21抗原,该抗原被证实为一种EBV受体,故而EBV相关性肾损伤多发生在肾间质[28]。同时也有文献报道,肾小球疾病与EBV感染有关,如IgA肾病[26]、膜增生性肾小球肾炎等[29],陈晓丽等[30]曾报道2例表现为膜性肾病的EBV相关性肾炎,可见EBV感染相关性肾损伤病理表现多样。其发病机制目前尚不完全清楚,既往有文献报道提示可能与病毒的直接侵袭及病毒引起的机体的免疫损伤有关[28,31]。但在本实验中肾损组的抗EBV-CA-IgM高于非肾损组提示随着IgM的升高肾损伤的发生有增加趋势,因此EBV感染可能主要是通过免疫反应而不是直接侵袭肾脏导致肾损伤,与寻励等[14]报道提示EBV感染相关性肾损伤的发生与EBV-DNA复制水平间关系不大的结论相呼应。
当EBV感染引起的肾脏损伤时,一般情况下是一个自限性的病程,在抗病毒治疗的基础上予以对症处理,短期内可治愈,但一旦病情加重,甚至出现肾衰竭则需要予以糖皮质激素治疗,必要时予以肾透析等。本研究显示,临床上EBV感染相关性肾损伤有较高的发生率,但是该数据主要是针对血尿及蛋白尿进行分析而得出,而郭小梅等[32]研究发现血β2-MG诊断病毒性感染肾早期损害的敏感性最高,血Cys-C的增高不受感染类型的限制,是各种类型感染性肾损害的良好指标,因此对于怀疑有EBV感染的患儿不仅应该常规进行尿液筛查,同时应进行血β2-MG、Cys-C的检测以便做到早发现、早诊断、早治疗,积极改善预后。本研究是回顾性研究,仅仅是将EBV感染相关性肾损伤组与非肾损伤组的临床特点作了总结,但由于临床医师普遍缺乏对EBV相关性肾损伤的关注,因此绝大部分发生肾损伤患儿未进行长期随访,本研究患儿远期的预后情况如何没有确切定论,这是一大缺憾,需要在以后的工作中进一步作长期随访研究。
参 考 文 献:
[1] 刘浩, 蒋龙凤. EBV相关传染性单核细胞增多症102例临床分析[J]. 中华临床医师杂志, 2013, 7(18): 8209-8212.
[2] 王玲玲. 155例EB病毒感染住院患儿的临床特点和实验室检查分析[D]. 太原: 山西医科大学, 2015.
[3] LEI P S, LOWICHIK A, ALLEN W, et al. Acute renal failure:unusual complication of Epstein-Barr virus-induced infection mononucleosis[J]. Clin Infect Dis, 2000, 31(6): 1519-1524.
[4] 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第7版. 北京: 人民卫生出版社, 2002: 821-825.
[5] FAFI-KREMER S, MORAND P, BRION J P, et al. Longterm shedding of infections Epstein-Barr virus after infections mononucleosis[J]. J Infect Dis, 2005, 191(6): 985-989.
[6] GAETA A, NAZZARI C, VERZARO S, et al. Early evidence of lympho-prodiferative disorder:post-transplant monitoring of Epsein-Barr virus infections in adult and pediatric patients[J]. New Microbiol, 2006, 29(4): 231-241.
[7] 黄维肖, 夏焱, 潘莉, 等. 更昔洛韦对小儿传染性单核细胞增多症的疗效观察[J]. 新医学, 2011, 42(4): 250-253.
[8] 张朝霞, 张轶庠, 文飞球, 等. 儿童传染性单核细胞增多症患者GST基因遗传多态性的研究[J]. 中国现代医学杂志, 2009,19(2): 227-230.
[9] 岳枫, 李长峰, 朱长波. EB病毒VCA-IgG、IgA抗体在自身免疫性疾病检测中的应用比较[J]. 实用医学杂志, 2015, 31(8):1256-1258.
[10] 郭建巍. EB病毒感染的核酸检测: 标本类型的选择[J]. 分子诊断与治疗杂志, 2016, 8(3): 145-149.
[11] 周亚玲. 407例小儿EB病毒感染临床分析[J]. 中国妇幼保健,2007, 22(23): 3246-3247.
[12] TSAI J D, LEE H C, LIN C C, et al. Epstein-Barr virus-associated acute renal failure: diagnosis, treatment, and follow-up[J]. Pediatr Nephrol, 2003, 18(7): 667-674.
[13] OZGURHAN G, OZCETIN M, VEHAPOGLU A, et al. Acute kidney injury complicated epstein-barr virus infection in infancy[J]. Case Rep Pediatr, 2015, 2015: 848959.
[14] 寻励, 李志辉, 段翠蓉, 等. 儿童EB病毒相关性肾脏损伤临床特点分析[J]. 中国实用儿科杂志, 2015, 1(30): 71-73.
[15] 严建华. 有关传染性单核细胞增多症发生肾损害的危险因素与预后的随访[J]. 医药前沿, 2014, 7(20): 57-58.
[16] 周玉平, 冯传成. 4777例CRP和WBC计数及手工分类的形态学检测结果[J]. 临床血液杂志, 2013, 26(2): 109-111.
[17] 左垺莲, 朱美娟, 都树娟, 等. EB病毒侵入宿主细胞机制的研究进展[J]. 病毒学, 2014, 30(4): 476-482.
[18] 朱易萍. 196例传染性单核细胞增多症的并发症[J]. 实用儿科临床杂志, 2003, 18(11): 902-903.
[19] 林应标, 李琦, 陈虹亮, 等. 患儿呼吸道感染EB病毒外周血淋巴细胞及异型淋巴细胞比值变化的临床研究[J]. 中华医院感染学杂志, 2017, 27(3): 667-670.
[20] YANG S I, GEONG J H, KIM J Y, et al. Clinical characteristics of primary Epstein Barr virus hepatitis with elevation of alkaline phosphatase and γ-glutamyltransferase in children[J]. 2014, 55(1):107-122.
[21] 古雪, 李铃, 敬雨佳, 等. 人类非嗜肝病毒所致肝炎患者临床特征的相关性分析[J]. 中国现代医学杂志, 2016, 26(6): 27-31.
[22] XIE Z D, WANG S X, ZHANG Z G, et al. Correlation factors of liver injury in infectious mononucleosis[J]. Chin J Postgrad Med,2012, 28(12): 893-895.
[23] KIMURA H, ITO Y, KAWABE S, et al. EBV-associated T/NK-cell lymphoproliferative diseases in nonimmunocompromised hosts: prospective analysis of 108 cases[J]. Blood, 2012, 119(3):673-686.
[24] 袁利群. EB病毒抗体检测在儿童传染性单核细胞增多症诊断中的应用[J]. 湖南师范大学学报(医学版), 2010, 7(3): 16-19.
[25] 钟帆. EB病毒壳体抗原IgM及核抗原IgG与淋巴细胞比值相关性分析[J]. 国际检验医学杂志, 2016, 37(6): 799-801.
[26] 梁倩妮. EB病毒衣壳抗原(VCA)IgA及核抗原1(NA1)IgG时间分辨荧光免疫定量检测试剂的研制[D]. 广州: 南方医科大学, 2015.
[27] MAYER H B, WANKE C A, WILLIAMS M, et al. Epstein-Barr virus-induced infectious mononucleosis complicated by acute renal failure: case report and review[J]. Clin Infect Dis, 1996, 22:1009-1018.
[28] JOANNE L B, FREDERICK M, GERARD J N, et al. Epstein-Barr virus infection of renal proximal tubule cells: posssible role in chronic interstitial nephritis[J]. J Chin Invest, 1999, 104(5):1673-1681.
[29] ANDRESDOTTIR M B, ASSMANN K J, HILBRANDS L B, et al. Primary Epstein-Barr virus infection and recurrent type imenbranoproliferative glomerulonephritis after renal transplantation[J]. Nephrol Dial Transplant, 2000, 15(8): 1235-1237.
[30] 陈晓丽, 杨芳, 王晨, 等. 膜性肾病肾组织 HCMV、EBV的原位杂交检测[J]. 中华肾病研究电子杂志, 2017, 6(2): 64-68.
[31] JOH K, KANETSUNA Y, ISHIKAWA Y, et al. Epstein-Barr virus genome positive tubulointerstitial nephritis associated with immune complex mediated glomerulonnephritis in chronic active EB virus infection[J]. Virchows Arch, 1998, 432(6): 567-573.
[32] 郭小梅, 徐前, 刘燕如, 等. 尿微量白蛋白、血β2微球蛋白、α1微球蛋白、胱抑素C在小儿感染性肾早期损害的临床意义[J]. 中国中西医结合儿科学, 2016, 8(1): 49-52.

