胰升血糖素样肽1对新诊断糖尿病患者分泌型卷曲相关蛋白1和β-连环蛋白表达水平的影响
王笑烨,袁景,孙峥,梁丽
[中国医科大学人民医院(辽宁省人民医院) 内分泌科,辽宁 沈阳 110016]
研究[1]发现,空腹血糖受损的肥胖人群β细胞量已降至正常人的60%,而新诊断2型糖尿病(type 2 diabetes mellitus,T2DM)患者的β细胞量仅为正常人的30%~70%。Wnt信号通路在细胞正常增殖、复制、分化过程调控中发挥重要作用,其异常活化与肿瘤的发生、发展密切相关。其中,分泌型卷曲相关蛋白1(secreted frizzled related protein 1,SFRP1)和β-连环蛋白(β-catenin)在通路中均具有重要的作用[2]。胰升血糖素样肽1(glucagon-like peptide 1,GLP-1)是由肠道L细胞分泌的具有多种功能的肠肽激素[3],研究[4-5]发现,Wnt信号通路通过直接或与GLP-1、炎症通路等相互作用的方式对胰岛β细胞的新生、增殖及其功能发挥调控作用,且可能介导外周组织与β细胞的对话机制,但国内该方面的相关研究较少。因此,本研究通过观察接受GLP-1类似物利拉鲁肽治疗后新诊断T2DM患者SFRP1和β-catenin表达水平的变化,探讨GLP-1对Wnt信号通路作用的可能机制,旨在为T2DM的治疗提供新的思路和方向。
1 资料与方法
1.1 一般资料
选取2015年1~12月于辽宁省人民医院内分泌门诊就诊或病房住院治疗的新诊断T2DM患者(T2DM组)72例作为研究对象,均符合1999年WHO关于糖尿病的诊断标准。其中,男性34例,女性38例;年龄45~65岁,平均(51.36±3.31)岁;糖尿病病程5~12个月,平均(6.19±2.08)个月。排除标准:T1DM、成人隐匿性自身免疫性糖尿病及其他特殊类型糖尿病患者;合并恶性肿瘤、严重肝肾功能障碍、急性感染、慢性炎症、外伤等应激状态者;患者入组前已开始接受降糖治疗,包括口服药、胰岛素及开始控制饮食和运动干预。另选取同期体检健康者80例作为健康对照(NC)组。其中,男性35例,女性45例;年龄44~63岁,平均(51.89±3.88)岁。本研究已经过该院伦理委员会审核,研究对象均知情同意。
1.2 方法
1.2.1 给药方法 T2DM组给予GLP-1类似物治疗(利拉鲁肽,国药准字J20160037,天津诺和诺德公司),前4周予1.2 mg 1次/d,4周后更改为1.8 mg 1次/d,共治疗12周。同时给予饮食和运动干预治疗。
1.2.2 指标测定 收集患者的性别、年龄、糖尿病病程、身高、体重等一般资料。分别于入组时、治疗12周及停药12周后测量患者的血压,计算体重指数(BMI)。空腹12 h以上于次日晨起抽取空腹静脉血,检测血糖(FPG)、糖化血红蛋白(Hemoglobin A1c,HbA1c)、胰岛素、血脂。血糖和血脂采用日本奥林巴斯公司AU2700全自动生化分析仪,以酶法测定;空腹胰岛素(fasting insulin,Fins)采用中国原子能科学研究院药盒,以放射免疫法测定;HbA1c采用美国BIO-RAD公司生产的Variant Ⅱ糖化血红蛋白分析仪,以高效液相色谱法测定。采用稳态模型评估法评估胰岛素抵抗指数(HOMA-IR)与胰岛素β细胞功能指数(HOMA-β),即HOMA-IR=Fins×FPG/22.5,HOMA-β=(20×FIns)/(FPG-3.5)。
1.2.3 SFRP1和β-catenin水平检测 于入组时、治疗12周时及停药12周时,分别抽取空腹静脉血5 ml,以3 000 r/min离心10 min,分离取上层血清,置于-80℃冰箱冷冻保存。采用酶联吸附免疫法(enzyme linked immunosorbent assay,ELISA)检测SFRP1和βcatenin水平,试剂盒购自武汉艾美捷科技有限公司,均按照说明书进行操作,批内差异<10%,批间差异<15%。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,同组间不同时间比较采用方差分析,两两比较采用配对样本t检验,并对检验水准进行校正。计数资料以例(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前基线资料的比较
T2DM 组 BMI、FPG、Fins、HbA1c、HOMA-IR、SFRP1及β-catenin与NC组比较,经独立样本t检验,差异有统计学意义(t=-6.426、-21.059、-16.954、-24.688、-57.261、-13.510 及 -48.714,均P=0.000),T2DM组高于NC组。两组HOMA-β比较,差异有统计学意义(t=9.560、P=0.000),T2DM组低于NC组。见表1。
2.2 T2DM组不同时间基线资料和SFRP1及β-catenin水平变化的比较
治疗12周和停药12周时BMI、FPG、HbA1c、TC、HDL-C及HOMA-IR与入组时比较,采用配对样本t检验,差异有统计学意义(t=4.307、5.567、3.173、8.800、7.991、7.694、9.044、2.978、4.338、3.498、10.002 及 10.592,P=0.000、0.000、0.004、0.000、0.000、0.000、0.000、0.006、0.000、0.002、0.000 及0.000),治疗12周和停药12周低于入组时;治疗12周和停药12周时HOMA-β与入组时比较,采用配对样本t检验,差异有统计学意义(t=-3.968和-2.054,P=0.000和0.003),治疗12周和停药12周高于入组时。治疗12周时和停药12周时SFRP1与入组时比较,采用配对样本t检验,差异有统计学意义(t=-9.294和-9.927,均P=0.000),治疗12周时和停药12周时高于入组时;停药12周时SFRP1与治疗12周时比较,采用配对样本t检验,差异有统计学意义(t=6.355,P=0.000),停药12周时低于治疗12周时。治疗12周时和停药12周时β-catenin与入组时比较,采用配对样本t检验,差异有统计学意义(t=18.468和6.956,均P=0.000),治疗12周时和停药12周时低于入组时;停药12周时β-catenin与治疗12周时比较,采用配对样本t检验,差异有统计学意义(t=18.129,P=0.000),停药12周时高于治疗12周时。见表2和附图。
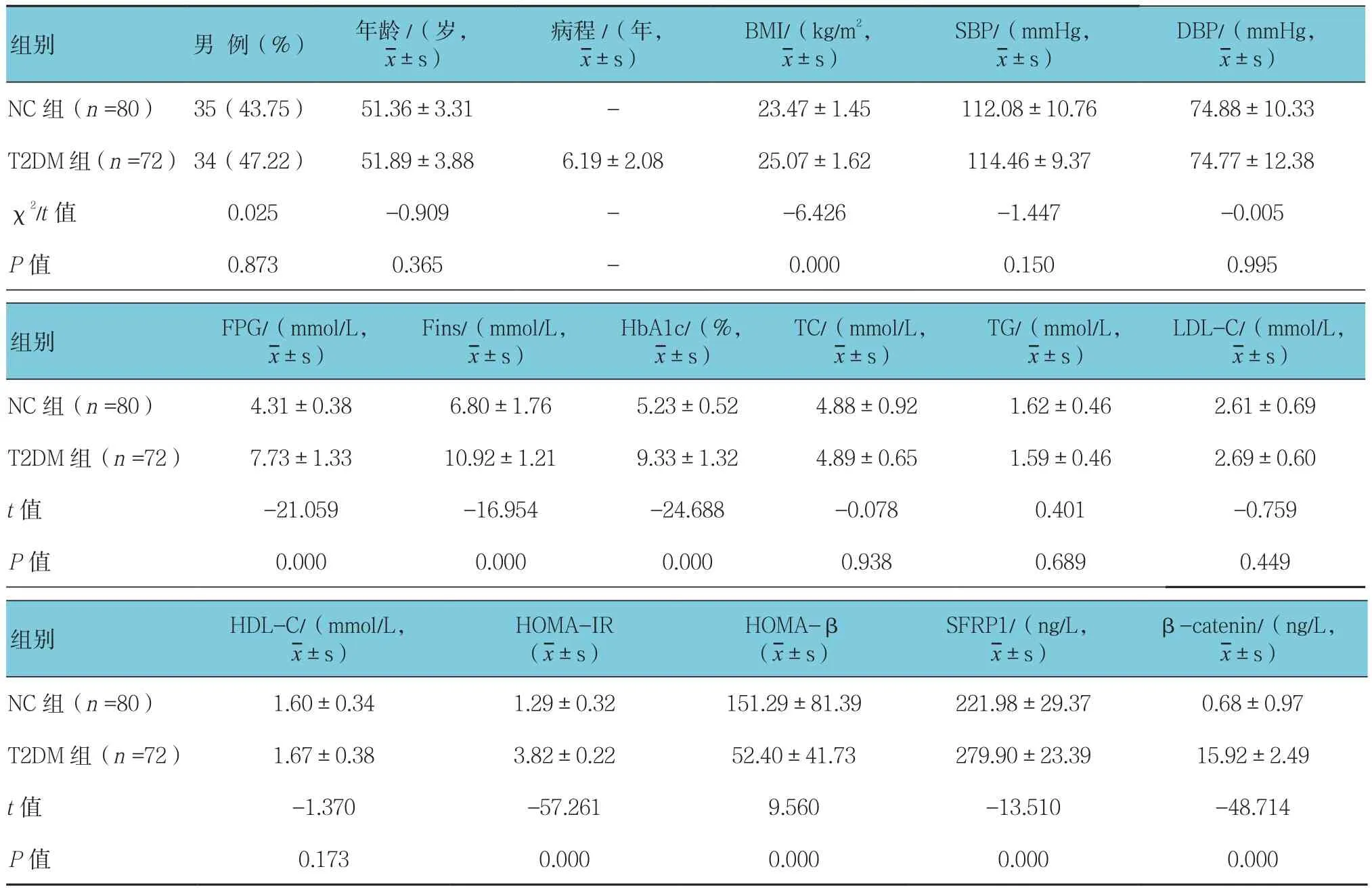
表1 两组治疗前基线资料的比较
表2 T2DM组不同时间基线资料和SFRP1、β-catenin水平变化的比较 (n =72,±s)
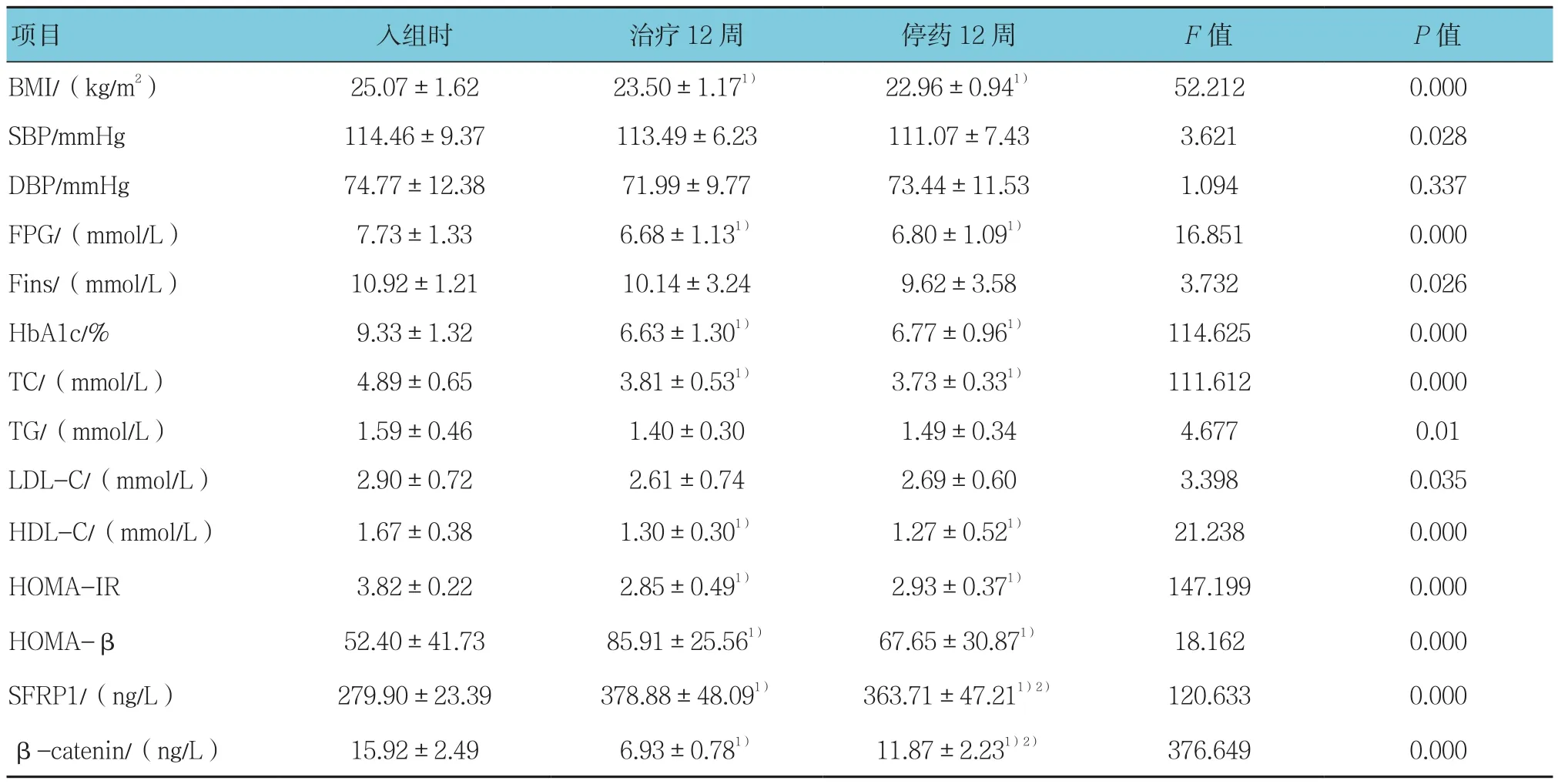
表2 T2DM组不同时间基线资料和SFRP1、β-catenin水平变化的比较 (n =72,±s)
注:1)与入组时比较,P <0.05;2)与治疗12周比较,P <0.05
项目 入组时 治疗12周 停药12周 F值 P值BMI/(kg/m2) 25.07±1.62 23.50±1.171) 22.96±0.941) 52.212 0.000 SBP/mmHg 114.46±9.37 113.49±6.23 111.07±7.43 3.621 0.028 DBP/mmHg 74.77±12.38 71.99±9.77 73.44±11.53 1.094 0.337 FPG/(mmol/L) 7.73±1.33 6.68±1.131) 6.80±1.091) 16.851 0.000 Fins/(mmol/L) 10.92±1.21 10.14±3.24 9.62±3.58 3.732 0.026 HbA1c/% 9.33±1.32 6.63±1.301) 6.77±0.961) 114.625 0.000 TC/(mmol/L) 4.89±0.65 3.81±0.531) 3.73±0.331) 111.612 0.000 TG/(mmol/L) 1.59±0.46 1.40±0.30 1.49±0.34 4.677 0.01 LDL-C/(mmol/L) 2.90±0.72 2.61±0.74 2.69±0.60 3.398 0.035 HDL-C/(mmol/L) 1.67±0.38 1.30±0.301) 1.27±0.521) 21.238 0.000 HOMA-IR 3.82±0.22 2.85±0.491) 2.93±0.371) 147.199 0.000 HOMA-β 52.40±41.73 85.91±25.561) 67.65±30.871) 18.162 0.000 SFRP1/(ng/L) 279.90±23.39 378.88±48.091) 363.71±47.211)2) 120.633 0.000 β-catenin/(ng/L) 15.92±2.49 6.93±0.781) 11.87±2.231)2) 376.649 0.000

附图 T2DM组不同时间SFRP1及β-catenin水平变化的比较
3 讨论
Wnt信号转导通路参与调节细胞的增殖、分化、运动及凋亡等,是细胞发育及形态形成所必需。Wnt信号通路的卷曲蛋白受体在人的胚胎以及成年胰腺的外分泌部和胰岛细胞上均有表达,Wnt信号通路的各种组成成分与胰岛母细胞增殖及胰岛素分泌关系密切。SFRP1是Wnt信号通路的负调控因子,是Wnt信号通路的主要拮抗剂,而β-catenin作为Wnt信号传导途径的核心元件参与通路调节,异常激活可以导致肿瘤、纤维增生等疾病的发生[6-7]。动物实验[8-9]发现,SFRP1和β-catenin与肾小管间质纤维化具有密切关系,可能导致糖尿病慢性肾脏疾病的发生和发展。在本研究中,T2DM组SFRP1和β-catenin水平高于NC组,提示糖尿病患者血清SFRP1和β-catenin水平较健康人升高,考虑可能与Wnt/β联蛋白信号通路在胰岛β细胞功能调控中的作用有关。Wnt/β联蛋白信号通路不仅可以调控β细胞的生长存活,且对调控成熟胰岛β细胞的分泌功能也有重要的作用。RULIFSON等[10]研究发现,经纯化的Wnt-3a蛋白溶液通过细胞周期调节蛋白刺激小鼠原代β细胞增殖,阳性β细胞的数量增加2倍,胰岛素的分泌量也明显增加,同时发现,SFRP1可阻断此作用。DESSIMOZ等[11]敲除胰腺上皮细胞的β-catenin基因后,发现胰岛细胞数量减少,胰岛素分泌量减少。
陆静尔等[12]研究发现,与二甲双胍治疗比较,采用GLP-1治疗对于新诊断T2DM患者可以更有效的控制空腹血糖和餐后血糖,同时降低血脂、血压,改善胰岛素抵抗水平等。本研究发现,与入组时比较,经过利拉鲁肽治疗12周后,T2DM组BMI、FPG、HbA1c、TC、HOMA-IR均较治疗前降低,HOMA-β较治疗前升高,差异有统计学意义,与以往研究[13]结果类似。规范使用GLP-1类似物利拉鲁肽治疗HbA1c可降低1.3%~1.5%,并能保护胰岛β细胞功能,增加胰岛素合成,改善血脂、降低血压等。本研究进一步分析发现,利拉鲁肽治疗12周时和停药12周时SFRP1较入组时升高,β-catenin较入组时降低,提示GLP-1可调节SFRP1和β-catenin的水平。有学者[14]认为,Wnt信号通路可能参与GLP-1对于胰岛β细胞的调控作用,是Wnt/β联蛋白通路在糖尿病领域受到重视的原因之一。作为β联蛋白与TCF的核内结合蛋白之一,TCF7L2可介导GLP-1在刺激β细胞增殖中的作用[15]。一项以锂模拟Wnt配体活性效益的动物实验[16]发现,在锂的刺激下,活化的β联蛋白可刺激大鼠ppI启动子的活性,也可以促进原代胎小鼠肠道细胞内源性ppI信使RNA的表达和GLP-1的产生。而TCF7L2与ppI启动子区域的G2部分的TCF结合序列在体内存在相互作用,且CF7L2基因多态性与T2DM发生风险的相关性已广泛受到关注。另外,Wnt配体蛋白Wnt 3a可以刺激ppI启动子的活化和mRNA的表达,GLP-1对Wnt信号通路可能也有影响[17]。
综上所述,GLP-1可提高新诊断T2DM患者SFRP1水平,降低β-catenin水平,其原因可能与GLP-1对Wnt信号通路的影响有关,但具体机制仍需进一步研究。
参 考 文 献:
[1] WEIR G C, BONNER-WEIR S. Islet β cell mass in diabetes and how it relates to function, birth, and death[J]. Ann N Y Acad Sci,2013, 1281: 92-105.
[2] POLAKIS P. Writ signaling and cancer[J]. Genes Dev, 2012, 4(5):1837-1851.
[3] YAMAGISHI S, FUKAMI K, MATSUI T. Crosstalk between advanced glycation end products (AGEs) -receptor RAGE axis and dipeptidyl peptidase-4-incretin system in diabetic vascular complications[J]. Cardiovasc Diabetol, 2015, 14(13): 2.
[4] CHEN G, LIU C, XUE Y, et al. Molecular mechanism of pancreatic β-cell adaptive proliferation: studies during pregnancy in rats and in vitro[J]. Endocrine, 2011, 39(2): 118-127.
[5] ALY H, ROHATGI N, MARSHALL C A, et al. A novel strategy to increase the proliferative potential of adult human β-cells while maintaining their differentiated phenotype[J]. PLoS One, 2013,8(6): e66131.
[6] 张孝艳, 乔玉环, 王琳, 等. 宫颈癌组织中sFRP1和β-catenin的表达及其意义[J]. 中国癌症杂志, 2011, 21(8): 610-614.
[7] ZHENG L, SUN D, FAN W, et al. Diagnostic value of SFRP1 as a favorable predictive and prognostic biomarker in patients with prostate cancer[J]. PLoS One, 2015, 10(2): e0118276.
[8] 石明隽, 肖瑛, 郭兵, 等. β-连环蛋白在糖尿病大鼠肾小管中的表达及意义[J]. 中国现代医学杂志, 2011, 21(5): 556-559.
[9] 段兴旺. 益肾胶囊对糖尿病肾病大鼠肾小管间质sFRP-1表达的影响[D]. 太原: 山西医科大学, 2012.
[10] RULIFSON I C, KARNIK S K, HEISCR P W, et al. Wnt signaling regulates pancreatic beta cell proliferation[J]. Proc Natl Acad Sei U S A, 2007, 104(15): 6247-6252.
[11] DESSIMOZ J, BONNARD C, HUELSKON J, et al. Pancreasspecific deletion of beta-catenin reveals Wnt-dependent and Wntindependent functions during development[J]. Curt Biol, 2005,15(18): 1677-1683.
[12] 陆静尔, 任跃忠, 龚维坤, 等. 利拉鲁肽治疗新诊断2型糖尿病患者临床疗效的观察[J]. 中国糖尿病杂志, 2014, 22(4): 350-352.
[13] 夏常杰, 李伶, 杨刚毅, 等. 利拉鲁肽对2型糖尿病患者血浆丝氨酸蛋白酶抑制剂水平的影响[J]. 中国老年学杂志, 2011,31(2): 181-183.
[14] 代喆, 徐焱成. Wnt经典通路对2型糖尿病β细胞功能的调控进展[J]. 医学综述, 2015, 21(10): 1831-1833.
[15] NOBREGA M A. TCF7L2 and glucose metabolism: time to look beyond the pancreas[J]. Diabetes, 2013, 62(3): 706-708.
[16] GARCÍA-MARTÍNEZ J M, CHOCARRO-CALVO A, MOYA C M, et al. WNT/beta-catenin increases the production of incretins by entero-endocrine cells[J]. Diabetologia, 2009, 52(9): 1913-1924.
[17] HELLER C, KÜHN M C, MÜLDERS-OPGENOORTH B, et al.Exendin-4 upregulates the expression of Wnt-4, a novel regulator of pancreatic β-cell proliferation[J]. Am J Physiol Endocrinol Metab, 2011, 301(5): E864-872.

