妊娠失败水牛血常规分析
程 蕾,谭明夏, 2,胡修忠,向 敏,刘晓华,余 婕,周 源,王定发
(1.武汉市农业科学院畜牧兽医研究所,湖北 武汉 430208,2.华中农业大学动物遗传育种与繁殖教育部重点实验室,湖北 武汉 430070 )
水牛养殖业在我国南方分布较为广泛,水牛虽然全年发情但存在卵泡发育不充分、发情表现不明显的特征,导致其受胎率普遍较低[1]。母牛单次配种后尽管受精率为90%以上,但是妊娠失败却高达35%~50%,是导致产犊率低下的主要原因,而绝大多数妊娠失败(70%~80%)发生在受精后的前3周,这其中又以14~19 d母体妊娠识别时期的早期胚胎丢失为主[2-3]。血液是机体内环境的重要组成部分,血常规是最基础的血液检验。在生产实践中对血液进行血常规分析,可以及时监测牛群状态并对机体是否存在感染、贫血以及血液系统疾病等及早诊断,从而通过提前预防治疗以及繁殖管理,降低实际生产中可能存在的风险[4]。目前,血细胞分析已被认为是牛疾病的一种诊断工具[5]。因此,为了探究水牛早期胚胎损失的原因,本研究对14头摩拉水牛进行了同期发情和人工授精,通过采集人工授精后0 d、18 d、20 d、23 d和28 d的外周血样本和血常规检测,研究其血常规数据的动态变化规律。结合早期妊娠阶段牛血常规数据和妊娠失败之间的内在关系分析,从血细胞参数变化方面对本试验牛群妊娠失败的原因进行深度分析,以便于制定相应的预防措施减少由早期妊娠失败带来的经济损失,同时也为血液方面的研究在相关动物繁殖和动物生产中的应用提供基础参考。
1 材料和方法
1.1 实验动物
实验牛来自于湖北省鄂州市某水牛养殖场,选取健康状况良好、体态相近的未孕摩拉水牛14头,用生源2+1法(宁波市三生药业有限公司)进行同期发情处理,并在发情后进行人工授精,采集人工授精后0 d、18 d、20 d、23 d和28 d的血液样本进行血常规分析。在人工授精后的第42 d利用直肠检查和B超检查进行妊娠诊断,诊断结果显示本次试验牛均为空怀牛。
1.2 仪器及检测指标
全自动血细胞分析仪ADVIA 2120i (SIEMENS)以及配套试剂,仪器开机后按照操作规程利用血液分析仪质控品(正常值)即3-in-1 TESTpointTM Hematology Controls(SIEMENS)首先对血液学检测系统的精密度和准确性进行监测,确保仪器工作正常后,在物种“牛(bovine)”模式下对水牛的五分类血液参数进行检测,检测指标见表1。

表1 牛全血参数指标及其参考范围
1.3 样本采集、预处理和上机检测
采集人工授精后0 d、18 d、20 d、23 d和28 d的血液样本。采血均在上午进行,采血前对保定牛的耳面进行消毒处理,耳静脉采血0.5~1 mL置于2 mL EDTA抗凝管中轻轻混匀,低温保存并运至实验室。利用全自动五分类血细胞分析仪分析血液中WBC(白细胞绝对值)、NEU(嗜中性粒细胞绝对值)、LYM(淋巴细胞绝对值)、RBC(红细胞)和PLT(血小板)等血液参数。上机前所有样本平衡至室温,血常规检测于采样当天完成。
1.4 数据分析和处理
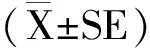
2 结果
2.1 妊娠失败摩拉水牛白细胞变化情况
人工授精后各时间点白细胞的各项数据汇如表2所示。通过与表1对比后发现:人工授精后0 d和18 d白细胞参数均在正常值范围或接近正常值。人工授精后20 d、23 d和28 d除嗜中性粒细胞绝对值(NEU)在正常值范围,白细胞(WBC)、单核细胞绝对值(MONO)和淋巴细胞绝对值(LYM)均超出了正常值范围。
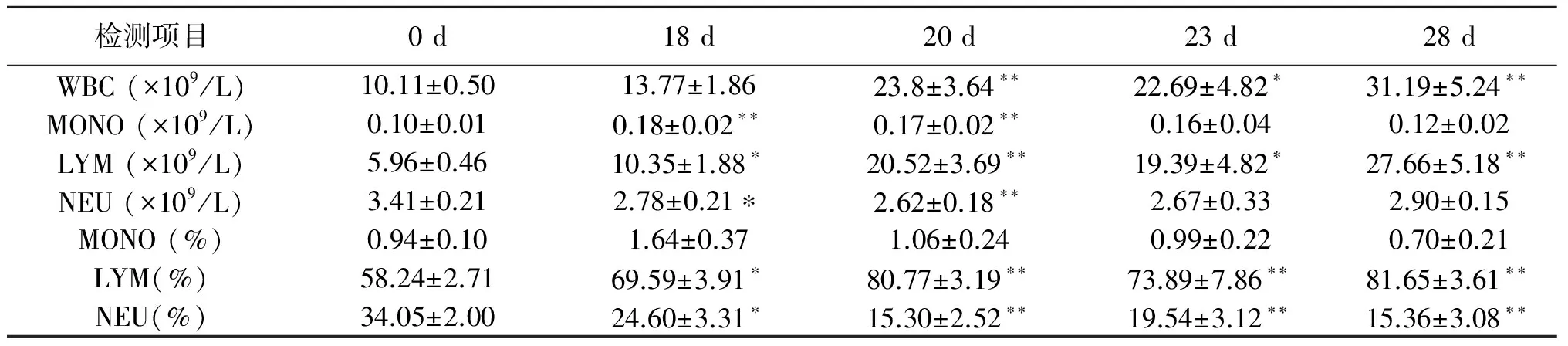
表2 摩拉水牛白细胞参数变化
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
从表2可以看出,WBC在人工授精后呈上升的趋势,并在20 d后显著增加(P<0.05);MONO在18 d和20 d极显著增加(P<0.01),但在之后的时间点无显著变化,其比例在各时间点无显著变化。NEU及其比例(NEU%)与0 d相比均显著降低(P<0.05)。LYM及其比例(LYM%)均呈现出增加的趋势,其显著性并随着时间点变化,由显著(P<0.05)变为极显著(P<0.01)。
2.2 妊娠失败摩拉水牛红细胞变化情况
人工授精后各时间点的红细胞参数如表3所示。人工授精后0 d,各红细胞参数均在正常值的范围或接近于正常值。而人工授精后18 d至28 d,除血红蛋白(HGB)和红细胞分布宽度变异数(RDW)外,其它红细胞参数均不在正常范围之内。与0 d相比,人工授精后18 d及之后的时间点,红细胞数(RBC)和红细胞压积(HCT)均极显著下降(P<0.01);红细胞平均体积(MCV)、红细胞平均血红蛋白含量(MCH)、红细胞平均血红蛋白浓度(MCHC)和RDW均极显著上升(P<0.01);各时间点HGB无显著变化。
2.3 妊娠失败摩拉水牛血小板变化情况
从表4可看出,试验期间平均血小板体积(MPV)无显著变化。与人工授精后0 d相比,18 d和20 d的血小板数(PLT)显著降低(P<0.05),23 d和28 d血小板数目出现一定量的增加;18 d、23 d和28 d的血小板分布宽度(PDW)极显著降低(P<0.01)。
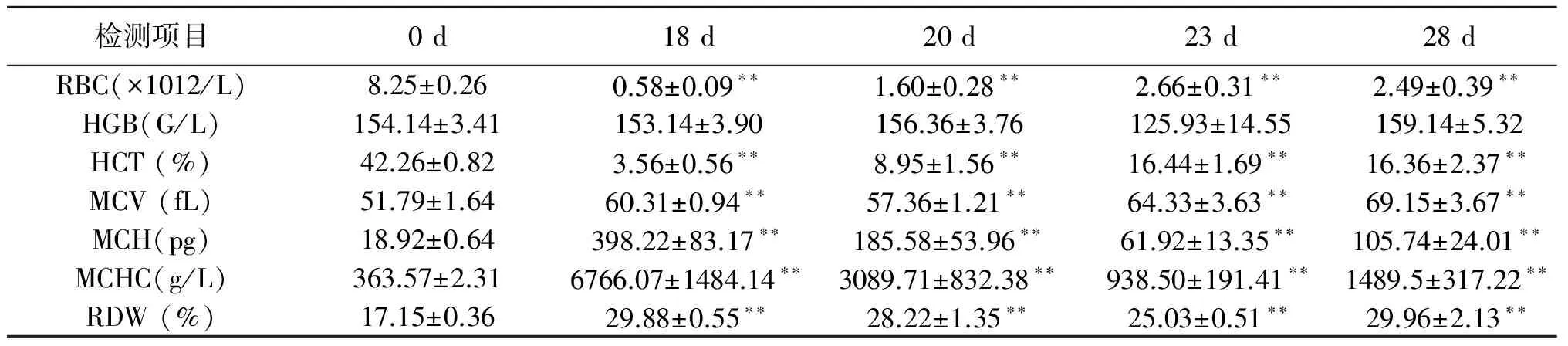
表3 摩拉水牛红细胞参数变化
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
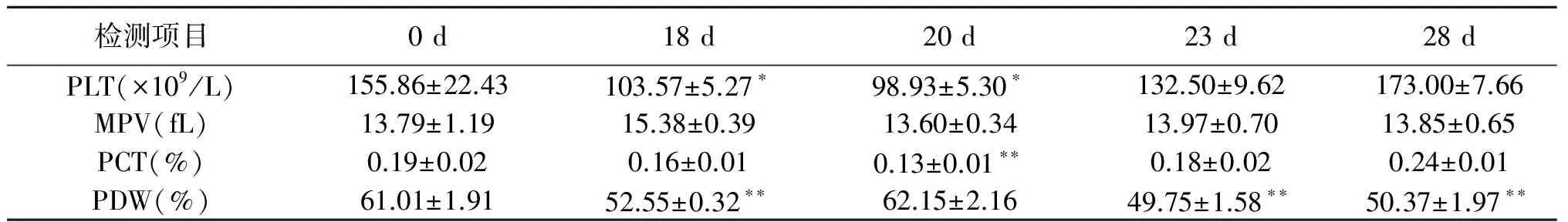
表4 摩拉水牛血小板参数比较
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
3 讨论
血常规指标是重要的、基本的生理指标,能直接客观地反映出疾病的变化及进程,在牛的健康检测、疾病诊断以及预后中的研究和应用越来越广泛[6-8]。本研究检测了妊娠失败摩拉水牛人工授精后0 d、18 d、20 d、23 d和28 d的血常规指标,结果显示0 d和18 d时白细胞参数均在正常值范围或接近正常值,提示试验牛在人工授精之前健康状况良好。而WBC于人工授精后20 d及其之后显著上升,并且超出正常值范围;同时NEU显著下降,MONO和LYM显著上升。单核细胞因含有较多的非特异性脂酶,能吞噬异物产生抗体,有非特异性防御和保护作用,但牛血液中单核细胞的数量容易发生变化,故不能作为疾病的敏感指示剂[9]。本研究结果也发现,MONO比例在整个试验过程中并没有显著变化,而且MONO绝对值上升的幅度很小,提示本次试验白细胞的上升主要是由LYM的升高引起。淋巴细胞是体内重要的免疫活性细胞,不具有吞噬功能,主要与浆细胞产生抗体物质,参与机体的特异性免疫反应[10];同时,T淋巴细胞还是介导细胞免疫的主要组分,妊娠识别与妊娠建立期间,母体在一定程度上需要通过弱化其细胞免疫实现对早期发育胚胎的免疫耐受。牛晖等[7]报道指出,由细菌感染引起的子宫内膜炎,患病奶牛NEU及其比例及显著增加,LYM比例极显著降低;同时也有报道指出病毒性疾病在临床上多表现为LYM和其比例上升[11]。本试验中NEU及其比例及显著降低,LYM及其比例显著上升,提示试验牛人工授精之后可能存在病毒性感染。本研究中,试验牛群平日为放养与圈养结合,以自然交配为主,日常管理方面较弱。另外,本次试验在人工授精以及血液采集的过程中均要对牛进行驱赶后绑定,对牛群而言其生活状态可能因过多人为因素干扰对其造成了一定的应激;而且本次试验血液样本的采集集中在5月份,江南地区此时阳光强度和日平均气温已经较高,可能会存在一定的热应激,这一系列活动影响了水牛的生理机能,降低了其免疫能力和抵抗力,从而会导致病原体更易入侵,使得淋巴细胞大量增殖。
试验牛在人工授精后各个时间点的红细胞参数显示,与0 d相比其它各时间点RBC和HCT均极显著下降(P<0.01),且均低于正常值,表明试验牛在人工授精18 d之后存在贫血症状。范超等[12]的研究表明,奶水牛犊牛断奶后红细胞数降低,而且HGB显著下降,提示可能由于断奶使犊牛产生厌食、消化不良等反应,导致体内铁含量降低而造成的贫血。本试验中HGB无显著变化,而且都在正常范围之内,因此可以排除是由缺铁而引起的贫血。同时研究结果也显示,试验牛MCV和RDW均显著增加,提示本试验可能由于大细胞不均一性引起的贫血[13]。而维生素或叶酸的缺乏均可引起大细胞贫血[14],这可能由于该试验场水牛因主要以肉用为主而平日营养供给不足导致日粮营养水平低下,不能满足其配种后的生理需求。
血小板是哺乳动物血液中的有形成分之一,是由骨髓成熟的巨核细胞胞质裂解而来的具有生物活性的小块胞质,具有促进止血和伤口愈合的作用。本次试验中人工授精后18 d和20 d PLT显著下降(P<0.05),而且整个试验期间PLT均低于正常值范围。血小板的大量减少会导致凝血功能的不足,从而出现出血症状,有报道称血小板数量减少会使母体血液凝固不良,从而导致母体妊娠失败[15]。因此,这也可能是导致本次试验牛妊娠失败的原因之一。
4 结论
本研究通过对配种后妊娠失败水牛的血常规数据检测分析发现,某些关键血常规指标发生了显著变化,其中,白细胞数显著上升主要由淋巴细胞及其比例的上升所致,暗示:试验水牛人工授精后对早期发育胚胎未能达到一种较好免疫耐受状态,这与牛群应激可能存在一定的关系;另外,授精后红细胞数和红细胞压积显著下降也说明需要进一步改善牛群日粮供给。本研究对于通过加强平时繁殖管理提升母水牛受胎率具有积极的指导意义。
参考文献:
[1] 邓青云. 浅谈水牛配种受胎率低的原因和对策[J]. 畜禽业, 2017,28(6):73-74.
[2] Minten M A, Bilby T R, Bruno R G, et al. Effects of fertility on gene expression and function of the bovine endometrium[J]. PLoS One, 2013, 8(8):e69444.
[3] Diskin M G, Morris D G. Embryonic and early foetal losses in cattle and other ruminants[J]. Reproduction in domestic animals, 2008, 43 Suppl 2:260-7.
[4] 常玉荣, 石峻, 殷华, 等. 血细胞形态学观察对血液系统疾病诊断的意义[J]. 检验医学, 2007, 22(1):78-80.
[5] Roland L, Drillich M, Iwersen M. Hematology as a diagnostic tool in bovine medicine[J]. Journal of Veterinary Diagnostic Investigation: official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc, 2014, 26(5):592.
[6] 雷虹, 龙云, 蔡文杰, 等. 热应激对湘西黄牛常规血液生化指标的影响[J]. 湖南畜牧兽医, 2016,38(1):38-40.
[7] 牛晖, 徐照学, 王二耀, 等. 奶牛子宫内膜炎血常规分析及病原分离鉴定[J]. 河南农业科学, 2015,44(8):141-144.
[8] 陈利霞. 复方中药制剂乳炎清治疗临床型奶牛炎的临床观察[J]. 草食家畜, 2017,38(2):42-46.
[9] Jones M L, Allison R W. Evaluation of the ruminant complete blood cell count[J]. The Veterinary clinics of North America. Food animal practice, 2007, 23(3):377-402.
[10] 麻延峰, 傅春泉, 王宏艳, 等. 金华地区奶牛子宫内膜炎的血常规变化研究[J].中国奶牛,2007,25(4):29-32.
[11] 陈宏梁. 犬的血常规检查与临床治疗意义[J]. 浙江畜牧兽医, 2011,57(3):33-34.
[12] 范超, 吴勇, 刘孝然, 等. 断奶应激对奶水牛犊牛血液生理生化指标和免疫功能的影响[J]. 中国畜牧兽医, 2016, 43(7):1749-1754.
[13] 张雪琳. MCV/RDW贫血分类法在妊娠期贫血的应用[J]. 国际检验医学杂志, 2013, 34(13):1763-1764.
[14] 张霞. 大细胞性贫血的病因及形态学观察[J]. 中国医药导报, 2010, 7(6):77-78.
[15] 吴新华, 雷虹, 刘莹莹,等. 湘西黄牛青年牛妊娠前后常规血液生化指标分析[J]. 湖南畜牧兽医, 2013,35(1):14-16.

