冻融囊胚移植结局的影响因素分析
邱乒乒,王烨,纪红,沙艳伟,何雪梅,李萍
(厦门市妇幼保健院,厦门 361003)
在辅助生殖领域,囊胚移植与卵裂胚相比显示出更为明显的优势:①有利于挑选发育潜能更大的胚胎;②具有更高的种植率;③有效降低移植胚胎数;④胚胎与子宫内膜的同步性更佳[1]。近年来随着囊胚培养液体系的逐步改善及囊胚冻融技术的日益成熟,囊胚培养与移植在辅助生殖领域得到越来越广泛的应用。较多研究证实复苏周期囊胚移植的临床妊娠率、种植率均显著优于新鲜周期[2-3]。由于冻融D3胚胎后行囊胚培养可能导致取消移植周期的增多,加重患者的经济和心理负担,加之目前囊胚冻融后的复苏存活率已与卵裂期胚胎无异,因此大部分生殖中心多在新鲜周期行囊胚培养,将可用囊胚进行冷冻后再行冻融囊胚移植。本研究回顾性分析我院2016年1~12月复苏周期中380例囊胚移植的临床数据资料,比较囊胚发育天数、囊胚质量、移植囊胚数等因素对临床妊娠结局的影响,以优化复苏周期的囊胚移植策略,为复苏周期行选择性单囊胚移植提供依据。
资料与方法
一、研究对象
选取2016年1~12月在厦门市妇幼保健院生殖医学科行冻融囊胚移植的患者资料。
纳入标准:新鲜周期不孕原因为输卵管因素、子宫内膜异位症(EM)及子宫腺肌症(AM)、男方因素。
排除标准:在一个复苏周期中同时移植D5和D6囊胚的患者以及移植D7囊胚的患者。
按照以上标准共纳入 357 例患者,共380个冻融囊胚移植周期。根据妊娠结局将患者分为2组:临床妊娠组(259周期);未临床妊娠组(121周期)。
二、方法
1.囊胚培养及评分:本研究纳入的357例患者在新鲜周期中所采用的促排卵方案按照本中心的常规进行,获卵后行IVF或ICSI授精。胚胎培养采用Vitrolife(瑞典)序贯培养液。培养环境为37℃、6% CO2、5% O2和89% N2。受精后第3日挑选2个优质胚胎进行移植或冷冻,剩余胚胎转移至囊胚培养液中继续培养。D5和D6分别观察囊胚形成情况。
囊胚评分参考Gardner评分系统[4]。根据囊腔的扩张程度对囊胚进行分期,共分为1~6期。对3~6期的囊胚行进一步的评价。
内细胞团(inner cell mass,ICM)评分:A,细胞数目多,排列紧密,碎片少;B,细胞数目较少,结合较松散;C,细胞数目极少,难以辨认。
外滋养层(TE)评分:A,细胞数量>10,大小均匀;B,细胞数量≈10,大小不均;C,细胞数量<10,大小不均,存在碎片。
本实验室将ICM与TE的评分为AA、BA、AB、BB的囊胚定义为优质囊胚。
考虑到早期囊胚的复苏率不佳,本实验室将发育到3期以上的囊胚进行冷冻保存。冷冻囊胚标准为:3期以上且内细胞团评级在B级以上的囊胚。
2.囊胚冷冻及复苏:本实验室采用玻璃化冷冻方法进行囊胚冷冻。囊胚冷冻之前使用激光打孔的方法进行人工皱缩,其后的冷冻及复苏操作均按照Origio(丹麦)玻璃化冷冻、解冻试剂盒说明书进行。解冻后的囊胚培养3~8 h后进行移植,解冻后2 h依据囊胚腔是否重新扩张来判断囊胚是否存活。
3. 子宫内膜的准备与囊胚移植:⑴人工周期:D2~D3开始口服戊酸雌二醇(补佳乐,拜耳,德国)4 mg/d,每隔5~7 d监测一次内膜,每次以2 mg递增,当内膜≥7 mm(服用补佳乐至少14 d后)口服黄体酮(安琪坦,博赏,法国)(300 mg,2次/d),黄体酮转化6 d后冻胚移植。⑵降调人工周期:D1~D2采用B超检查子宫、卵巢、AFC数目及大小等盆腔情况,注射长效GnRH-a 3.75 mg,28~35 d后开始口服补佳乐(2 mg,2次/d),每隔5~7 d监测一次内膜,每次以2 mg递增,当内膜≥7 mm(服用补佳乐至少14 d后)口服黄体酮(300 mg,2次/d),黄体酮转化6 d后冻胚移植。
移植后使用黄体酮凝胶(雪诺同,默克雪兰诺,瑞士)90 mg/d阴道给药行黄体支持,至移植后10 d测血β-HCG。
4.移植后结局判定:胚胎移植后4~6周,B超探及妊娠囊,确诊为临床妊娠;B超未探及妊娠囊判定为未临床妊娠。拟诊异位妊娠或宫内合并宫外妊娠者,积极观察,一经确诊尽早留院处理。临床妊娠率=临床妊娠周期数/移植囊胚周期数×100%。
三、统计学方法

结 果
一、患者基础情况比较
2016年1~12月本院进行囊胚复苏的共380个周期。根据妊娠结局将患者分临床妊娠组和未临床妊娠组,两组患者的年龄、BMI、AMH、内膜厚度、不孕原因构成比均无统计学差异(P>0.05);与妊娠组比较,未妊娠组患者不孕年限显著增长(P<0.05)(表1)。
二、两组患者的临床治疗及移植情况
统计结果显示,两组患者的治疗方式无显著性差异(P>0.05);与妊娠组比较,未妊娠组患者平均移植胚胎数显著减少(P<0.01);妊娠组中D5囊胚所占的比例显著高于未妊娠组(P<0.01);妊娠组中双优胚所占的比例显著升高(P<0.01),非优胚所占的比例显著降低(P<0.01);妊娠组中优质囊胚(双优囊胚数与单优囊胚数之和)所占的比例显著高于未妊娠组(P<0.01)(表2)。
三、Logistic回归分析
从上述未经其他因素校正的统计数据得出,囊胚质量和囊胚发育速度与临床妊娠率有关,因此在单因素分析中可将囊胚质量及囊胚发育天数作为预测临床妊娠的两个独立指标。为了进一步综合分析各因素对妊娠结局的影响,将是否临床妊娠作为因变量,女方年龄、不孕年限、囊胚发育天数、移植优质囊胚数作为自变量进行Logistic回归分析。
分析结果显示,≥39岁患者的妊娠率显著低于<35岁组[OR0.339,95%CI(0.130,0.886);P=0.027);双优胚和单优胚移植组间的妊娠率无统计学差异[OR0.579,95%CI(0.290,1.156);P=0.121),而非优胚移植组的妊娠率相较双优胚移植组显著下降[OR0.362,95%CI(0.174,0.753;P=0.007);在校正了以上各因素后,D5和D6囊胚的临床妊娠率差异无统计学意义(P>0.05)(表3)。
讨 论
随着囊胚玻璃化冷冻技术的日趋成熟,与新鲜周期相比,复苏周期囊胚移植更具优势。可能原因是囊胚冻融本身也构成对囊胚的一种筛选,发育潜能较低或质量较差的囊胚在冻融之后不能实现再次扩张[5-6],而在进行复苏周期移植时弃用了这部分囊胚。在新鲜周期中D5形成囊胚的种植率和妊娠率明显高于D6形成的囊胚,其原因可能是受到了内膜容受性的影响[7-10]。而复苏周期中的内膜因素得以更好的控制,更能客观地对各影响因素进行分析,因此本文选取复苏周期中的囊胚移植为研究对象,通过单因素分析及多元Logistic回归比较了囊胚发育天数、囊胚质量、移植胚胎数等因素对妊娠结局不同的影响。
表1 两组患者基本资料[(-±s),n(%)]
注:与妊娠组相比,*P<0.05
表2 两组患者的移植情况[(-±s),n(%)]
注:与未妊娠组比较,*P<0.01
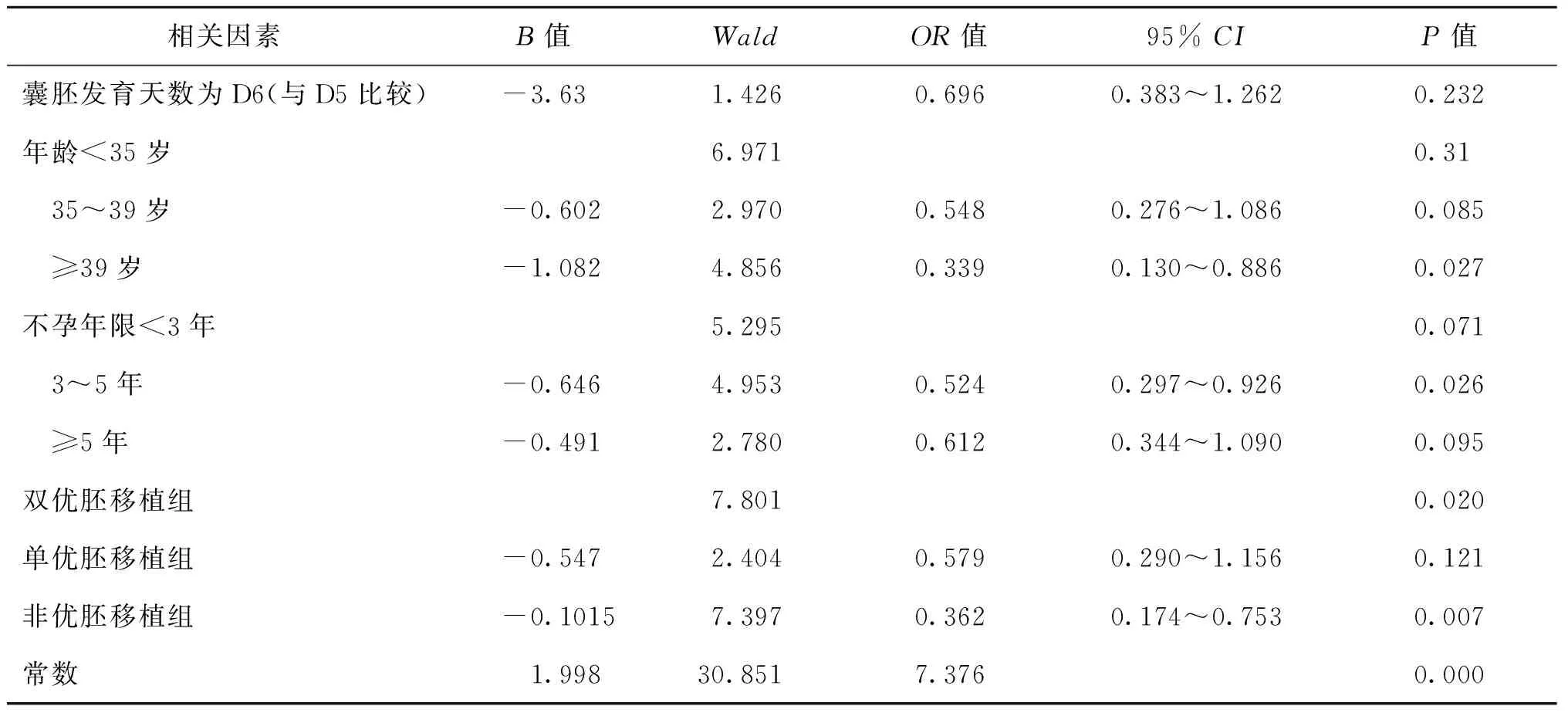
表3 Logistic回归Enter法
目前关于囊胚发育天数是否会对妊娠率和种植率产生影响,文献报道的结果并不一致。有学者发现现D5和D6囊胚的整倍体率并无统计学差异[11]。一项纳入15篇复苏周期囊胚移植文章的Meta分析,统计了2 502个冻融囊胚移植周期,发现D5组囊胚移植后的临床妊娠率、继续妊娠率和活产率明显高于D6组,但是精确比较D5和D6发育到同一阶段的囊胚移植结局时并无统计学差异[12]。在本研究中,进行囊胚发育天数的单因素分析时,D5囊胚的临床妊娠率显著高于D6囊胚。然而随后进行的多元Logistic回归分析显示囊胚发育天数的差异对妊娠结局无显著的影响,临床妊娠率与移植优质胚胎数的相关性最大。D5的平均移植囊胚数为(1.75±0.43)枚,D6的平均移植囊胚数为(1.66±0.48)枚(P=0.11),二者无统计学差异。因此本研究数据表明,囊胚质量对妊娠结局的影响大于囊胚发育速度。Yang等[13]也报道了相似的结果,其将1 374个D5囊胚复苏周期和255个D6囊胚复苏周期进行分析,发现D5优质囊胚和D6优质囊胚的临床妊娠率、种植率无显著差异(分别为52.4% vs. 52.6%;38.9% vs. 35.6%)。故我们建议在进行复苏周期囊胚移植时,应首先选择评级高的囊胚;而在囊胚评级相同的情况下,优选D5形成的囊胚进行移植。
近期文献报道,在新鲜周期中,囊胚的扩张程度、内细胞团评级和外滋养层评级与临床妊娠率及活产率有密切联系[14]。Kresowik等[15]的研究表明与非扩张期的囊胚相比移植扩张期的囊胚会得到更高的种植率。本研究选择3期以上的囊胚进行冷冻,在期别上有较好的同质性,规避了囊胚不同期别对临床结局的影响。另有一些研究表明无论在新鲜周期还是在复苏周期中TE的评级对临床结局最具预测价值[16-18],移植ICM评级为A的囊胚能够降低早期流产的风险[14]。与大多数文献相同,我们对于囊胚的评分也采用了Gardner评分系统,但此系统对于ICM和TE形态学的描述较宽泛,因此不同的胚胎学家对囊胚评级带有较大的主观性。本研究中我们对于ICM和TE的评级采用了更具体的量化标准,减少了本实验室不同的评分者之间的主观差异。在此前提下,我们分析数据得出移植优质囊胚组的临床妊娠率显著高于非优质囊胚组,即ICM和TE评级高的囊胚其妊娠率也较高,这一结论与前人的报道一致。同时我们也关注到,有文献研究表明囊胚的扩张程度、内细胞团评级和外滋养层评级三者之间可能存在内在的联系。扩张程度高的囊胚其TE细胞数也较多,连接紧密,功能也比较好[16]。而ICM和TE之间也有关联,囊胚评级为AA、BB、CC的概率高于其他组合[14]。因此更好地了解三种形态学参数之间的内在关联有利于在选择最优囊胚移植上达成共识。
众多研究表明,多胎妊娠显著增加妊娠期糖尿病、高血压、剖宫产等产妇风险,同时也增加新生儿的早产率、低体质量儿率及死胎率[19]。因此为了保障单胎活产率,国内外领先的生殖中心已开始实施选择性单囊胚移植。本研究的数据显示复苏周期中单优胚移植组的临床妊娠率与双优胚组之间无显著性差异,因此对于<35岁,且有优质囊胚的患者应优先选择单囊胚移植。
【参考文献】
[1] Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. Blastocyst culture and transfer in clinical-assisted reproduction: a committee opinion[J]. Fertil Steril,2013,99: 667-672.
[2] Zhu D,Zhang J,Cao S,et al. Vitrified-warmed blastocyst transfer cycles yield higher pregnancy and implantation rates compared with fresh blastocyst transfer cycles—time for a new embryo transfer strategy?[J]. Fertil Steril,2011,95: 1691-1695.
[3] 何巧花,李杭生,张国玲,等. 新鲜囊胚与玻璃化冷冻囊胚复融周期移植的临床结局比较[J]. 生殖医学杂志,2014,23: 809-812.
[4] Gardner DK,Lane M,Stevens J,et al. Blastocyst score affects implantation and pregnancy outcome: towards a single blastocyst transfer[J]. Fertil Steril,2000,73: 1155-1158.
[5] Yin H,Hong J,He R,et al. The effects of blastocyst morphological score and blastocoele re-expansion speed after warming on pregnancy outcomes[J].Clin Exp Reprod Med,2016,43: 31-37.
[6] Shu Y,Watt J,Gebhardt J,et al. The value of fast blastocoele re-expansion in the selection of a viable thawed blastocyst for transfer[J]. Fertil Steril,2009,91: 401-406.
[7] Shapiro BS,Daneshmand ST,Garner FC,et al. Contrasting patterns in in vitro fertilization pregnancy rates among fresh autologous,fresh oocyte donor,and cryopreserved cycles with the use of day 5 or day 6 blastocysts may reflect differences in embryo-endometrium synchrony[J]. Fertil Steril,2008,89: 20-26.
[8] 宋文妍,侯小漫,吴亮,等. 体外受精-胚胎移植周期中不同天数和发育阶段囊胚移植妊娠结局的比较[J]. 生殖与避孕,2016,36: 807-815.
[9] Wang X,Zhen J,Sun Z,et al. Effects of fifth day(D5) or sixth day(D6) frozen-thawed blastocysts on neonatal outcomes[J].Zygote,2016,24: 684-691.
[10] Elgindy E,Elsedeek S E. Day 5 expanded blastocysts transferred on same day have comparable outcome to those left for more extended culture and transferred on day 6[J].J Assist Reprod Genet,2012,29: 1111-1115.
[11] Capalbo A,Rienzi L,Cimadomo D,et al. Correlation between standard blastocyst morphology,euploidy and implantation: an observational study in two centers involving 956 screened blastocysts[J].Hum Reprod,2014,29: 1173-1181.
[12] Sunkara SK,Siozos Abolton VN,Khalaf Y,et al. The influence of delayed blastocyst formation on the outcome of frozen-thawed blastocyst transfer: a systematic review and meta-analysis[J].Hum Reprod,2010,25: 1906-1915.
[13] Yang H,Yang Q,Dai S,et al. Comparison of differences in development potentials between frozen-thawed D5 and D6 blastocysts and their relationship with pregnancy outcomes[J].J Assist Reprod Genet,2016,33: 865-872.
[14] Van DE,Balaban B,Ziebe S,et al. Association between blastocyst morphology and outcome of single-blastocyst transfer[J/OL].Reprod Biomed Online,2013,27: 353-361.
[15] Kresowik JDK,Sparks AET,Van Voorhis BJ. Clinical factors associated with live birth after single embryo transfer[J]. Fertil Steril,2012,98: 1152-1156.
[16] Ahlström A,Westin C,Reismer E,et al. Trophectoderm morphology: an important parameter for predicting live birth after single blastocyst transfer[J].Hum Reprod,2011,26: 3289-3296.
[17] Hill MJ,Richter KS,Heitmann RJ,et al. Trophectoderm grade predicts outcomes of single-blastocyst transfers[J]. Fertil Steril,2013,99: 1283-1289.
[18] Honnma H,Baba T,Sasaki M,et al. Trophectoderm morphology significantly affects the rates of ongoing pregnancy and miscarriage in frozen-thawed single-blastocyst transfer cycle in vitro fertilization[J]. Fertil Steril,2012,98: 361-367.
[19] 来天娇,郭艺红. 多胎妊娠减胎术伦理争议[J]. 生殖医学杂志,2017,26: 219-223.

