肥胖对雄性大鼠生殖功能影响的机制研究
郭颖,王晓尉,周芳,安琪,谷翊群*
(1.国家卫生计生委男性生殖健康重点实验室,国家卫生计生委科学技术研究所,北京 100081;2. 北京协和医学院研究生院,北京 100730)
有调查显示,我国中老年人群中半数以上的人处于超重/肥胖状态[1]。而肥胖对男性生殖的影响越来越受到关注[2-4]。研究表明,肥胖状态往往伴随着活性氧(ROS)的增加,Bakos等[5]发现高脂饮食导致大鼠精子DNA碎片化指数(DFI)增加同时精子活力下降。肥胖状态可能通过增加机体氧化损伤水平导致生精障碍,然而目前关于肥胖对精子活力的影响尚未定论[6]。本研究通过高脂饮食构建营养性肥胖的大鼠模型,研究肥胖对雄性大鼠生殖功能的影响,初步探讨其氧化损伤相关的机制。
资料与方法
一、研究对象
6周龄SD雄性大鼠45只,体重(130.4±7.2)g,由北京维通利华提供[许可证号:SCXK(京)2012-0001]。
二、方法
1.构建肥胖模型:45只雄性SD大鼠随机分成对照组(普通饲料)和肥胖组(高脂饮食:普通饲料73%、蔗糖10%、蛋黄粉5%、胆盐0.5%、胆固醇1.5%、猪油10%),自由进食饮水,两组除饮食外其他饲养条件均一致。喂养16周后,测定大鼠体重和身长。
2.肥胖判定标准:目前Lee指数是评价成年大鼠肥胖的常用数据。根据文献报道高脂饮食喂养过程中动物可出现肥胖和肥胖抵抗,再结合Lee指数,本实验中将肥胖组体重位于后25%位的大鼠去除[7]。因此,最终得到对照组(n=15)和肥胖组(n=22)。
3.计算身体指数:腹腔注射戊巴比妥(30 mg/kg),麻醉后取材。称取内脏脂肪、双侧睾丸和附睾的重量。计算相关参数:Lee指数=[体重(g)×103/身长(cm)]1/3;脂肪、睾丸和肾脏系数=器官重量/体重×100%。
4.代谢和内分泌指标测定:腹主动脉取血,4℃、2 400 r/min离心20 min分离血清,-80℃冻存。由酶联免疫法(上海泸峰化工)和放射免疫法(北京北方生物)测定,具体方法过程根据试剂盒中说明书操作,其中代谢指标包括葡萄糖(GLU)、胰岛素(INS)、胆固醇(TC)、甘油三酯(TG)、瘦素(Lep),内分泌指标包括促性腺激素释放激素GnRH、LH、FSH、总睾酮(TT)、雌二醇(E2)、性激素结合球蛋白(SHBG)。依据公式计算:游离睾酮指数(FTI)=T/SHBG、睾酮分泌指数(TSI)=LH/T、游离睾酮(cFT)=[T-23.43cFT/SHBG-(T-23.43cFT)]×10-9mol/L。
5.精子参数:附睾尾经37℃生理盐水简单洗涤,置于2 ml冻存管中剪碎再加入精子洗涤液中,37℃水浴箱中轻微震荡孵育30 min。计算机辅助精子分析系统(CASS)计数精子浓度、活力和前向运动。
6.生精细胞凋亡检测:取大鼠睾丸,Bouins液固定、石蜡包埋后切片。依据试剂盒(罗氏,美国)操作说明测定睾丸组织生精细胞的凋亡情况,光学显微镜下观察至少5个视野,计数500个生精细胞。凋亡细胞指数(AI)=凋亡细胞数/500×100%。
7.睾丸组织氧化应激检测:用玻璃匀浆管制作睾丸组织匀浆液,冰上进行。4℃、12 000 r/min离心15 min,取上清液,考马斯亮蓝染色测定总蛋白浓度。参照试剂盒(南京建成生物)说明测定超氧化物歧化酶(SOD)活力和丙二醛(MDA)浓度。
三、统计学处理
结 果
一、两组大鼠身体指标和代谢参数比较
喂养16周后,肥胖组大鼠体重、Lee指数、脂肪系数显著升高而睾丸系数、肾脏系数显著降低,血清中Lep、INS、TG显著升高,与对照组相比差异具有统计学意义(P<0.05);两组大鼠的身长、GLU和TC无显著性差异(P>0.05)(表1)。
二、两组大鼠生殖内分泌激素结果比较
统计分析发现,与对照组比较,肥胖组大鼠GnRH、LH、TT、SHBG显著降低而E2显著升高,经公式计算的FTI、cFT差异均具有统计学意义(P<0.05);两组大鼠血清FSH未见显著性差异(P>0.05)(表2)。
三、两组大鼠附睾尾精子计数
统计结果显示,与对照组比较,肥胖组大鼠附睾尾精子活力和前向运动精子百分比显著下降(P<0.01);两组大鼠的精子浓度无明显差异(P>0.05)(表3)。
四、睾丸生精细胞凋亡与氧化应激的检测
TUNEL法检测肥胖组大鼠生精细胞凋亡指数较对照组显著增加(P<0.05),肥胖组大鼠睾丸组织匀浆MDA浓度显著升高而SOD活力显著降低(P<0.05)(表4)。
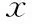
表1 一般身体指标和代谢参数(-±s)
注:与对照组比较,*P<0.05,#P<0.01
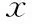
表2 生殖-内分泌激素检测结果(-±s)
注:与对照组比较,*P<0.05,#P<0.01
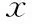
表3 两组精子参数的比较(-±s)
注:与对照组比较,*P<0.01
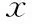
表4 两组AI、MDA和SOD比较(-±s)
注:MDA、SOD单位:每毫克蛋白的浓度、活力;与对照组比较,*P<0.05,#P<0.01
讨 论
目前,肥胖对男性生殖的影响尚无定论。一项回顾性分析发现约1/3的文章报道肥胖会导致精子活力和精子浓度的下降[6]。近期也有学者发现,超重或者肥胖是男性少精子症、无精子症的高危因素[8-9]。鉴于人群中的研究容易受到其他因素(如生活习惯、药物使用等)的干扰,因此本研究采用模式生物SD雄性大鼠为研究对象,条件可控。
本项研究的基础是营养性肥胖大鼠模型的建立,与对照组相比,高脂饮食诱导大鼠的体重和Lee指数明显增加,说明肥胖模型造模成功。另外内脏脂肪也是判断肥胖的重要体质指标,实验中测定两组大鼠肠系膜、肾周和睾周脂肪在内的总脂肪重量及脂肪系数,高脂饮食组明显高于普通饮食组。瘦素是由脂肪细胞分泌的抑制肥胖的一种蛋白,但是处于肥胖状态时,机体不仅降低对自身瘦素的反应,并对外源瘦素产生抗性[10]。此外,脂质代谢紊乱也与肥胖关系密切。本研究中,肥胖组大鼠出现了高瘦素、高胰岛素和高甘油三脂,说明肥胖大鼠出现瘦素抵抗和代谢紊乱。
有数据表明,雄激素低下与体重升高有一定的关联,而严重肥胖可能导致机体下丘脑-垂体-性腺轴功能的紊乱[11]。一项生物信息学的研究结果显示,肥胖状态下机体生殖功能受到影响可能与类固醇激素、肽类激素代谢改变有重要关系[12]。睾酮是精子发生的关键激素,睾酮合成受LH激活的cAMP/PKA通路的调控,本实验中睾酮水平的降低并伴随着GnRH和LH的下降,我们推测肥胖抑制了HPT的整个通路。此外,肥胖状态下脂肪细胞产生过多的芳香化酶,从而导致睾酮转化E2增多,而E2的增加进一步抑制HPT轴,进一步抑制睾酮的合成和分泌。再者血清学分析显示肥胖组大鼠SHBG水平显著低于正常组大鼠,而性激素结合球蛋白(SHBG)在雄激素运输过程中发挥着重要的保护作用,这可能也是肥胖组大鼠睾酮低的原因之一。
细胞凋亡是机体生长发育中正常的生理性死亡现象,正常大鼠睾丸中也存在着自发的生精细胞凋亡现象。Kun等[13]研究显示促凋亡蛋白Bax和抗凋亡蛋白Bcl-2通过线粒体途径在调控生精细胞凋亡中发挥重要作用,二者比例失调可以激活下游caspase信号通路。细胞凋亡的显著特点之一就是DNA碎片化,本研究采用TUNEL检测睾丸组织生精细胞DNA损伤,结果显示高脂饮食大鼠生精细胞凋亡指数较对照组明显增高,可能通过线粒体通路导致的生精细胞凋亡从而造成男性不育。
肥胖患者常伴随ROS的增加[14],氧化应激水平升高与多种因素相关,其中线粒体功能改变起决定作用。在能量摄入过多的情况下导致机体高血糖水平使线粒体呼吸链活性增强,ROS增多。在正常生理条件下,氧化应激处于动态平衡,当机体受到损伤时,其活性氧(ROS)就会增加,从而造成精子损伤[15]。精子膜富含多聚不饱和脂肪酸且抗氧化酶水平相对较低,容易受到活性氧的攻击影响精子膜结构。另外过多的ROS也会攻击精子线粒体DNA,使精子线粒体功能受损,从而导致精子运动能力的下降。本研究中高脂饮食的大鼠睾丸组织匀浆中SOD降低而MDA升高,说明肥胖组大鼠氧化应激水平提高。这可能是本实验中肥胖组精子活力和前向运动精子百分比明显下降的原因。此外,肥胖组大鼠的睾酮水平低下,而睾酮作为精子发生成熟的关键因素,也可能导致精子活力下降。另外也有研究显示,高血脂水平可使附睾发生退行性的改[16],高胰岛素血症和瘦素水平升高会引起精子线粒体功能受损,从而使精子活力下降[17-20]。由此可见,本研究中肥胖组大鼠精子活力下降与前述的代谢紊乱亦密切相关。
综上所述,本研究中高脂饮食诱导的肥胖大鼠出现代谢紊乱,下丘脑-垂体-睾丸性腺轴受到抑制,加之氧化损伤的增加导致生精细胞凋亡和精子活力下降。
致谢特别感谢中国中医科学院西苑医院葛争艳教授在构建肥胖大鼠模型中的悉心指导。
【参考文献】
[1] 王增武,郝光,王馨,等. 我国中年人群超重/肥胖现况及心血管病危险因素聚集分析[J]. 中华高血压杂志,2014,35:354-358.
[2] Coviello AD,Legro RS,Dunaif A. Adolescent girls with polycystic ovary syndrome have an increased risk of the metabolic syndrome associated with increasing androgen levels independent of obesity and insulin resistance [J]. J Clin Endocrinol Metab,2006,91: 492-497.
[3] Landry D,Cloutier F,Martin LJ. Implications of leptin in neuroendocrine regulation of male reproduction[J]. Reprod Biol,2013,13: 1-14.
[4] Cabler S,Agarwal A,Flint M,et al. Obesity: modern man’s fertility nemesis[J]. Asian J Androl,2010,12: 480-489.
[5] Bakos HW,Mitchell M,Setchell BP,et al. The effect of paternal die-tinduced obesity on sperm function and fertilization in a mouse model[J].Int J Androl,2011,34: 402-410.
[6] McPherson NO,Lane M. Male obesity and subfertility,is it really about increased adiposity[J]. Asian J Androl,2015,17: 450-458.
[7] Chang S,Graham B,Yakubu F,et al. Metabolic differences between obesity-prone and obesity-resistant rats[J]. Am J Physiol,1990,259: R1103-1110.
[8] Sermondade N,Faure C,Fezeu L,et al. BMI in relation to sperm count: an updated systematic review and collaborative meta-analysis[J]. Hum Reprod Update,2013,19: 221-231.
[9] Sermondade N,Faure C,Fezeu L,et al. Obesity and increased risk for oligozoospermia and azoospermia[J]. Arch Intern Med,2012,172: 440-442.
[10] Myers MG,Cowley MA,Münzberg H. Mechanisms of leptin action and leptin resistance[J]. Annu Rev Physio,2008,70: 537-556.
[11] 贾艳飞,郭颖,杨镒魟,等. 肥胖对男性生殖功能影响的研究进展[J].生殖医学杂志,2016,25: 89-93.
[12] 贾艳飞,郭颖,张蔚,等. 生物信息学方法研究高脂饮食诱导肥胖对雄性SD大鼠的影响[J].生殖医学杂志,2017,26: 822-828.
[13] Kun Z,Haiyun Z,Meng W,et al. Dietary omega-3 polyunsaturated fatty acids can inhibit expression of granzyme B,perforin,and cation-independent mannose6-phosphate/insulin-like growth factor receptor in rat model of small bowel transplant chronic rejection[J]. JPEN J Parenter Enteral Nutr,2008,32:12-17.
[14] Meigs JB,Larson MG,Fox CS,et al. Association of oxidative stress,insulin resistance,and diabetes risk phenotypes: the Framingham Offspring Study[J]. Diabetes Care,2007,30: 2529-2535.
[15] 郭颖,辛玲,于和鸣. 精子氧化损伤与抗氧化剂的研究[J]. 国际生殖健康/计划生育杂志,2012,31: 475-478.
[16] Saez F,Ouvrier A,Drevet JR. Epididymis cholesterol homeostasis and sperm fertilizing ability[J]. Asian J Androl,2011,13: 11-17.
[17] Hanafy S,Halawa FA,Mostafa T,et al. Serum leptin correlates in infertile oligozoospermic males[J]. Andrologia,2007,39: 177-180.
[18] Jahan S,Bibi R,Ahmed S,et al. Leptin levels in infertile males[J]. J Coll Physicians Surg Pak,2011,21: 393-397.
[19] Lampiao F,du Pleissis SS. Insulin and leptin enhance human sperm motility,acrosome reaction and nitric oxide production[J]. Asian J Androl,2008,10: 799-807.
[20] Ando S,Aquila S. Arguments raised by the recent discovery that insulin and leptin are expressed in and secreted by human ejaculated spermatozoa[J]. Mol Cell Endocrinol,2005,245: 1-6.

