月经发生中低氧诱导因子-1A对VEGF的调节
郭士格,南楠,尹德东,周芳,王树芳,刘建兵,贺斌,王介东,徐祥波,陈西华*
(1.北京协和医学院研究生院,北京 100730;2.国家卫生计生委科学技术研究所,北京 100081;3.新乡医学院,新乡 453003;4.山西医科大学,太原 030001)
月经是女性重要的生理现象,子宫内膜异常出血严重影响女性的生活质量,每年寻求治疗的妇女数量庞大[1]。但是有关人类月经生理和病理的许多问题仍没有得到解答。
Markee[2]将兔的子宫内膜移植于雌性猕猴眼前房内,观察到蜕膜化的子宫内膜在孕酮撤退后,螺旋动脉强烈收缩,推测螺旋动脉收缩引起的组织低氧是造成子宫内膜崩解的关键因素。低氧诱导因子HIF1A是应答低氧的首要转录因子[3]。在低氧条件下,HIF1A的降解受到阻断,HIF1A转运到细胞核与HIF1B形成异源二聚体[4],结合于DNA中的低氧反应元件并调控下游基因表达。本研究采用的HIF1A抑制剂甲氧雌二醇(Methoxyestradiol,2ME)具有解聚微管蛋白的作用,从而抑制HIF1A进入细胞核[5]。
血管内皮生长因子(VEGF)是一个编码HIF1A转录活性的关键应答基因[6]。VEGF的所有亚型及其受体均在子宫内膜中表达[7]。VEGF在女性增殖期中期表达上调并且促进血管增生[8-10]。
有研究分别利用人子宫内膜组织块、人内膜基质原代细胞进行体外培养,探讨了孕酮撤退和低氧对VEGFmRNA的调节作用[11-12]。但是在活体内,孕酮撤退后HIF1A是否直接与VEGF基因的上游启动子结合并调节其表达,并未明确阐述。本科室前期研究表明[13],小鼠月经样模型崩解期,孕酮撤退后Vegf与Hif1amRNA的表达变化趋势随着时间的推移变化基本一致;HIF1A蛋白进入细胞核,转录活性被激活,且其达峰时间点与VegfmRNA达峰时间点一致。本研究进一步以小鼠月经样模型为基础,研究HIF1A对VEGF的调控作用与调控关系,并在小鼠月经样模型中证明HIF1A能够直接调控VEGF的表达,并在体外培养模拟月经发生的人蜕膜化子宫内膜基质细胞中得到验证。
材料和方法
一、实验动物及细胞材料来源
实验动物:8~10周龄C57BL6雌鼠(SPFⅡ),根据国家卫计委科学技术研究所动物伦理委员会许可批准进行实验。小鼠在可控的条件下给予充足的水和食物,光照8:00~20:00,温度(20±1)℃。
取术前三个月未用任何激素药物给予子宫切除手术的子宫肌瘤患者增殖中、晚期或分泌早期子宫内膜用于人子宫内膜基质细胞分离培养。
二、研究方法
1.小鼠月经样模型的建立及HIF1A抑制剂干预实验:据前期研究建立小鼠生理性孕酮撤退月经样模型[14]。蜕膜化2 d后移去孕酮皮下埋植管时记为0 h。抑制剂组分别在孕酮撤退前4 h、撤退后4 h与12 h共3个时间点以腹腔注射的方式给予HIF1A抑制剂2ME 100 mg/kg(Selleck,美国);对照组处理为同样时间给予等量2ME的溶媒溶液。在孕酮撤退后24 h取材,-80°C保存。
2. 染色质免疫共沉淀(ChIP):据ChIP试剂盒(Cell Signaling,美国)操作说明书,取小鼠月经样模型孕酮撤退后0 h、8 h、12 h、16 h和24 h的-80°C冻存小鼠子宫,加入PBS+蛋白酶抑制剂Cocktail(PIC)溶液并剪碎;加入37%甲醛450 μl,室温摇床孵育20 min进行蛋白质-DNA交联反应。随后加入Glycine终止反应;样品达到单细胞状态,依次加入Buffer A/B,加入10~15 μl Micrococcal Nuclease,使样品DNA被分解成150~900 bp的片段,加入100~150 μl 0.5 mol/L EDTA,终止反应;破碎细胞,收集上清完成交联染色体制备;用ChIP Buffer将样品稀释至100 μg/ml;分别加入沉降抗体:HIF1A 1 μl(1:500)(Novus,美国)、H3阳性对照组蛋白H3抗体10 μl、阴性对照正常兔IgG抗体1 μl,4°C摇床孵育过夜;各样品加入30 μl ChIP沉降珠,4°C摇床孵育2 h;离心后保留沉淀,随后沉降珠洗脱,样品纯化,最后利用实时荧光定量PCR检测目标序列的相对含量。
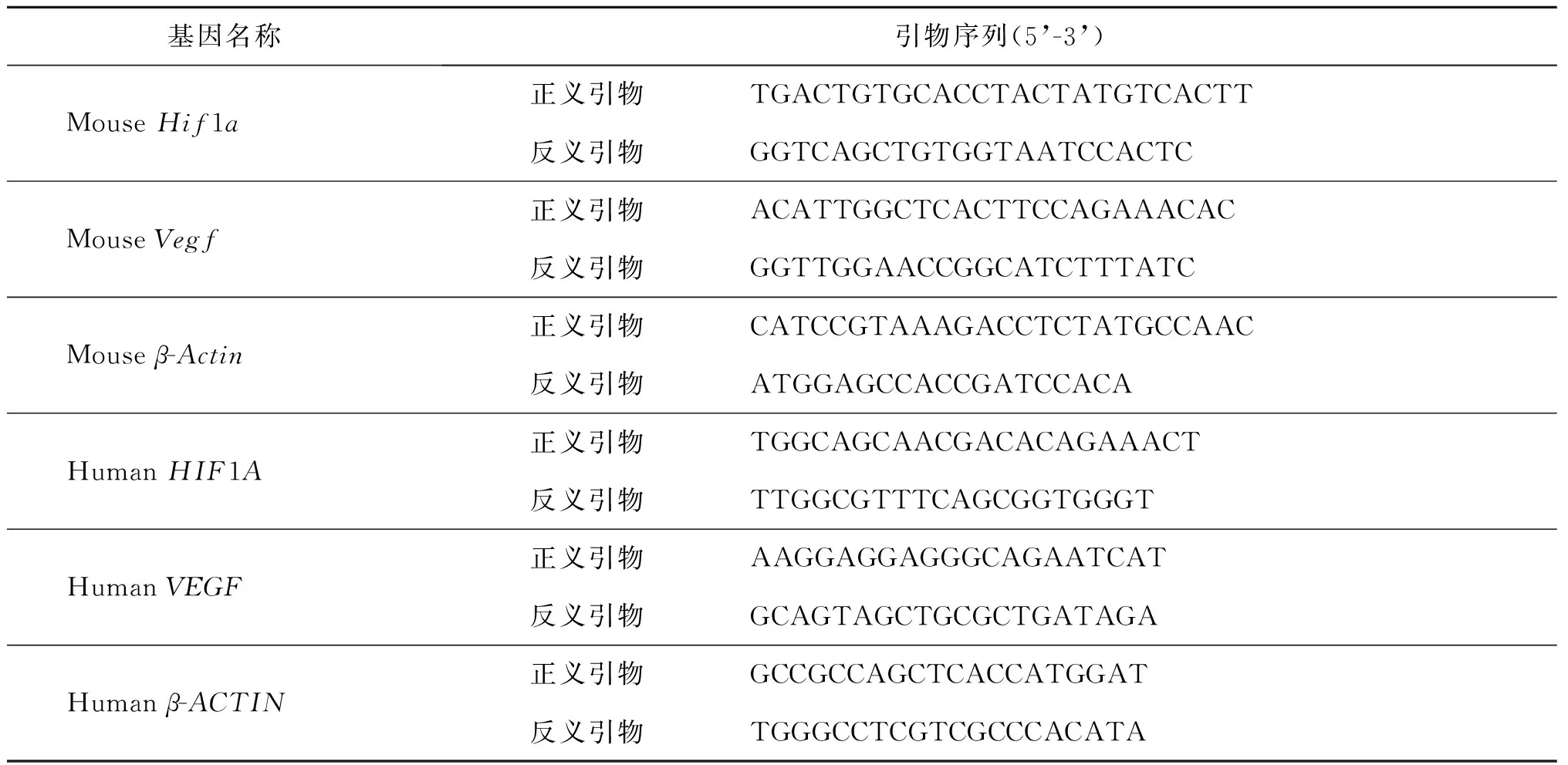
表1 引物序列
3.Western blot检测:-80℃保存的小鼠子宫组织分别提取核蛋白与胞质蛋白,加入适量蛋白酶抑制剂;将40~50 μg蛋白质进行10%SDS-PAGE胶电泳,转移至PVDF膜后,分别进行VEGF(Santa Cruz,美国)、HIF1A(Novus,美国)、β-ACTIN(北京康为世纪生物)、LAMIN-B抗体(Santa Cruz,美国)杂交,用ECL发光试剂盒(北京全式金生物)检测。
4.人蜕膜化子宫内膜基质细胞体外模拟月经发生:主要试剂为DMEM/F12(Gibco,美国)、雌二醇(E2)(Alfa Aesar,美国)、甲羟孕酮(MPA)(Sigma,美国)、Charcoal stripped FBS(Invitrogen,美国)。据前期研究报道建立人子宫内膜基质细胞蜕膜化模型[15],原代培养2 d后,换成维持培养基(无酚红DMEM/F12+抗生素+MPA 10-7mol/L、E210-8mol/L)培养12~24 h;更换无激素培养基模拟月经发生(DMEM/F12无酚红+10% Charcoal-stripped FBS+抗生素),记为0 h;在处理后0 h、12 h、24 h和36 h收集细胞。
5. 实时荧光定量PCR:将-80℃保存的样本,TRIzol法提取总RNA。将总RNA与Random primer及Oligo(dT)混合,70℃孵育10 min,迅速于冰上冷却2~3 min,配制逆转录体系,30℃孵育10 min,42℃孵育60 min,70℃孵育15 min,最后冰上冷却,获得cDNA文库;用实时荧光定量PCR检测VEGF和HIF1AmRNA的表达量。所用主要试剂Real-Time PCR kit(SYBR宝生物工程),引物序列见表1。
6.人蜕膜化内膜基质细胞HIF1A敲降实验:敲降组采用激素维持培养基(无酚红DMEM/F12+2%Charcoal stripped FBS+MPA10-7mol/L、E210-8mol/L)+Hif1a敲降;相应的阴性对照组中转染无义序列。无抗生素无血清激素维持培养基(无酚红DMEM/F12+MPA10-7mol/L、E210-8mol/L),37°C培养24 h。转染试剂为LipofectamineTM2000(Thermo Fisher,美国),具体步骤参照产品说明书。转染特异性HIF1A的siRNA序列(Gene Pharma,上海)24 h后完成敲降过程,将培养基更换成无激素培养基模拟月经发生(无酚红DMEM/F12+2%Charcoal stripped FBS),记为0 h。分别在0、12、24、36 h共4个时间点收集细胞,Real-time PCR方法检测VEGFmRNA表达量。
四、统计学方法
结 果
一、HIF1A与Vegf基因在小鼠月经样模型孕酮撤退后的结合
孕酮撤退后,ChIP实验结果显示HIF1A结合Vegfpromoter的相对含量在0 h较低,随后逐渐上升,在12 h达到峰值(P<0.01),在16 h迅速降低,24 h随后略上升,但显著低于12 h峰值(P<0.01)(图1)。
二、小鼠月经样模型中HIF1A抑制剂对HIF1A-VEGF调控的影响
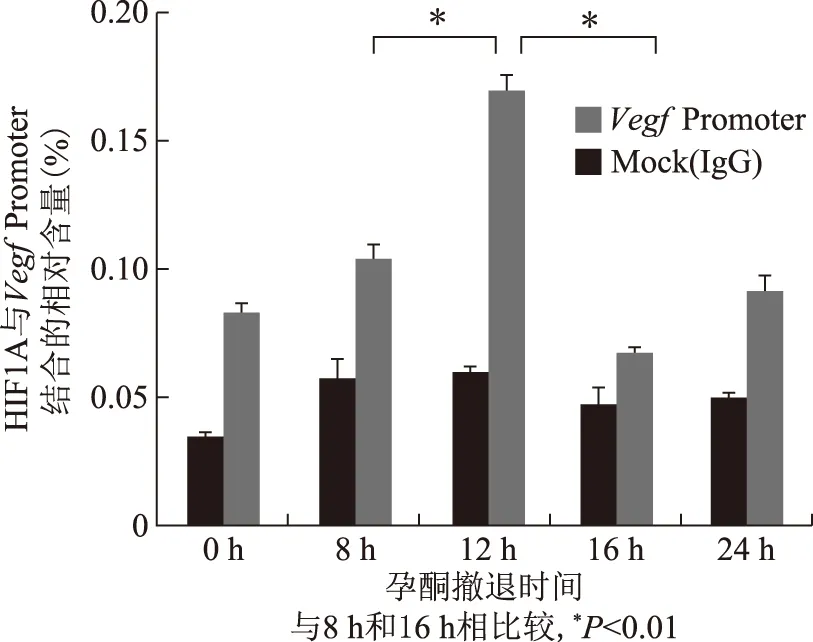
图1 小鼠月经样模型崩解期HIF1A结合Vegf promoter区域的相对含量
在小鼠月经样模型中给予2ME抑制HIF1A功能,于孕酮撤退后24 h检测HIF1A和VEGF蛋白的表达。HIF1A在子宫组织细胞质中的表达在抑制剂组较阴性对照组中高(P<0.01)(图2A),而胞核中,在抑制剂组中较对照组低(P<0.05)(图2B)。抑制剂组中VEGF在胞质的表达量较对照组低(P<0.01)(图2C)。

A:胞质中HIF1A蛋白Western blot结果与相对表达量;B:胞核中HIF1A蛋白Western blot结果及相对表达量;C:胞质中VEGF蛋白Western blot结果与相对表达量;相互比较,*P<0.01图2 小鼠月经样模型中HIF1A抑制剂(2ME)对子宫组织HIF1A-VEGF调控的影响
三、HIF1A 与VEGF mRNA在体外模拟月经发生(激素撤退)的人蜕膜化内膜基质细胞中的表达
HIF1A与VEGFmRNA均在0 h处于较低水平,12 h略上升;与12 h相比,HIF1AmRNA在24 h、36 h显著升高(P<0.01),约为12 h的表达量的3倍,VEGFmRNA的表达升高更为明显(P<0.01)(图3)。
四、采用siRNA敲降HIF1A对HIF1A-VEGF调控的影响
使用HIF1AmRNA特异性siRNA转入蜕膜化人ESC细胞后,HIF1AmRNA敲降效率在敲降后0 h为90%,在48 h敲降效率为88%(图4A)。阴性对照组,VEGFmRNA表达量在激素撤退后呈上升趋势,在0 h表达量最低,12 h略上升,在24 h和36 h表达量显著高于12 h(P<0.01),且36 h的表达量进一步显著升高(P<0.01);而HIF1A敲降组,VEGFmRNA的表达虽略有上升,但是上升的幅度与对照组相比显著降低(P<0.01),且VEGFmRNA的表达量在24 h和36 h仅约为阴性对照组的1/2(图4B)。

A:HIF1A mRNA的表达;B:VEGF mRNA的表达;相互比较,*P<0.01图3 孕酮撤退后HIF1A和VEGF mRNA在蜕膜化人子宫内膜基质细胞的表达

A:HIF1A敲降效率;B:阴性对照组与HIF1A敲降组中VEGF mRNA的相对表达量;相互比较,*P<0.01图4 HIF1A敲降对于孕酮撤退后蜕膜化人内膜基质细胞VEGF mRNA表达的影响
讨 论
本研究在小鼠月经样模型中探究HIF1A与VEGF的表达及其调控关系。结果显示,在孕酮撤退0-24 h,HIF1A结合的Vegfpromoter的相对含量变化趋势先升高后降低并在12 h达到峰值(P<0.05)。VegfmRNA在12 h出现的峰值与此时HIF1A与Vegfpromoter的结合关系紧密[13],提示孕酮撤退后HIF1A入核激活,并启动下游调控基因VegfmRNA的表达。2ME抑制HIF1A入核活化的同时,VEGF表达显著降低(P<0.05)。综上证明,小鼠月经样模型在孕酮撤退后HIF1A进入细胞核,其转录因子功能被激活,并启动下游调控基因VegfmRNA的表达。
我们进一步在体外培养的人蜕膜化内膜基质细胞中验证HIF1A对VEGF的直接调节关系。结果显示,HIF1A和VEGFmRNA均在0 h处于较低的水平,在12 h略上升,在24 h、36 h表达量显著升高(P<0.01)。也就是说孕酮撤退显著上调HIF1A和VEGFmRNA的表达量。体外培养的人蜕膜化内膜基质细胞在孕酮撤退后,VEGFmRNA在HIF1A敲降组的表达虽略有上升,但是上升的幅度与对照组相比显著降低(P<0.01)。综上证明,在小鼠月经样模型和体外培养的人蜕膜化内膜基质细胞中,孕酮撤退后HIF1A入核,其转录因子活性被激活,并启动下游调控基因VegfmRNA的表达。
低氧诱导因子HIF1A是应答低氧的主要转录因子[3]。2002年Zhang等[16]发现HIF1A仅在少数分泌晚期和月经期前的人子宫内膜中表达。2006年,Critchley等[17]发现HIF1A蛋白和HIF1AmRNA在分泌期功能层人子宫内膜,特别是月经期人子宫内膜组织中高表达。低氧条件下,HIF1A的降解被阻断,HIF1A积累并与HIF1B结合形成异源二聚体转运至细胞核内,与基因组中的低氧反应元件结合,调控下游靶基因的转录与表达。血管内皮生长因子VEGF是一个编码HIF1A转录活性的关键应答基因[6]。本科室前期研究表明,在小鼠月经样模型崩解期,孕酮撤退后VEGF与HIF1AmRNA的表达量时相变化相一致[13]。
本研究以小鼠月经样模型为基础,明确了在孕酮撤退后HIF1A转录因子功能被激活,并直接结合于Vegfpromoter区,启动下游调控基因VegfmRNA的表达。进一步利用人子宫内膜基质细胞体外培养模拟月经发生(激素撤退),验证了HIF1A对VEGF的直接调节关系。
子宫内膜异常出血是影响女性生殖健康的重要因素。阐明子宫内膜崩解出血生理机制,有助于促进异常出血机制的研究、治疗策略探寻及女性生殖健康水平的提升。
【参考文献】
[1] Maybin JA,Critchley HO. Menstrual physiology: implications for endometrial pathology and beyond[J]. Hum Reprod Update,2015,21:748-761.
[2] Markee JE. Menstruation in intraocular transplants in the rhesus monkey[J]. Contr Embryol Carnegie Instn,1940,177:211-308.
[3] Semenza GL,Wang GL. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J]. Mol Cell Biol,1992,12:5447-5454.
[4] Wang GL,Jiang BH,Rue EA,et al. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tention[J]. Proc Natl Acad Sci USA,1995,92:5510-5514.
[5] Martin C,Yu AY,Jiang BH,et al. Cardiac hypertrophy in chronically anemic fetal sheep: Increased vascularization is associated with increased myocardial expression of vascular endothelial growth factor and hypoxia-inducible factor 1[J]. Am J Obstet Gynecol,1998,178: 527-534.
[6] Thom R,Rowe GC,Jang C,et al. Hypoxic induction of vacular endothelial growth factor(VEGF) and angiogenesis in muscleby truncated peroxisome proliferator-activated receptor coactivator(PGC)-1α[J]. Biol Chem,2014,289:8810-8817.
[7] Smith SK. Angiogenesis,vascular endothelial growth factor and the endometrium[J]. Hum Reprod Update,1998,4: 509-519.
[8] Rogers PA,Lederman F,Taylor N. Endometrial microvascular growth in normal and dysfunctional states[J]. Hum Reprod Update,1998,4:503-508.
[9] Punyadeera C,Thijssen VL,Tchaikovski S,et al. Expression and regulation of vascular endothelial growth factor ligands and receptors during menstruation and post-menstrual repair of human endometrium[J]. Mol Hum Reprod,2006,12:367-375.
[10] Chennazhi KP,Nayak NR. Regulation of angiogenesis in the primate endometrium: vascular endothelial growth factor[J]. Semin Reprod Med,2009,27:80-89.
[11] Maybin J A,Hirani N,Brown P,et al. The regulation of vascular endothelial growth factor by hypoxia and prostaglandin F2α during human endometrial repair[J]. J Clin Endocrinol Metab,2011,96:2475-2483.
[12] Tsuzuki T,Okada H,Cho H,et al. Hypoxic stress simultaneously stimulates vascular endothelial growth factor via hypoxia-inducible factor-1alpha and inhibits stromal cell-derived factor-1 in human endometrial stromal cells[J]. Hum Reprod,2012,27:523-530.
[13] 庄太凤,陈西华,贺斌,等. HIF1A与VEGF在小鼠月经样模型的表达与共定位[J]. 生殖医学杂志,2017,26:808-813.
[14] 曹惠子,陈西华,贺斌,等.环氧合酶在小鼠子宫内膜崩解过程中的定位[J]. 基因组学与应用生物学,2015,34:304-307.
[15] 胡琳莉. 子宫内膜基质细胞分化过程中细胞周期界面的调控机制研究[D]. 武汉:华中科技大学同济医学院附属同济医院,2009:13-22.
[16] Zhang J,Salamonsen LA. Expression of hypoxia-inducible factors in human endometrium and suppression of matrix metalloproteinases under hypoxic conditions do not support a major role for hypoxia in regulating tissue breakdown at menstruation[J]. Hum Reprod,2002,17:265-274.
[17] Critchley HO,Osei J,Henderson TA,et al. Hypoxia-inducible factor-1alpha expression in human endometrium and its regulation by prostaglandin E-series prostanoid receptor 2(EP2)[J]. Endocrinology,2006,147:744-753.

