冻融胚胎囊胚培养中胚胎质量与囊胚形成之间关系
陈希曦,黎淑贞,吴海涛,黎平,郭江华,梁辉洪
(广东省江门市中心医院生殖中心,江门 529030)
相对于卵裂期胚胎移植,囊胚移植被认为是更符合生理的[1];胚胎从卵裂期至囊胚经历了细胞融合、囊胚腔形成、囊胚腔扩张和内细胞团孵出,基因调控由母型调节转换为胚胎型调节,具有了更高的发育潜能[2],研究已证实囊胚移植可以提高临床妊娠率及胚胎着床率,减低多胎率[3]。冻融胚胎行囊胚培养是囊胚培养的一种新的临床应用,选择性解冻卵裂期胚胎是该应用一个显著特点。本研究的目的在于探讨胚胎质量与囊胚形成之间的关系,选择性挑选卵裂期胚胎进行解冻,力求形成1~2个优质/可用囊胚进行移植。
资料和方法
一、研究对象
收集2013~2016年在江门市中心医院行冻融胚胎囊胚培养449名患者共478个周期的资料,进行回顾性分析。
纳入标准:其胚胎均以玻璃化快速冷冻方法进行冷冻。
二、治疗方法回顾
1.胚胎冻融技术:将D3卵裂期优于4B、5B、6C以上且有发育潜能的胚胎进行玻璃化快速冷冻方法,采用加藤冷冻及解冻试剂盒(Kitazato,日本),按其说明书进行操作。
2.子宫内膜准备:采用激素替代或自然周期进行子宫内膜的准备。激素替代于月经第3~5天开始口服戊酸雌二醇(补佳乐,拜耳,德国),根据监测内膜的生长情况调整给药的剂量及时间。当口服戊酸雌二醇天数≥14 d、内膜厚度≥8 mm,并测血孕酮(P)水平<3.18 nmol/L,即以肌注黄体酮(浙江仙琚制药)进行内膜的转化,此时为D0;自然周期以排卵日为D0。
3.囊胚培养及移植:于D2下午3~4时或D3上午9~10时解冻卵裂期胚胎,进行囊胚培养。采用Quinn’s Adavantage序贯培养液(SAGE,美国)或Vitrolife序贯培养液(Vitrolife,瑞典),按其说明书进行操作。于D5上午8~9时观察,若当天形成可用囊胚即移植,若未形成可用囊胚则D6上午8~9时再观察,若D6形成可用囊胚即移植。移植囊胚数1~2个。
4.移植后支持及妊娠判定:囊胚移植后继续激素替代至10 d,测尿HCG及血β-HCG确定是否妊娠。如妊娠,继续激素替代至妊娠8~9周开始逐渐减量,至孕11~12周停药;移植后30 d左右 B超检查,确定临床妊娠及妊娠胎数。
三、胚胎评价标准及观察指标
1.D3胚胎评价标准:(1)D3胚胎细胞数:胚胎的卵裂球数,分为<7细胞、7~9细胞、>9细胞;(2)D3胚胎细胞评级:依据胚胎的对称性、无核碎片的比例[4],将胚胎评级为A级(等大,碎片≤5%)、B级(不等大、无碎片或等大、碎片≤25%)、C级(等大或不等大、碎片≤50%)、D级(碎片>50%);(3)D3胚胎质量:以D3胚胎细胞数以及评级综合判定,以4A、8B等表示。优质胚胎为D3的7~9细胞B级以上的胚胎,非优质胚胎包括<7细胞、>9细胞以及7~9细胞的C+D级胚胎。解冻后胚胎进行重新上述标准评级。
2.解冻后胚胎存活状态:复苏胚胎超过一半细胞保持完整定义为存活胚胎。全存活:胚胎细胞均存活;半存活:胚胎细胞存在裂解(死亡),存活细胞≥1/2。
3.囊胚评价标准:采用Gardner人类囊胚分级系统[2],将 D5评分≥3BB、D6评分≥4BB定为优质囊胚,将D5评分>3CC、D6评分>4CC定为可用囊胚。囊胚形成率=囊胚形成数/囊胚培养胚胎数,可用囊胚形成率=可用囊胚形成数/囊胚培养胚胎数,优质囊胚形成率=优质囊胚形成数/囊胚培养胚胎数。
4.观察指标:比较不同D3胚胎质量的囊胚形成率、可用囊胚形成率、优质囊胚形成率,分析各观察指标与可用囊胚形成、优质囊胚形成的相关性。
四、统计学方法
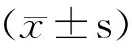
结 果
一、患者一般资料
共纳入449名患者的478个周期。年龄范围为21~45岁,平均(31.16±4.31)岁;不育年限为1~18年,平均(4.24±3.01)年;助孕指征:输卵管因素203例,宫腔内人工授精(IUI)失败53例,男方因素143例,排卵障碍6例,上次IVF受精失败/受精率低3例,双方因素41例。
二、囊胚培养结果
449名患者进行了478个解冻周期,共解冻培养2 097个胚胎,总囊胚形成率58.89%(1 235/2 097)、总可用囊胚形成率47.88 %(1 004/2 097)、总优质囊胚形成率18.69%(392/2 097)。
三、各因素与囊胚形成的关系
1.患者年龄:各年龄组之间的囊胚形成率、可用囊胚形成率、优质囊胚形成率无显著差异(P>0.05)(表1)。
2.解冻后胚胎存活状态:全存活组囊胚形成率、可用囊胚形成率、优质囊胚形成率显著高于半存活组(分别为59.71% vs.51.02%、48.97% vs.37.24 %、19.67% vs.9.18 %,P<0.05)(表2)。
3.D3胚胎质量:优质胚胎组囊胚形成率、可用囊胚形成率、优质囊胚形成率显著高于非优质胚胎组(分别为67.51% vs.49.95%、53.56% vs.41.98%、22.10% vs.15.16%,P<0.05)(表3)。
4.D3胚胎细胞数:<7细胞组囊胚形成率、可用囊胚形成率、优质囊胚形成率显著低于7~9细胞组及>9细胞组(P<0.05)(表4)。
5.D3胚胎细胞评级:A+B组优质囊胚形成率显著高于C+D组(19.82% vs.14.83%,P<0.05)(表5)。
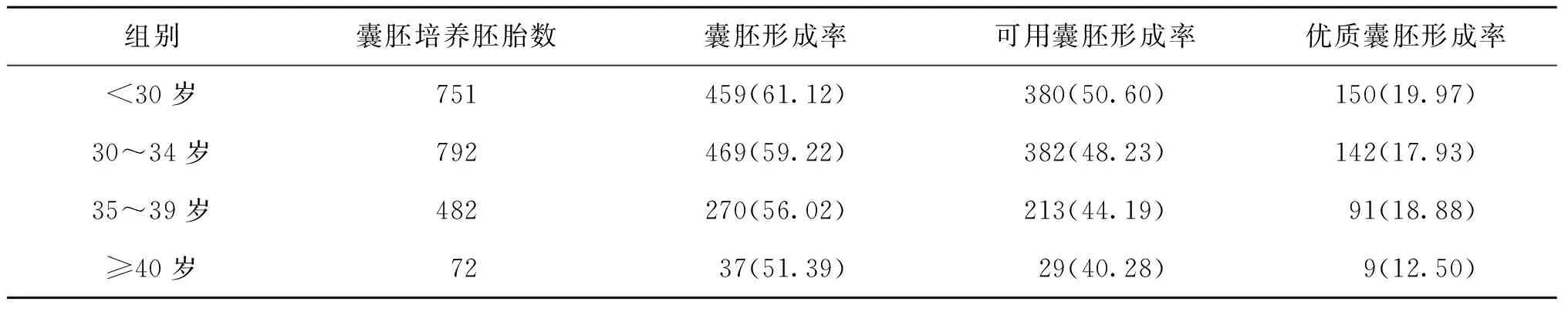
表1 患者年龄与囊胚形成率[n(%)]

表2 解冻胚胎存活状态与囊胚形成率[n(%)]
注:与全存活组比较,*P<0.05

表3 D3胚胎质量与囊胚形成率[n(%)]
注:与优质胚胎组比较,*P<0.05

表4 D3胚胎细胞数与囊胚形成率[n(%)]
注:与<7细胞组比较,*P<0.05

表5 D3胚胎细胞评级与囊胚形成率[n(%)]
注:与A+B组比较,*P<0.05
四、Logistic分析
将上述因素分析中的差异因素,即患者年龄、胚胎解冻存活状态、D3胚胎质量、D3胚胎细胞数、D3胚胎细胞评级做Logistic分析,用Forward LR方法,结果提示患者年龄、胚胎解冻存活状态、D3胚胎细胞数与可用囊胚形成显著相关(P<0.05),患者年龄、胚胎解冻存活状态、D3胚胎细胞数、D3胚胎细胞评级与优质囊胚形成显著有关(P<0.05)(表6、7)。
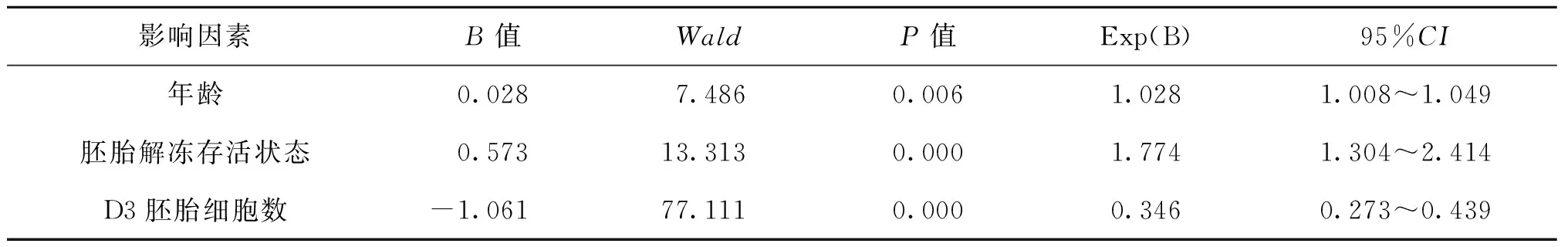
表6 可用囊胚形成多因素Logistic回归分析
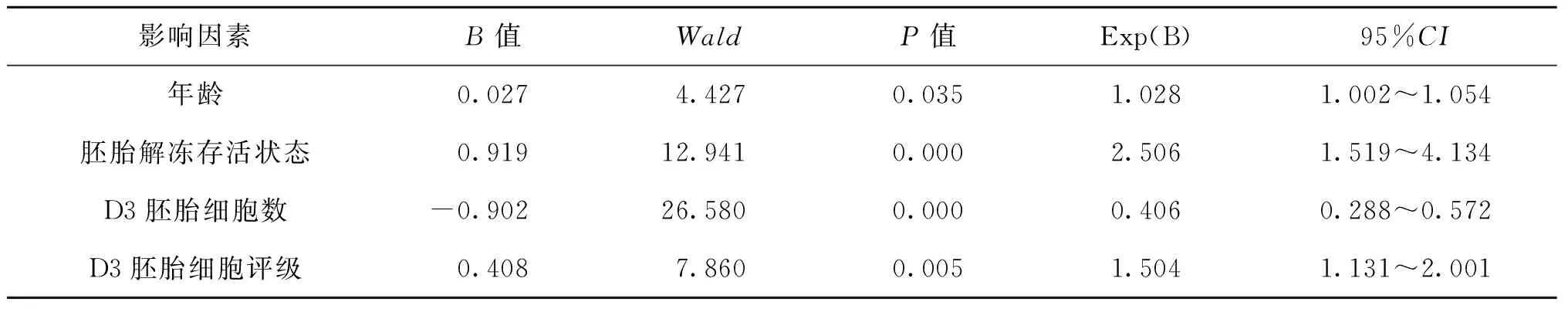
表7 优质囊胚形成多因素Logistic回归分析
讨 论
胚胎培养能够挑选出高质量胚胎[1],囊胚是胚胎体外培养的终末阶段,因此囊胚培养不仅有利于挑选具备发育潜能的胚胎,淘汰发育潜能差及染色体异常的胚胎,提高移植周期的临床妊娠率和活产率[5-6],同时还可明显降低多胎妊娠的发生率。有研究表明囊胚质量与临床结局显著相关[7],但质量差的囊胚也有妊娠机会且一旦妊娠并不会增加不良产科和围产期结局[8]。因此,对D3卵裂期胚胎进行选择性解冻后囊胚培养,最终形成1~2个优质或可用囊胚进行移植为最佳,多于2个可能面临胚胎二次冷冻、无囊胚形成等而给患者带来心理的负面影响。在本研究中的质量评估纳入胚胎解冻后存活状态、D3胚胎细胞数、D3胚胎细胞评级以及D3胚胎质量,分析D3卵裂期胚胎已有质量指数与囊胚形成之间关系,为临床选择性解冻胚胎提供依据。
年龄是影响囊胚形成的因素之一[9]。本研究中单因素分析结果显示随着年龄增长各囊胚形成率均有所下降,然均无统计学差异;但Logistic分析结果显示可用囊胚率、优质囊胚率与患者年龄均显著有关,但二者的Exp(B)、95%CI均在1附近,B值分别为0.028、0.027。因此,我们认为年龄对冻融胚胎囊胚形成有一定影响,但其影响力不如其他影响因素;其次可能是由于纳入≥40岁患者的胚胎数较少造成了偏倚。
研究发现胚胎的冷冻过程本身可引起重要的细胞内改变[10],冷冻胚胎解冻后卵裂球的存活程度反映了胚胎内在质量,能更好地承受冷冻过程的胚胎有着更好的发育潜能。本研究结果也证实这一点,Logistic分析结果显示胚胎解冻后存活状态是各种影响因素中对可用囊胚形成率、优质囊胚形成率影响最大者。
对于卵裂期胚胎质量的评估,目前应用最广泛的评分方法依然是胚胎形态学评分系统[11],依据胚胎发育的速度、卵裂球数目、细胞质的均匀性及碎片进行评分分级,因此胚胎质量是对胚胎细胞数与细胞评级的综合评估。Logistic分析结果胚胎质量与可用囊胚、优质囊胚无显著相关。我们认为其原因在于:<7细胞胚胎较≥7细胞胚胎的各囊胚形成率低,而7~9细胞与>9细胞胚胎之间囊胚形成率相当;而细胞评级的区别仅仅导致优质囊胚形成率差异;胚胎质量在细胞数与细胞评级二者此长彼消中削弱其对可用囊胚、优质囊胚形成的影响力;此外,已许多研究表明单从D3胚胎的形态来预测胚胎发育潜能是不够精确[1,12-13],Graham等[13]研究显示,对符合胚胎选择标准的D3胚胎与不符合使用标准的剩余胚胎进行囊胚培养后发现,二者间的囊胚率并无统计学差异(P>0.05)。冻融胚胎囊胚培养是以传统评分系统对D3胚胎进行评估后将符合选择标准的胚胎进行冷冻保存后再解冻后囊胚培养,因此本研究对象是符合选择标准的胚胎,而这些胚胎再行囊胚培养时依然呈现出不同的囊胚形成率。本研究目的在于通过已知的胚胎质量参数去预测囊胚形成的可能性,提高此囊胚培养策略的有效性。这也揭示了该种策略的不足:可能丢弃那些本可以形成囊胚甚至优质囊胚的不符合选择标准的胚胎。因此,我们认为冻融胚胎囊胚培养应用于那些已有冷冻胚胎同时存在多胎高危因素或多次移植失败的患者。
人类胚胎正常的发育速度是:受精后第1天为2细胞期,第2天为 4~6 细胞期,第 3 天为7~9 细胞期[14]。因此在D3时,<7细胞胚胎发育较慢,>9细胞胚胎则发育较快。Lundin 等[15]研究显示发育较快的胚胎可能有更高的妊娠率;有学者认为胚胎发育速度过快说明非整倍体等遗传缺陷比例较高,会削弱胚胎发育潜能[16];有研究显示,D3移植8细胞胚胎的临床妊娠率高于非8细胞胎[17-18],亦有学者认为D3移植8细胞胚胎时妊娠率的提高可能与子宫内膜和胚胎发育的同步化有关[19-20]。由于每个胚胎观察时间点存在差异,细胞分裂是一个连续动态过程,从而胚胎细胞数是很容易变化的,仅能粗略地反映胚胎发育速度。在本研究中7~9细胞、>9细胞D3胚胎的囊胚形成率显著高于<7细胞胚胎;因此在Logistic分析中将细胞数分为<7细胞与≥7细胞两组,结果提示随着D3胚胎细胞数增加有助于可用囊胚、优质囊胚形成。
综上所述,在冻融胚胎囊胚培养中,患者年龄、胚胎解冻存活状态、D3胚胎细胞与可用囊胚形成有关,患者年龄、胚胎解冻存活状态、D3胚胎细胞、D3胚胎细胞评级与优质囊胚形成有关,其中胚胎解冻后存活状态对可用/优质囊胚形成预测价值最大。
【参考文献】
[1] Herbemont C,Sarandi S,Boujenah J,et al. Shoule we consider day-2 and day-3 embryo morphology before day-5 transfer when blastocysts reach a similar good quality?[J/OL]. Reprod Biomed Online,2017,35:521-528.
[2] Raju GA,Prakash GJ,Krishna KM,et al. Vitrification of human early cavitating and deflated expanded blastocysts: clinical outcome of 474 cycles[J]. J Assist Reprod Genet,2009,26:523-529.
[3] Glujovsky D,Farquhar C,Quinteiro Retamar AM,et al. Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology [DB/OL]. Cochrane Database Syst Rev,2016,(6):CD002118.
[4] El-Toukhy T,Coomarasamy A,Khairy M,et al. The relationship between endometrial thickness and outcome of medicated frozen embryo replacement cycles[J]. Fertil Steril,2008,89:832-839.
[5] Blake DA,Farquhar CM,Johnson N,et al. Cleavage stage versus blastocyst stage embryo transfer in assisted conception [DB/OL]. Cochrane Database Syst Rev,2007,(17):CD002118.
[6] Guerif F,Lemseffer M,Bidault R,et al. Single day 2 embryo versus blastocyst-stage transfer: a prospective study integrating fresh and frozen embryo transfer [J]. Hum Reprod,2009,24: 1051-1058.
[7] 倪晓蓓,王珊珊,张宁媛,等.单囊胚冷冻复苏周期中囊胚时期及质量与临床结局相关分析[J].生殖医学杂志,2016,25:926-931.
[8] 柳亚南,薛侠,张四林,等.囊胚形态对冻融单囊胚移植临床结局的影响[J].生殖医学杂志,2016,25:1002-1005.
[9] Thum MY,Wells V,Abdalla H. Patient selection criteria for blastocyst culture in IVF/ICSI treatment [J]. J Assist Reprod Genet,2010,27: 555-560.
[10] Dhali A,Anchamparuthy VM,Butler SP,et al. Gene expression and development of mouse zygotes following droplet vitrification[J]. Theriogenology,2007,68:1292-1298.
[11] 章师平,周平. 从卵子形态及胚胎质量选择移植胚胎的研究进展[J]. 中华临床医师杂志(电子版),2012,6:7370-7372.
[12] Guerif F,Le Gouge A,Giraudeau B,et al. Limited value of morphological assessment at days 1 and 2 to predict blastocyst development potential: a prospective study based on 4042 embryos[J]. Hum Reprod,2007,22: 1973-1981.
[13] Graham J,Han T,Porter R,et al. Day 3 morphology is a poor predictor of blastocyst quality in extended culture[J]. Fertil Steril,2000,74: 495-497.
[14] 李楠,黎靖宇,唐永梅,等. 早期胚胎质量评估:提高预测胚胎发育潜能的敏感性和特异性[J]. 中国组织工程研究,2014,18: 6849-6855.
[15] Lundin K,Bergh C,Hardarson T. Early embryo cleavage is a strong indicator of embryo quality in human IVF[J]. Hum Reprod,2001,16: 2652-2657.
[16] Hardarson T,Hanson C,Sjogren A,et al. Human embryos with unevenly sized blastomeres have lower pregnancy and implantation rates: indications for aneuploidy and multinucleation [J]. Hum Reprod,2001,16: 313-318.
[17] Scott L. Pronuclear scoring as a predictor of embryo development [J/OL]. Reprod Biomed Online,2003,6: 201-214.
[18] Borini A,Lagalla C,Cattoli M,et al. Predictive factors for embryo implantation potential [J/OL]. Reprod Biomed Online,2005,10:653-668.
[19] 朱依敏,黄荷凤,周馥贞,等. 影响冻融胚胎移植成功的因素分析[J]. 中华妇产科杂志,2001,36:33-35.
[20] 马龙,钱晓乔,蔡令波,等. 全胚冷冻再行解冻胚胎移植周期的临床结局分析[J].生殖与避孕,2012,32:237-240.

