HIV-1感染者CD73+CD8+ T细胞减少与T细胞异常活化的相关性研究
常文仙,张和倩,周双男,黄辉煌,涂 波,周春保,张纪元,王福生
AIDS是由HIV-1感染引起的免疫缺陷性疾病,其免疫学特征有CD4+T细胞进行性减少,持续性免疫激活和系统性炎症[1-2]。随着高效抗反转录病毒治疗(highly active anti-retroviral therapy,HAART)的应用,HIV-1/AIDS患者免疫功能逐渐恢复,生活质量得以改善,AIDS相关性死亡明显减少[3]。但HIV-1感染者还是具有较高的发病率和病死率,每年仍有很多患者死于心血管病或肿瘤等非AIDS相关事件[4-5]。研究证实,HIV-1感染中,持续的免疫激活不仅与疾病进展密切相关,而且与患者早期免疫衰老和发病率增加有关[6-7]。因此,人们猜测HIV-1感染者发生非AIDS相关事件和死亡的风险增加也是由于持续的免疫激活所致[8]。
CD73是一种胞外核苷酸酶,表达于多种免疫细胞表面,其与另一种核苷酸酶CD39协同作用将ATP转化为腺苷,腺苷与相应受体结合发挥免疫学效应,在多种疾病的发生、发展中扮演重要角色[9-10]。炎症或应激条件下,ATP从受损细胞内释放,与其受体结合激活免疫细胞从而促进炎性反应。CD39和CD73将ATP逐步水解生成腺苷,一方面降低了ATP引起的炎性反应,另一方面生成的腺苷本身就是免疫抑制性物质[11]。腺苷不仅能抑制淋巴细胞的活化和增殖,还可以调节抗原提呈细胞的作用,抑制其细胞因子的释放,从多方面降低免疫反应,避免过度的免疫活化[12-13]。因此,CD39/CD73/腺苷途径作为“免疫开关”,将ATP驱动的促炎反应转变为由腺苷介导的抗炎状态[14],其在HIV-1感染相关的免疫活化中发挥的作用逐渐受到重视。
研究报道,HIV-1感染者调节性T细胞(regulatory T cells,Tregs)上CD39表达上调,并协同Tregs抑制免疫反应,有助于控制免疫活化[15-16]。同时Moreno-Fernandez等[17]研究发现,HIV-1感染早期,CD39+Tregs可通过CD39依赖机制抑制T细胞内HIV-1的复制,对机体起到保护作用。此外,Nikolova等[16]报道CD39的变异体在非洲人群和亚洲人群中表达水平不同,而且具有延缓AIDS进展的作用。CD73是CD39/CD73/腺苷途径的限速酶,研究发现HIV-1感染者外周血中CD4+和CD8+T细胞上CD73的表达均明显减少,且与AIDS进展相关[18-20]。但对于不同地区的HIV-1感染群体,其T细胞上CD73的变化特点及其与疾病进展的关系还不清楚。CD38是活化性分子,检测CD38+CD8+T细胞的频率可以反映HIV-1感染者T细胞的活化程度。因此,本研究针对我国HIV-1感染者外周血CD8+T细胞上CD73的表达情况展开研究,并分析其与AIDS疾病进展和T细胞活化的关系,进而探讨CD73/腺苷通路在中国AIDS人群疾病进展中的作用。
1 对象与方法
1.1 对象 本研究入选HIV-1感染者65例,所有病例均来自解放军第三〇二医院2016年4月—2017年2月期间的门诊患者,平均年龄为(34.2±9.6)岁,所有患者为未接受抗病毒治疗,诊断符合中华医学会感染病学分会艾滋病学组2015年修订的《艾滋病诊疗指南》[21]。排除标准:①年龄<18岁和>65岁者;②目前存在机会性感染者;③妊娠妇女或产褥期妇女;④有精神疾病或其他严重疾病者;⑤不愿意合作者。如表1所示,HIV-1感染者根据CD4+T细胞计数分为CD4+T细胞计数≥ 200个/μl组和< 200个/μl组。另外在病例收集期间纳入27例实验室同事作为健康对照(health control,HC),平均年龄为(32.7±6.8)岁。所有病例及健康对照均签署知情同意书。
1.2 试剂 本实验所用的主要荧光抗体包括鼠抗人CD8-PerCP、鼠抗人CD38-APC、鼠抗人CD3-FITC/CD45-PerCP/CD8-PE/CD4-APC抗体组合均购自美国BD Biosciences公司;鼠抗人CD3-BV510、鼠抗人CD73-BV421购自美国Biolegend公司,同时购买对应的同型对照抗体。
1.3 方法
1.3.1 CD4+T细胞计数 取HIV-1感染者新鲜采集的EDTA抗凝血50 μl至Trucount管内,加入CD3/CD45/CD8/CD4抗体组合共20 μl,震荡混匀,室温避光孵育20 min,加入免洗溶血素450 μl,震荡混匀,室温避光孵育20 min后利用FACS Calibur型流式细胞仪检测,实验数据用MultiSET软件进行分析[22],得到CD3+、CD4+及CD8+T细胞计数。1.3.2 流式细胞仪检测CD8+T细胞上CD73和CD38的表达 取新鲜采集的EDTA抗凝血300 μl至5 ml流式管内,依次加入荧光标记抗体CD3-BV510 5 μl、CD8-PerCP 5 μl、CD73-BV421 5 μl、CD38-APC 20 μl;另设同型对照管,依次加入荧光抗体CD3-BV510、CD8-PerCP、IgG-APC各20 μl及 IgG-BV421 5 μl,震荡混匀,室温避光孵育20 min,加入3 ml溶血素,震荡后避光10 min,1600 rpm离心5 min,弃去上清,再用2 ml PBS洗涤2遍,离心后弃上清,加300 μl 1%多聚甲醛固定,放入4 ℃冰箱,24 h内使用FACS Verse型流式细胞仪检测[31],实验数据用Flowjo 7.6软件进行分析。
1.3.3 血浆HIV-1 RNA检测 取EDTA抗凝血6 ml,2000 rpm离心10 min,吸取血浆,放入-80 ℃冰箱冻存。待标本收集完全后,取400 μl血浆,利用HIV-1核酸定量检测试剂盒(QIAGEN), 在 CFX96TM Real-Time system型荧光定量PCR分析仪(BIO-RAD)上定量检测血浆中HIV-1 RNA。扩增的靶核酸位置是HIV gag区,可扩增HIV-1 M群的A-H亚型和N群基因型样本。实验设1个内部定量标准品,阴性质控,结果以每毫升血浆含病毒拷贝数表示[24]。
1.4 统计学处理 用SPSS 19.0软件进行统计学分析并用GraphPad Prism 5.0制图。正态分布的定量资料以±s表示,非正态分布的定量资料以中位数(最小值,最大值)表示。2组间比较采用Mann-Whitney U检验;相关性分析采用Spearman相关检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 HIV-1感染者外周血CD73+CD8+T细胞的频率变化 统计显示,HIV-1感染者外周血CD73+CD8+T细胞的频率明显低于HC组(U= 139.000,P= 0.001),见图1A。HIV-1感染者的组间比较显示,CD4+T细胞计数< 200个/μl组的外周血CD73+CD8+T细胞的频率显著低 于CD4+T细胞计数≥ 200个/μl组(U=206.500,P= 0.017),见图1B。
2.2 HIV-1感染者外周血CD73+CD8+T细胞绝对计数的变化 HIV-1感染者外周血CD73+CD8+T细胞绝对计数明显低于HC组(U=301.000,P=0.001),见图1C。CD4+T细胞计数< 200个 /μl组外周血CD73+CD8+T细胞绝对计数显著低于CD4+T 细胞计数≥ 200个 /μl组(U= 180.000,P=0.005),见图1D。
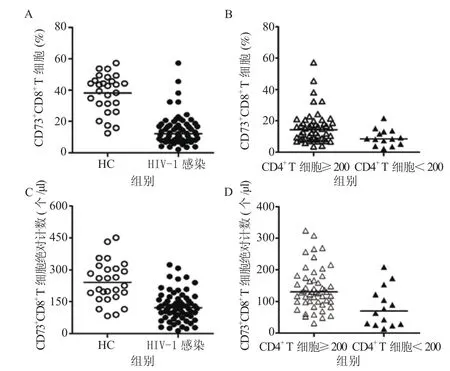
图1 HIV-1感染者CD73+CD8+ T细胞频率和绝对计数的变化Figure 1 Change of the frequency and absolute count of CD73+CD8+ T cells in HIV-1 infected patients
2.3 HIV-1感染者外周血CD73+CD8+T细胞绝对计数、频率与CD4+T细胞计数的相关性 HIV-1感染者外周血CD73+CD8+T细胞的绝对计数、频率均与其CD4+T细胞计数呈正相关(r=0.555,P=0.001;r=0.342,P=0.005),见图2 A和B。
2.4 HIV-1感染者外周血CD73+CD8+T细胞绝对计数与HIV-1载量的相关性 HIV-1感染者CD73+CD8+T细胞绝对计数与血浆HIV-1载量呈现弱负相关(r=-0.261,P=0.035),见图2C,但其频率与HIV-1载量之间没有相关性(r=-0.140,P=0.265),见图2D。
2.5 HIV-1感染者CD73+CD8+T细胞绝对计数、频率与CD38+CD8+T细胞频率的相关性 HIV-1感染者外周血CD73+CD8+T细胞的绝对计数和频率均与其CD38+CD8+T细胞频率呈负相关(r=-0.384,P=0.002;r=-0.387,P=0.001),图3A和B。
3 讨 论
持续的免疫活化和系统性炎症是HIV-1慢性感染期的重要特征,可加快HIV-1/AIDS患者免疫衰老和系统老化的过程,对患者的预后和生存带来诸多不利影响[25]。HIV-1感染中免疫过度活化的主要原因是循环中HIV-1的持续存在,病毒直接或间接作用于机体免疫系统,引起广泛性免疫活化[6]。但在部分HAART后血浆病毒载量低于检测下限的患者中仍能观察到持续的免疫激活反应,表明除了病毒本身的作用外,还有其他引起免疫激活的因素存在,如肠道菌群的移位,其他病毒如巨细胞病毒的再活化以及体内T细胞的平衡失调等[19]。
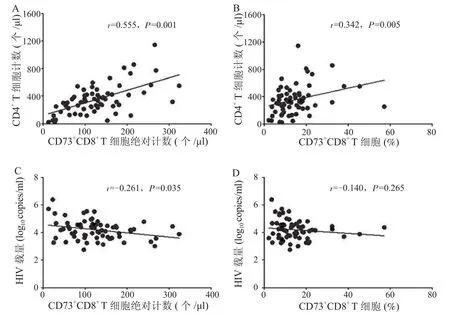
图2 HIV-1感染者CD73+CD8+ T细胞绝对计数、频率与CD4+ T细胞计数和HIV-1载量的相关性Figure 2 Correlation of absolute count and frequency of CD73+CD8+ T cells with CD4+ T cell count and HIV-1 viral load in HIV-1 infected patients
CD38是衡量T细胞活化水平的主要表面分子,有研究表明CD38+CD8+T细胞在HIV-1感染者体内显著增多,既反映了HIV-1/AIDS患者的免疫活化水平,也是疾病进展的独立预测因素[26]。本研究就HIV-1感染后CD73+CD8+T细胞与AIDS进展的关系及其在T细胞免疫应答和免疫活化方面的作用展开研究。本研究首先检测了CD73在HC及HIV-1感染者CD8+T细胞上的表达情况。结果显示,与HC组相比,HIV-1感染者外周血CD73+CD8+T细胞的频率和绝对计数均明显减少,且CD4+T细胞计数< 200个/μl的AIDS患者减少更为明显,相关性分析显示CD73+CD8+T细胞绝对计数与CD4+T细胞计数呈明显正相关。本研究结果与国外的报道一致[18-20],后又进一步证实HIV-1感染者体内CD73+CD8+T细胞减少并与AIDS疾病进展密切相关。CD38是T细胞活化的分子标志,本研究中HIV-1感染者外周血CD73+CD8+T细胞的频率及绝对计数均与其CD38+CD8+T细胞频率呈负相关,提示该群细胞在控制T细胞活化方面具有一定作用。
此外,关于CD73+CD8+T细胞对抗病毒免疫应答的影响,相关性分析发现,只有CD73+CD8+T细胞绝对计数与HIV-1感染者血浆中病毒载量呈弱负相关,且相关系数(r=0.261)较小,这可能与实验样本量不足或个体差异有关,但总体可见HIV-1感染者中CD73+CD8+T细胞的减少不利于病毒的清除。国外研究认为CD73+T细胞可通过生成腺苷抑制T细胞免疫反应[19],因此CD73+CD8+T细胞的减少应该有助于抗病毒免疫反应,但本研究的结果与之相反,提示CD73+CD8+T细胞在抗病毒免疫方面可能存在其他未知的机制,需要更深入的研究加以证实。
总之,本研究发现HIV-1感染者外周血CD73+CD8+T细胞的绝对计数和频率均明显减少,并与T细胞活化和AIDS进展密切相关。而关于CD73+CD8+T细胞减少的原因以及其影响病毒载量和T细胞活化的相关机制目前还不清楚,未来可以针对这几方面展开研究,从而阐明该群细胞在AIDS疾病进展中的作用机制。
【参考文献】
[1]Sharp PM,Hahn BH.Origins of HIV and the AIDS pandemic[J].Cold Spring Harb Perspect Med,2011,1(1):a6841.
[2]Becerra JC,Bildstein LS,Gach JS.Recent insights into the HIV/AIDS pandemic[J].Microb Cell,2016,3(9):451-475.
[3]Hileman CO,Funderburg NT.Inflammation,immune activation,and antiretroviral therapy in HIV[J].Curr HIV/AIDS Rep,2017,14(3):93-100.
[4]van Sighem A,Danner S,Ghani AC,et al.Mortality in patients with successful initial response to highly active antiretroviral therapy is still higher than in non-HIV-infected individuals [J].J Acquir Immune Defic Syndr,2005,40(2):212-218.
[5]Lohse N,Hansen AB,Pedersen G,et al.Survival of persons with and without HIV infection in Denmark,1995-2005[J].Ann Intern Med,2007,146(2):87-95.
[6]Appay V,Sauce D.Immune activation and inflammation in HIV-1 infection: causes and consequences [J].J Pathol,2008,214(2):231-241.
[7]Utay NS,Hunt PW.Role of immune activation in progression to AIDS[J].Curr Opin HIV AIDS,2016,11(2):131-137.
[8]Grund B,Neuhaus J,Phillips A.Relative risk of death in the SMART study [J].Lancet Infect Dis,2009,9(12):724-725.
[9]Liang D,Zuo A,Shao H,et al.Roles of the adenosine receptor and CD73 in the regulatory effect of gammadelta T cells[J].PLoS One,2014,9(9):e108932.
[10]Bono MR,Fernandez D,Flores-Santibanez F,et al.CD73 and CD39 ectonucleotidases in T cell differentiation: beyond immunosuppression[J].FEBS Lett,2015,589(22):3454-3460.
[11]Cekic C,Linden J.Purinergic regulation of the immune system[J].Nat Rev Immunol,2016,16(3):177-192.
[12]Linden J,Cekic C.Regulation of lymphocyte function by adenosine[J].Arterioscler Thromb Vasc Biol,2012,32(9):2097-2103.
[13]Kobie JJ,Shah PR,Yang L,et al.T regulatory and primed uncommitted CD4 T cells express CD73,which suppresses effector CD4 T cells by converting 5'-adenosine monophosphate to adenosine[J].J Immunol,2006,177(10):6780-6786.
[14]Antonioli L,Pacher P,Vizi ES,et al.CD39 and CD73 in immunity and inflammation[J].Trends Mol Med,2013,19(6):355-367.
[15]Schulze ZW J,Thomssen A,Hartjen P,et al.Comprehensive analysis of frequency and phenotype of T regulatory cells in HIV infection: CD39 expression of FoxP3+T regulatory cells correlates with progressive disease[J].J Virol,2011,85(3):1287-1297.
[16]Nikolova M,Carriere M,Jenabian MA,et al.CD39/adenosine pathway is involved in AIDS progression[J].PLoS Pathog,2011,7(7):e1002110.
[17]Moreno-Fernandez ME,Rueda CM,Rusie LK,et al.Regulatory T cells control HIV replication in activated T cells through a cAMP-dependent mechanism[J].Blood,2011,117(20):5372-5380.
[18]Toth I,Le AQ,Hartjen P,et al.Decreased frequency of CD73+CD8+T cells of HIV-infected patients correlates with immune activation and T cell exhaustion[J].J Leukoc Biol,2013,94(4):551-561.
[19]Schuler PJ,Macatangay BJ,Saze Z,et al.CD4(+)CD73(+) T cells are associated with lower T-cell activation and C reactive protein levels and are depleted in HIV-1 infection regardless of viral suppression [J].AIDS,2013,27(10):1545-1555.
[20]Carriere M,Lacabaratz C,Kok A,et al.HIV "elite controllers" are characterized by a high frequency of memory CD8+CD73+T cells involved in the antigen-specific CD8+T-cell response[J].J Infect Dis,2014,209(9):1321-1330.
[21]中华医学会感染病学分会艾滋病学组.艾滋病诊疗指南(第三版)[J].中华传染病杂志,2015,33(10):577-593.
[22]张钰,田云飞,肖江,等.有效的高效抗反转录病毒治疗后低CD4/CD8比值HIV/AIDS患者免疫学特征分析[J].传染病信息,2015,28(6):357-361.
[23]张昕,涂波,赵娟娟,等.3型天然淋巴细胞在HIV-1慢性感染中的免疫特征及其与疾病进展的关系研究[J].传染病信息,2016,29(3):144-147.
[24]严亚军,桂希恩,荣玉萍,等.HIV感染患者CD4+T淋巴细胞数与病毒载量分析[J].中华医院感染学杂志,2014,24(2):268-270.
[25]Appay V,Sauce D.Immune activation and inflammation in HIV-1 infection: causes and consequences[J].J Pathol,2008,214(2):231-241.
[26]李延卿,任伟宏,桑锋,等.HIV/AIDS患者免疫激活相关分子的表达及其对疾病进程的影响[J].免疫学杂志,2016,32(8):629-696.

