CXCR5+CD8+ T细胞在HIV感染中的免疫特征及其与疾病进展关系的研究
赵 爽,许 文,陈威巍,赵 敏
CXCR5+CD8+T细胞是一群被新定义的细胞群。不同于传统CD8+T细胞,这群细胞表达趋化因子受体CXCR5,通过CXCR5-CXCL13轴趋化其优先定植于B细胞滤泡中,构成了滤泡中的大部分CD8+T细胞,因而有研究将其定义为滤泡细胞毒性T细胞(follicular cytotoxic T cells,TFC)[1-4]。在慢性HIV感染期间,病毒复制集中于次级淋巴滤泡中,其中的滤泡辅助T细胞(follicular helper T cells,Tfh)是HIV感染和复制的重要位点[5-6],传统的细胞毒性CD8+T细胞无法进入滤泡中,不能控制定植于淋巴滤泡内Tfh中的HIV感染。因此,CXCR5+CD8+T细胞的发现,可能对清除这一重要的HIV病毒库提供新的治疗靶点。
目前,对于CXCR5+CD8+T细胞在HIV感染疾病进程中的作用还存在争议。有学者认为CXCR5+CD8+T细胞是CD8+T细胞中的一群调节性细胞亚群,其在HIV及猴免疫缺陷病毒感染中可抑制Tfh的B细胞辅助功能,从而损害生发中心的应答,起到类似CD4+滤泡调节T细胞(follicular regulatory T cell,Tfr)的作用,因此定义其为CD8+Tfr[7]。目前对该群细胞的表型、免疫功能等的研究较少,且现有的研究还存在争议,其与HIV感染的关系有待进一步深入研究。本文拟对HIV感染中CXCR5+CD8+T细胞频率、功能变化及与HIV感染疾病进展的相关性进行研究,以探讨该群细胞在HIV感染免疫病理进程中发挥作用的可能机制。
1 对象与方法
1.1 对象 解放军第三〇二医院2015年10月—2017年5月收治的HIV感染者40例(HIV感染组)及同期体检的健康者15例(健康对照组)。HIV感染组中,男性35例,女性5例,平均年龄为(34.2±10.2)岁。HIV感染组纳入标准:①年龄18~60岁,自愿参加本研究者;②经HIV确证试验确诊的HIV感染者;③还未开始高效抗反转录病毒治疗(highly active antiretroviral therapy,HAART);④无机会性感染;⑤无高血压、糖尿病等慢性疾病。排除标准:①妊娠妇女或产褥期妇女;②有其他免疫相关性疾病或使用免疫抑制剂者。健康对照组中男13例,女2例,平均年龄(38.1±13.1)岁。已排除妊娠妇女、产褥期妇女,以及既往无免疫相关性疾病或其他基础疾病者,入组前2周无急性感染性疾病,未使用免疫抑制剂。HIV感染组和健康对照组之间在性别(χ2=0.007,P=0.934)、年龄(t=0.778,P=0.337)方面差异均无统计学意义。
本研究已获得我院伦理委员会批准,入组的所有患者及健康者均签署知情同意书。
1.2 仪器与试剂 FACS CantoII流式细胞仪、淋巴细胞亚群检测试剂盒、淋巴细胞绝对计数管、CD45-APC/Cy7、CD3-BV510、CD8-Percp/cy5.5单克隆抗体均购自美国BD公司。 CXCR5-FITC、IFN-γ-AF700、IL-10-PE单克隆抗体和固定破膜剂均购自美国Biolegend公司。淋巴细胞分离液购自德国GE Healthcare公司。HIV载量测定使用的全自动核酸分离纯化系统购自德国BIO-RAD公司(CFX96 Real-Time Ststem),HIV核酸定量检测试剂盒购自德国QIAGEN公司。
1.3 标本采集及外周血单个核细胞分离 采集研究对象清晨空腹外周静脉血4 ml,EDTA抗凝,使用Ficoll密度梯度离心法分离外周血单个核细胞(peripheral blood monocytes,PBMCs)。
1.4 流式细胞染色
1.4.1 细胞表面标志物染色 将Ficoll密度梯度离心法分离的PBMCs计数,取1.0×106个细胞悬于含2%胎牛血清(fetal calf serum,FBS)的PBS缓冲液中,调整浓度为2.0×107个/ml。加入预混目的抗体组合和同型对照抗体组合,振荡混匀后室温避光孵育30 min;加入1 ml含2% FBS的PBS缓冲液,混匀后以1500 rpm离心5 min,弃去上清后重复1次;加入1%多聚甲醛400 μl固定,4 ℃避光存放;待流式细胞仪检测。
1.4.2 细胞因子检测 将Ficoll密度梯度离心法分离的PBMCs重悬于含有10%FBS的1640培养基并接种于96孔板中,使用50 ng/ml佛波酯和500 ng/ml离子霉素作为激活剂,激活后1 h加入高尔基阻断剂,于37 ℃、5%CO2培养箱中培养4 h,回收细胞后加入1 ml含2%FBS的PBS,混匀后以1500 rpm离心5 min,弃去上清并加入固定破膜剂400 μl,4 ℃破膜30 min,其后加入破膜洗液1 ml,1500 rpm离心5 min,弃上清,加入IFN-γ流式抗体,避光孵育30 min,再用1 ml破膜洗液1500 rpm 离心5 min洗涤,加入1%多聚甲醛400 μl固定,4 ℃避光存放;待流式细胞仪检测。
1.4.3 流式细胞分析圈门策略 通过白细胞共同抗原CD45圈出淋巴细胞群,其后选定CD3+CD8+T细胞群,再从其中圈定CXCR5+的细胞群即CXCR5+CD8+T细胞,以及IFN-γ+和IL-10+的CXCR5+CD8+T细胞(见图1)。
1.5 血浆病毒载量测定 血浆HIV RNA载量检测采用实时荧光定量PCR方法,使用全自动核酸分离纯化系统(COBAS AMPLICOR)和核酸提取试剂盒,提取病毒RNA并测定病毒载量。操作过程严格按照试剂盒说明书进行。最低检测下限为40 copies/ml。
1.6 统计学处理 用SPSS 13.0统计软件进行分析,计量资料呈正态分布,以±s表示。2组间均数的比较采用成组t检验(组间方差齐)。2组相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 CXCR5+CD8+T细胞及CXCR5-CD8+T细胞功能差异 健康对照组中,CXCR5+CD8+T细胞分泌IFN-γ高于CXCR5-CD8+T细胞,CXCR5+CD8+T细胞分泌IL-10也同样高于CXCR5-CD8+T细胞(图2A、B)。HIV感染组中,CXCR5+CD8+T细胞分泌IFN-γ和IL-10的能力均显著高于CXCR5-CD8+T细胞(图2C、D)。
2.2 HIV感染者CXCR5+CD8+T细胞频率及功能变化 流式细胞分析发现,HIV感染组患者外周血CXCR5+CD8+T细胞频率较健康对照组上调,差异有统计学意义(P<0.05)(图3A);2组CXCR5+CD8+T细胞分泌IFN-γ的能力差异无统计学意义(P>0.05)(图3B)。HIV感染组CXCR5+CD8+T细胞分泌IL-10的能力较健康对照组明显上调,差异有统计学意义(P<0.05)(图3C)。

图1 CXCR5+CD8+ T细胞流式分析Figure 1 CXCR5+CD8+ T cell subset analyzed by flow cytometry

图2 HIV感染组(n=40)及健康对照组(n=15)CXCR5+CD8+ T细胞和CXCR5-CD8+ T细胞功能差异A、B.健康对照组CXCR5+CD8+ T细胞及CXCR5-CD8+ T细胞IFN-γ及IL-10表达差异;C、D.HIV感染组CXCR5+CD8+ T细胞及CXCR5-CD8+ T细胞IFN-γ及IL-10表达差异Figure 2 Differences of the function of CXCR5+CD8+ T cells and CXCR5-CD8+ T cells in HIV infected group (n=40) and health control group (n=15)
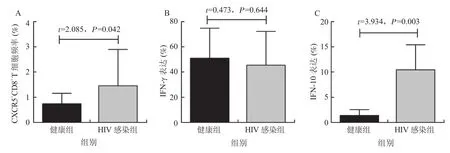
图3 HIV感染组(n=40)及健康对照组(n=15)CXCR5+CD8+ T细胞频率及功能差异A.2组间CXCR5+CD8+ T细胞频率差异;B.2组间CXCR5+CD8+ T细胞IFN-γ表达差异;C.2组间CXCR5+CD8+ T细胞IL-10表达差异Figure 3 Differences of the frequency and function of CXCR5+CD8+ T cells between HIV infected group (n=40) and health control group (n=15)
2.3 HIV感染者外周血CXCR5+CD8+T细胞频率、功能与疾病进展的关系 本研究进一步分析HIV感染者外周血CXCR5+CD8+T细胞频率与CD4+T细胞计数和血浆HIV载量的相关性发现,CXCR5+CD8+T细胞频率与其外周血CD4+T细胞计数呈弱正相关(图4A),而与血浆HIV载量呈弱负相关(图4D);CXCR5+CD8+T细胞IFN-γ的表达与其外周血CD4+T细胞计数无相关性(图4B),与血浆HIV载量呈负相关(图4E)。而CXCR5+CD8+T细胞IL-10的表达与外周血CD4+T细胞计数呈弱负相关(图4C),与血浆HIV载量呈正相关(图4F)。这些数据表明外周血CXCR5+CD8+T细胞频率及功能与HIV感染者的疾病进展密切相关。

图4 HIV感染组外周血CD4+ T细胞计数、血浆HIV载量与外周血CXCR5+CD8+ T细胞频率及功能的相关性A、B和C.CD4+ T淋巴细胞计数与CXCR5+CD8+ T细胞频率、IFN-γ表达及IL-10表达的相关性;D、E和F.血浆HIV载量与CXCR5+CD8+ T细胞频率、IFN-γ表达及IL-10表达的相关性Figure 4 Correlation of CD4+ T lymphocyte counts and plasma HIV load with the frequency and function of CXCR5+CD8+ T cells in peripheral blood of HIV infected patients
3 讨 论
目前HIV感染中CXCR5+CD8+T细胞群的免疫特征及其与疾病进展的关系尚不明确。本研究初步探索了CXCR5+CD8+T细胞的频率及IFN-γ和IL-10分泌功能,发现其频率及功能的变化与疾病的进展密切相关,提示其可能在HIV感染免疫致病机制中发挥了重要的作用。
此外,本研究还发现无论HIV感染者还是健康对照者,CXCR5+CD8+T细胞分泌IFN-γ的能力均较CXCR5-CD8+T细胞升高。新近的研究发现,利用T细胞过继转移治疗淋巴细胞脉络丛脑膜炎病毒慢性感染小鼠时,CXCR5+CD8+T细胞亚群比CXCR5-亚群表现出更好的治疗潜力[1],且在慢性HIV感染中,CXCR5-CD8+T细胞位于T细胞区,受严重原位抑制性微环境的影响,表现出严重的功能障碍,也称为耗竭[8],提示CXCR5+CD8+T细胞在慢性感染中可能发挥了更重要的抗病毒作用。本研究发现,未经治疗的HIV感染者中CXCR5+CD8+T细胞频率较健康对照组上调,其IFN-γ的表达在2组中的差异无统计学意义。而CXCR5+CD8+T细胞频率与外周血CD4+T细胞计数呈弱正相关,而与血浆HIV载量呈弱负相关,提示其对HIV感染病程可能起着控制作用。且该群细胞分泌IFN-γ的能力与血浆HIV载量呈负相关,也提示IFN-γ的分泌对控制病毒的复制发挥重要作用。
CXCR5+CD8+T细胞和CXCR5-CD8+T细胞的基因表达模式有较大差异[1]。本研究发现,CXCR5+CD8+T细胞在HIV感染组和健康对照组中分泌IL-10的能力均显著高于CXCR5-CD8+T细胞。CXCR5+CD8+T细胞群在HIV感染组中相对健康对照组也明显上调了IL-10的表达,且与外周血CD4+T细胞计数呈弱负相关,与血浆HIV载量呈正相关。近期研究发现,CXCR5+CD8+T细胞可损伤Tfh的功能及生发中心B细胞抗体的产生[7],且既往研究发现CD8+T细胞的免疫抑制作用主要依赖于IL-10的分泌[9-10],提示HIV感染可能通过上调CXCR5+CD8+T细胞的IL-10的表达抑制了生发中心应答,造成了HIV感染者体液免疫损伤,起到类似Tfr的作用[11]。另外也有研究发现,IL-10+的CD8+T细胞可通过分泌IL-10抑制IL-10-CD8+T细胞的增殖及IFN-γ的产生[9,12]。这提示高表达IL-10的CXCR5+CD8+T细胞可能也会损害CD8+T细胞分泌IFN-γ的功能从而抑制其抗病毒作用。以上研究结果提示,CXCR5+CD8+T细胞可能在HIV感染中发挥着复杂的免疫作用。CXCR5+CD8+T细胞群分泌较低IL-10和较高IFN-γ水平的HIV感染者,能更好地控制病毒复制并维持CD4+T细胞数量在较高水平。但是,目前对IL-10+CD8+T细胞发挥的功能还有争议,对羊毛硫氨酸合成酶2的研究发现其激活可能通过上调CD8+T细胞IL-10的表达,促进记忆CD4+T细胞和记忆CD8+T细胞的成熟,从而促进固有免疫向适应性免疫的转化[13]。对高表达IL-10的CXCR5+CD8+T细胞的功能还须进一步深入研究。
HIV病毒库难以清除是HIV治疗的一大障碍。而定植于淋巴滤泡中的Tfh因其对HIV高度易感以及HIV在滤泡中逃避了效应CD8+T细胞的作用而成为难以清除的HIV病毒库[5,14-15]。因此,进一步研究HIV治疗性疫苗与PD-1阻断剂或IL-2的联合使用,提高CXCR5+CD8+T细胞的免疫应答能力,可能为实现Tfh病毒库的清除提供新的途径。另外,将HIV特异的广泛中和抗体转移至非人灵长类及啮齿类动物中,均能发挥预防及治疗作用,但HIV感染者中仅有很少一部分能产生广泛中和抗体[16-17],Tfh功能的受损可能是其体液免疫功能障碍的最主要原因,阻断CXCR5+CD8+T细胞对Tfh及生发中心B细胞的抑制作用,可恢复受损的HIV感染者的体液免疫功能,从而为疫苗诱导广泛中和抗体的产生提供了可能。
研究已经明确CXCR5+CD8+T细胞主要分布在次级免疫器官中,并发现其可能在清除Tfh病毒库及生发中心B细胞功能调节中发挥重要作用。而由于组织获取的方法有限,本研究仅限于HIV感染者外周血CXCR5+CD8+T细胞,因而不能很好地解释人体组织内的该群细胞免疫特点及其在HIV感染组中与健康对照组的差异。
综上所述,本研究发现HIV慢性感染者外周血CXCR5+CD8+T细胞频率和功能与疾病进展密切相关。提示该群细胞在HIV感染免疫致病中可能发挥了重要作用,为HIV感染免疫致病机制提供了新的解释。一方面,CXCR5+CD8+T细胞可能发挥了重要的抗病毒作用,另一方面其免疫负调控作用可能也损伤了HIV感染者生发中心的B细胞应答。通过进一步的深入研究,可能揭示HIV感染中CXCR5+CD8+T细胞、Tfh及生发中心B细胞的相互作用机制,并为HIV感染病毒库的清除及HIV疫苗的研制提供新的可能的方向。
【参考文献】
[1]He R,Hou S,Liu C,et al.Follicular CXCR5-expressing CD8(+)T cells curtail chronic viral infection[J].Nature,2016,537(7620):412-428.
[2]Leong YA,Chen Y,Ong HS,et al.CXCR5(+) follicular cytotoxic T cells control viral infection in B cell follicles[J].Nat Immunol,2016,17(10):1187-1196.
[3]杨鸿鸽,焦艳梅,王福生.滤泡细胞毒性T细胞参与HIV感染进程的研究进展[J].传染病信息,2016,29(6):321-323.
[4]Ym J,Hg Y,Hh H,et al.Dichotomous roles of programmed cell death 1 on HIV-specific CXCR5+and CXCR5-CD8+T cells during chronic HIV infection[J].Front Immunol,2017,8:1786.
[5]Kohler SL,Pham MN,Folkvord JM,et al.Germinal center T follicular helper cells are highly permissive to HIV-1 and alter their phenotype during virus replication[J].J Immunol,2016,196(6):2711-2722.
[6]Crotty S.T follicular helper cell differentiation,function,and roles in disease [J].Immunity,2014,41(4):529-542.
[7]Brodie M,Miller SM,Folkvord JM,et al.Follicular regulatory CD8 T cells impair the germinal center response in SIV and ex vivo HIV infection[J].PLoS Pathog,2016,12(10):e1005924.
[8]Kuchroo VK,Anderson AC,Petrovas C.Coinhibitory receptors and CD8 T cell exhaustion in chronic infections[J].Curr Opin HIV AIDS,2014,9(5):439-445.
[9]Brockman MA,Kwon DS,Tighe DP,et al.IL-10 is up-regulated in multiple cell types during viremic HIV infection and reversibly inhibits virus-specific T cells[J].Blood,2009,114(2):346-356.
[10]Elrefaei M,Ventura FL,Baker CA,et al.HIV-specific IL-10-positive CD8+T cells suppress cytolysis and IL-2 production by CD8+T cells[J].J Immunol,2007,178(5):3265-3271.
[11]Miles B,Miller SM,Folkvord JM,et al.Follicular regulatory T cells impair follicular T helper cells in HIV and SIV infection[J].Nat Commun,2015,6:8608
[12]Endharti AT,Rifa'i M,Shi Z,et al.Cutting edge: CD8+CD122+regulatory T cells produce IL-10 to suppress IFN-gamma production and proliferation of CD8+T cells[J].J Immunol,2005,175(11):7093-7097.
[13]Leber A,Bassaganya-Riera J,Tubau-Juni N,et al.Lanthionine synthetase C-Like 2 modulates immune responses to influenza virus infection[J].Front Immunol,2017,8(4):178.
[14]Miles B,Connick E.TFH in HIV latency and as sources of replication competent virus[J].Trends Microbiol,2016,24(5):338-344.
[15]Folkvord JM,Armon C,Connick E.Lymphoid follicles are sites of heightened human immunodeficiency virus type 1 (HIV-1)replication and reduced antiretroviral effector mechanisms [J].AIDS Res Hum Retrov,2005,21(5):363-370.
[16]Moldt B,Rakasz EG,Schultz N,et al.Highly potent HIV-specific antibody neutralization in vitro translates into effective protection against mucosal SHIV challenge in vivo[J].Proc Natl Acad Sci U S A,2012,109(46):18921-18925.
[17]Shingai M,Nishimura Y,Klein F,et al.Antibody-mediated immunotherapy of macaques chronically infected with SHIV suppresses viraemia[J].Nature,2013,503(7475):277-280.

