血清免疫球蛋白等因素对分离胶采血管血液分离效果的影响
张靖宇, 范 洪, 路炳通, 胡海涛
(河北省沧州中西医结合医院实验诊断科,河北 沧州 061001)
分离胶采血管由于具有分离血清较快,在血细胞和血清之间形成隔离层,能有效阻止血细胞和血清之间的物质交换,同时可提高工作效率以及能分离出较多血清的特点,已被广泛应用于临床。有关分离胶采血管对检验结果影响的报道较多[1-4],但分离胶采血管对特殊血液分离效果的报道却较少见。本研究通过观察多发性骨髓瘤(multiple myeloma,MM)患者血液样本在分离胶采血管中的分离效果,探讨免疫球蛋白(immunoglobulin,Ig)等因素对分离胶采血管血液分离效果的影响及相应的处理办法。
1 材料和方法
1.1 研究对象
选取河北省沧州市3家医院(河北省沧州中西医结合医院、沧州市中心医院、沧州市人民医院)2012年6月—2016年12月收治的MM患者、自身免疫性疾病患者以及贫血患者。纳入标准:(1)所有MM病例的诊断均符合《中国多发性骨髓瘤诊治指南(2015年修订)》[5]中的诊断标准;(2)所有MM病例均未经过任何药物治疗;(3)自身免疫性疾病患者总蛋白(total protein,TP)>80 g/L;(4)贫血患者排除单克隆免疫球蛋白病且血细胞比容(hematocrit,HCT)<40%;(5)所有患者均知情同意并签署知情同意书。排除标准:(1)从透析管中采集的血液;(2)近期应用过造影剂的患者。
根据纳入和排除标准选取MM患者221例(IgG型149例、IgA型65例、IgM型7例),分别采用免疫透射比浊法、双缩脲法和血细胞分析仪检测Ig、TP和HCT水平(采用肝素锂抗凝)。根据Ig水平分组,将IgG型患者分为IgG≤47 g/ L组(A组,84例)和IgG>47 g/L组(B组,65例),将IgA型患者分为IgA≤38 g/L 组(C组,39例)和IgA>38 g/L组(D组,26例),所有IgM型患者IgM≤63 g/L,为IgM≤63 g/L组(E组,7例);根据TP水平将50例自身免疫性疾病患者分为TP≤90 g/L组(F组,27例)和TP>90 g/L组(G组,23例);根据HCT水平将55例贫血患者分为HCT≤30%组(H组,26例)和HCT>30%组(I组,29例)。各组年龄及性别构成比较,差异无统计学意义(P>0.05)。各组其他资料比较见表1。其中B、D和E组的Ig水平明显高于A、C、F、G、H、I组(P<0.05),B、D和G组TP水平明显高于A、C、E、F、H、I组(P<0.05),B、D和H组HCT水平明显低于A、C、E、F、G、I组(P<0.05)。
表1 各组间Ig、TP、HCT水平的比较 (±s)
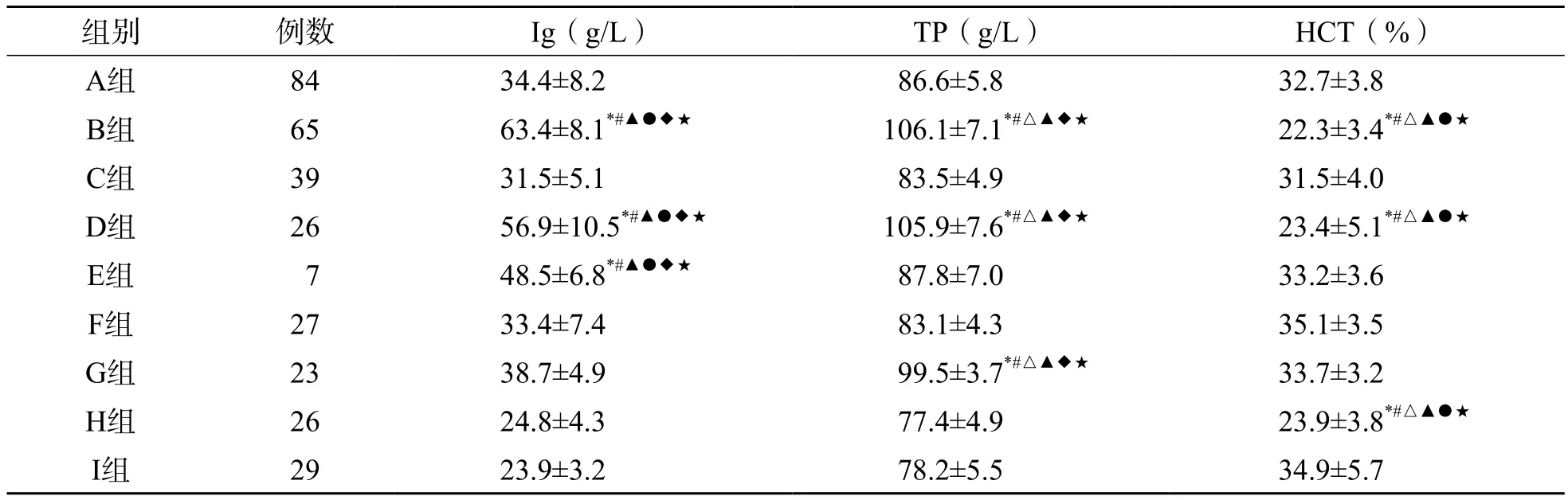
表1 各组间Ig、TP、HCT水平的比较 (±s)
注:与A组比较,*P<0.05;与C组比较,#P<0.05;与E组比较,△P<0.05;与F组比较,▲P<0.05;与G组比较,●P<0.05;与H组比较,◆P<0.05;与I组比较,★P<0.05
组别 例数 Ig(g/L) TP(g/L) HCT(%)A组 84 34.4±8.2 86.6±5.8 32.7±3.8 B组 65 63.4±8.1*#▲●◆★ 106.1±7.1*#△▲◆★ 22.3±3.4*#△▲●★C组 39 31.5±5.1 83.5±4.9 31.5±4.0 D组 26 56.9±10.5*#▲●◆★ 105.9±7.6*#△▲◆★ 23.4±5.1*#△▲●★E组 7 48.5±6.8*#▲●◆★ 87.8±7.0 33.2±3.6 F组 27 33.4±7.4 83.1±4.3 35.1±3.5 G组 23 38.7±4.9 99.5±3.7*#△▲◆★ 33.7±3.2 H组 26 24.8±4.3 77.4±4.9 23.9±3.8*#△▲●★I组 29 23.9±3.2 78.2±5.5 34.9±5.7
1.2 试剂和仪器
2种不同厂家的分离胶采血管(规格5 mL,100 mm×13 mm,上海碧迪医疗器械有限公司和河北沧州永康医药用品有限公司),肝素锂抗凝管(规格5 mL,100 mm×13 mm,河北沧州永康医药用品有限公司),样本前处理系统(日本Hitachi公司),7600-210全自动生化分析仪(日本Hitachi公司),XE-5000全自动血液分析仪及原装配套试剂(日本Sysmex公司),Ig、TP试剂盒(北京森美希克玛生物科技有限公司)。
1.3 样本采集及处理
采集研究对象空腹静脉血分别注入2种分离胶采血管以及肝素锂抗凝管(3 mL/管)中,180度上下颠倒混匀5~6次,待分离胶采血管完全凝固后置样本前处理系统中,经1 185×g离心10 min,观察2种分离胶采血管血液分层、胶体分布以及血清含量。
1.4 统计学方法
采用SPSS 22.0软件进行统计分析。计量资料进行正态性检验,符合正态分布的数据用x±s表示,不符合正态分布的数据进行转换后再进行统计,组间比较采用完全随机设计方差分。以P<0.05为差异有统计学意义。
2 结果
2.1 2种分离胶采血管离心后的血液分离效果
2种分离胶采血管的血液分离效果未见明显差异,均出现异常和正常2种不同的血液分离效果。异常血液分离效果为离心后分4层,自上而下依次为:血清、红细胞(red blood cell,RBC)、胶体、RBC,上层血清含量极少,其下的RBC明显增多,底层有少量RBC,见图1。正常血液分离效果为离心后分3层,自上而下依次为:血清、胶体、RBC,血清含量较多,见图2。
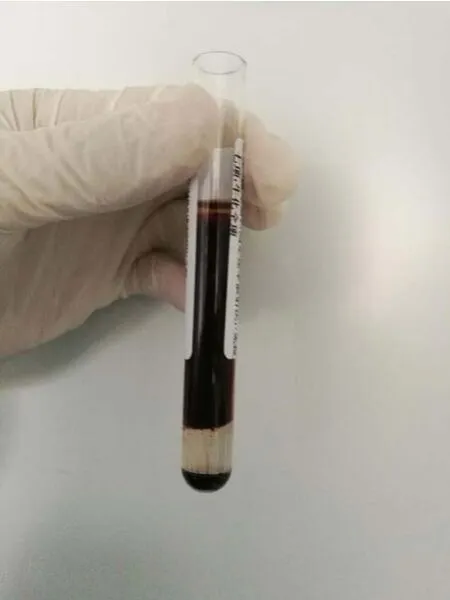
图1 异常血液分离效果
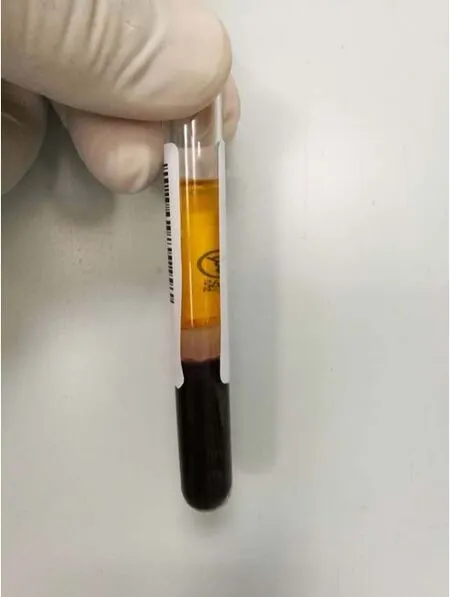
图2 正常血液分离效果
2.2 各组血液分离效果的比较
B和D组血液分离效果为异常,A、C、E、F、G、H、I组血液分离效果正常。
3 讨论
血清分离胶是一种黏性流体,其结构中有大量氢键,通过缔合作用形成网状结构,这种网状结构在离心力的作用下可被破坏,变成黏度低的流体,但当离心力消失后又会重新形成网状结构,这种性质称为触变性。分离胶的密度界于血清和RBC之间,在离心力的作用下,由于密度的原因,分离胶位置由底部升至血清与RBC层之间,形成隔离层,这种现象称为分离胶翻转。有报道称应用造影剂以及从透析管中采集的血液会造成分离胶翻转异常[6-7]。目前,国内外关于分离胶采血管翻转异常现象的报道多数集中在BD分离胶采血管出现胶体漂浮现象上[8-9],而本实验室在日常工作中发现用分离胶采血管采集TP、Ig水平明显升高,HCT、RBC明显降低的MM患者的血液,经最大离心力为1 185×g离心后出现分离胶不能有效翻转、血液分层明显异常、血清量极少、RBC明显增多的现象,血清量无法满足检验需求。
王子娥等[10]研究了2种不同胶体成分的BD采血管,发现胶体成分为丙烯酸PS510的分离胶采血管在血清IgG>50 g/L时,经2 000×g离心10 min出现分离胶漂浮现象,出现了分离胶、血清、血细胞层的分布特点,而成分为聚酯凝胶P5A的分离胶采血管没有出现分离胶漂浮现象,推测这种现象可能由分离胶成分的不同造成分离胶密度细微差别引起。FATÁS等[11]在发现分离胶漂浮现象后,为了找到分离胶漂浮的原因,他们用不同密度、黏度的葡聚糖生理盐水溶液模拟不同状态的血液,证实血清(血浆)的密度是影响分离胶漂浮的主要原因,而非血清(血浆)黏度。FAUGHT等[12]选择不同厂家分离胶采血管进行葡聚糖模拟实验,随着模拟物密度的增加,各厂家的分离胶采血管均出现分离胶漂浮现象,进一步证实了任何导致血清(血浆)密度增加并且超过分离胶密度的因素都能引起分离胶翻转异常。本研究选取的2种分离胶采血管的主要成分为聚酯凝胶P5A(上海碧迪医疗器疗器械有限公司)和烯烃低聚物(河北沧州永康医药用品有限公司),是目前国内分离胶采血管生产厂家应用较多的胶体成分,虽未发现胶体漂浮现象,但本实验室发现TP、Ig水平明显升高,HCT、RBC明显降低的MM患者2种分离胶采血管均出现胶体位置异常、肉眼红细胞层明显增多,但血液常规结果显示HCT明显降低的现象,说明胶体成分不是造成这一现象的主要原因,同时也说明肉眼所见的RBC层含有大量的血清成分,形成RBC、血清混合层。如将该混合层看成一个整体,由于血清成分较多,该层的密度有可能低于胶体密度,因此胶体不能在RBC和血清之间形成隔离层,而底层的少量RBC层由于含有血清成分少,密度比胶体大,所以出现在底部。本研究结果显示,Ig、TP水平相对较低而HCT水平相对较高的A、C、F、I组和单一Ig水平明显升高的E组以及单一TP水平明显升高的G组和单一HCT明显减少的H组血液分离现象均正常,只有Ig、TP水平明显升高,HCT明显降低的B组和D组出现异常分离现象,说明Ig、TP、HCT单一因素的明显异常不会导致血液分离异常,只有Ig、TP、HCT等同时出现异常才会造成血液异常分离,这些异常因素共同导致血凝块形成受影响以及血块回缩不良。
随着检验医学的发展,越来越多的实验室引进了全自动流水线,流水线的应用极大地降低了检验人员的工作强度。在方便的同时,以前可以通过肉眼观察到的异常现象却容易被忽视,但流水线在进行血清自动提取的过程中也经常出现提取失败的情况,除血样过少外,真性红细胞增多症、肺心病、MM等也会出现血清量过少的现象,在观察血清量的同时也要对血液分层、胶体分布情况进行观察,无论是胶体翻转异常还是分层出现问题,均要考虑该样本可能存在Ig、TP、HCT异常的情况,同样也要考虑MM存在的可能性。
[1]陈益川,张德亭,李莉莉,等. 3种采血管制备的标本对6种生化指标检测结果的影响[J]. 检验医学,2014,29(4):402-404.
[2]牛爱军,任爱琴,王开森,等. 分离胶真空采血管在医学检验自动化流水线中应用[J]. 中国现代医学杂志,2013,23(12):73-77.
[3]HEPBURN S,WRIGHT M J,BOYDER C,et al.Sex steroid hormone stability in serum tubes with and without separator gels[J]. Clin Chem Lab Med,2016,54(9):1451-1459.
[4]BORAI A,BAHIJRI S,LIVINGSTONE C,et al.Assessment of becton dickinson plain and serum separator tubes in measurement of 25-hydroxyvitamin D3(25OHD3) by HPLC and immunoassay methods[J]. J Clin Lab Anal,2016,30(1):32-35.
[5]中国医师协会血液科医师分会,中华医学会血液学分会,中国医师协会多发性骨髓瘤专业委员会.中国多发性骨髓瘤诊治指南(2015年修订)[J]. 中华内科杂志,2015,54(12):1066-1070.
[6]LIMA-OLIVEIRA G,LIPPI G,SALVAGNO G L,et al. Abnormal gel flotation caused by contrast media during adrenal vein sampling[J]. Biochem Med(Zagreb),2016,26(3):444-450.
[7]赵立飞,徐建华,解传芬,等. 临床应用分离胶采血管需注意的问题[J]. 临床检验杂志,2012,30(7):543-545.
[8]VAN DEN OUWELAND JOHANNES M W,CHURCH S. High total protein impairs appropriate gel barrier formation in BD vacutainer blood collection tubes[J]. Clin Chem,2007,53(2):364-365.
[9]GERIN F,RAMAZAN D C,BAYKAN O,et al.Abnormal gel flotation in a patient with apperant pneumonia diagnosis:a case report[J]. Biochem Med(Zagreb),2014,24(1):180-182.
[10]王子娥,宋晓斐,段文冰,等. 血清IgG浓度对分离胶采血管使用的影响[J]. 中华检验医学杂志,2015,38(2):141-142.
[11]FATÁS M,FRANQUELO P,FRANQUELO R.Anomalous flotation of separator gel:density or viscosity?[J]. Clin Chem,2008,54(4):771-772.
[12]FAUGHT R C,MARSHALL J,BORNHORST J.Solution densities and estimated total protein contents associated with inappropriate fl otation of separator gel in different blood collection tubes[J]. Arch Pathol Lab Med,2011,135(9):1081-1084.

