血清CX3CL1在肺癌骨转移中的临床意义
许 晨, 唐晓峰
(第二军医大学长征医院输血科,上海 200003)
肺癌是全世界发病率和死亡率最高的癌症之一,每年大约有170万人死于肺癌,占癌症死亡总人数的23%[1]。近年来,我国肺癌发病率急剧升高,成为世界上肺癌患者最多的国家[2]。与其他癌症一样,转移是造成肺癌患者死亡的主要原因[3]。骨是肺癌最常见的转移部位,尸检显示80%的肺癌患者最终发生骨转移,肺癌骨转移患者平均生存期仅为9.7个月[4]。肺癌骨转移起病隐匿,临床上缺少行之有效的预警手段,从而错过最佳干预时机。目前采用的血液检验、电子计算机断层扫描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)等常规检查手段并不能及时检出癌症骨转移灶,而发射型计算机断层扫描(emission computed tomography,ECT)、正电子发射断层显像/X线计算机体层成像(positron emission tomography/computed tomography,PET/CT)检查虽具有一定的敏感性,但其存在耗时、价格昂贵、辐射损伤、操作繁琐等缺陷而不宜作为常规检查项目。所以,肺癌骨转移的监测和早期诊断亟需新的方法。血清肿瘤标志物以其方便快捷、价格低廉、安全高效等优点在癌症的临床诊治中发挥着至关重要的作用[5]。有研究显示,CX3趋化因子配体1(CX3 chemokine ligand 1,CX3CL1)与多种癌症脊柱转移相关[6]。为此,本研究通过检测肺癌患者血清CX3CL1水平,初步探讨血清CX3CL1对肺癌骨转移的临床价值。
1 材料和方法
1.1 研究对象
选取2017年1—5月第二军医大学长征医院骨肿瘤科确诊的肺癌骨转移患者40例,其中男24例、女16例,年龄42~88岁。选取同期第二军医大学长征医院呼吸内科及胸外科确诊的无远处转移肺癌患者40例,其中男20例、女20例,年龄43~89岁。收集80例肺癌患者的临床资料进行回顾性分析。肺癌病理类型经活检或术后病理确诊,肺癌骨转移经PET/CT、ECT等影像学检查判定或术后病理确诊。
1.2 方法
采集所有患者术前空腹静脉血5 mL,室温静置60 min后1 000×g离心15 min,分离血清,置-80 ℃保存。采用酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)检测可溶型CX3CL1,试剂盒购自美国R&D公司,严格按试剂盒说明书操作,每份样本重复检测3次[6]。
1.3 统计学方法
采用SPSS 16.0软件进行统计分析。计量数据呈正态分布,采用±s表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 肺癌患者血清CX3CL1水平分析
80例肺癌患者中男44例、女36例,年龄42~89岁;腺癌57例,鳞癌23例;原发灶直径(多发者取最大病灶测量)为0.25~3.08 cm,中位数为1.31 cm。
骨转移组血清CX3CL1水平高于无转移组(P<0.001)。不同病理类型、原发灶大小、年龄和性别的肺癌患者之间血清CX3CL1水平差异均无统计学意义(P>0.05)。见表1。
表1 不同临床及病理因素的肺癌患者血清CX3CL1水平的比较 (ng/mL,±s)
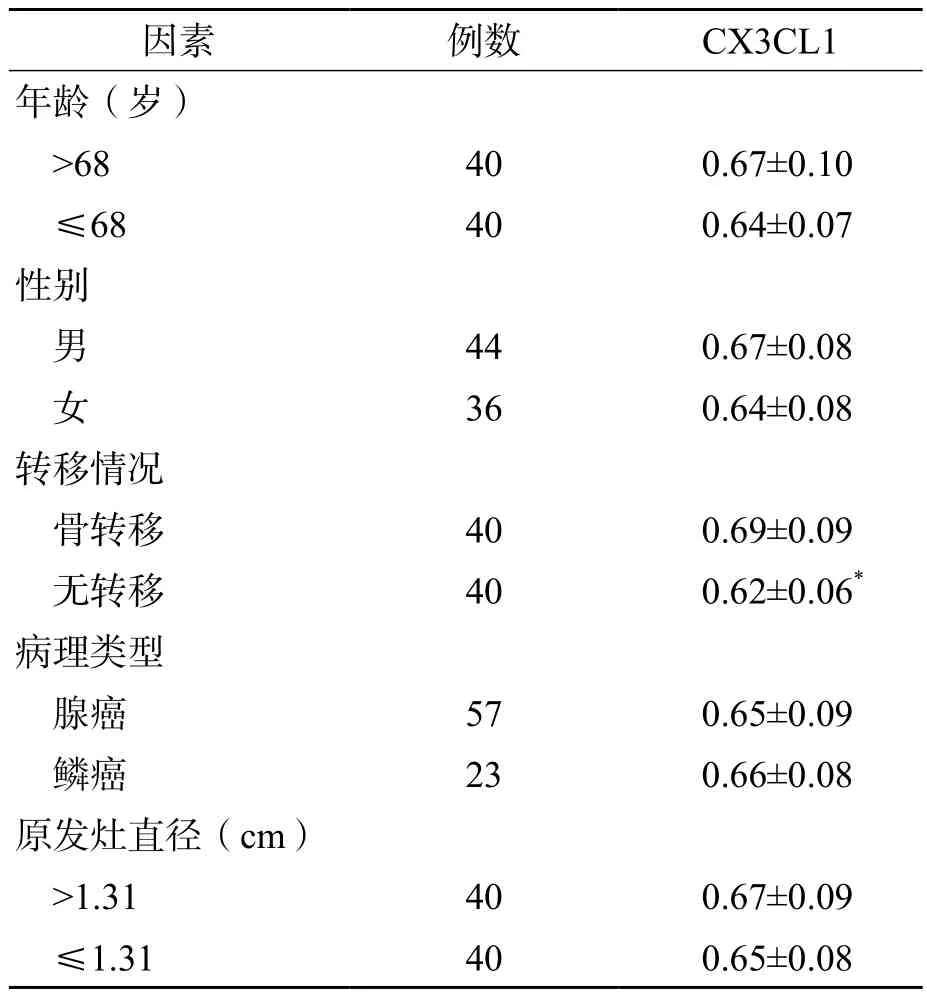
表1 不同临床及病理因素的肺癌患者血清CX3CL1水平的比较 (ng/mL,±s)
注:与骨转移比较,*P<0.001
因素 例数 CX3CL1年龄(岁)>68 40 0.67±0.10≤68 40 0.64±0.07性别男44 0.67±0.08女36 0.64±0.08转移情况骨转移 40 0.69±0.09无转移 40 0.62±0.06*病理类型腺癌 57 0.65±0.09鳞癌 23 0.66±0.08原发灶直径(cm)>1.31 40 0.67±0.09≤1.31 40 0.65±0.08
2.2 肺腺癌患者血清CX3CL1水平分析
57例肺腺癌患者中男30例,女27例,中位年龄为67岁,原发灶直径中位数为1.32 cm,骨转移者33例、无转移者24例。
骨转移组血清CX3CL1水平高于无转移组(P=0.002)。不同病理类型、原发灶大小、年龄和性别的肺腺癌患者之间血清CX3CL1水平差异均无统计学意义(P>0.05)。见表2。
2.3 肺鳞癌患者血清CX3CL1水平分析
23例肺鳞癌患者中男14例,女9例,中位年龄为72岁,原发灶直径中位数为1.29 cm,骨转移者7例、无转移者16例。
表2 不同临床及病理因素的肺腺癌患者血清CX3CL1水平的比较 (ng/mL,±s)

表2 不同临床及病理因素的肺腺癌患者血清CX3CL1水平的比较 (ng/mL,±s)
注:与骨转移比较,*P=0.002
因素 例数 CX3CL1年龄(岁)>67 28 0.67±0.10≤67 29 0.64±0.07性别男30 0.66±0.08女27 0.64±0.09转移情况骨转移 33 0.68±0.09无转移 24 0.61±0.06*原发灶直径(cm)>1.32 29 0.65±0.09≤1.32 28 0.65±0.09
骨转移组血清CX3CL1水平高于无转移组(P=0.001)。不同病理类型、原发灶大小、年龄和性别的肺鳞癌患者之间血清CX3CL1水平差异均无统计学意义(P>0.05)。见表3。
表3 不同临床及病理因素的肺鳞癌患者血清CX3CL1水平的比较 (ng/mL,±s)
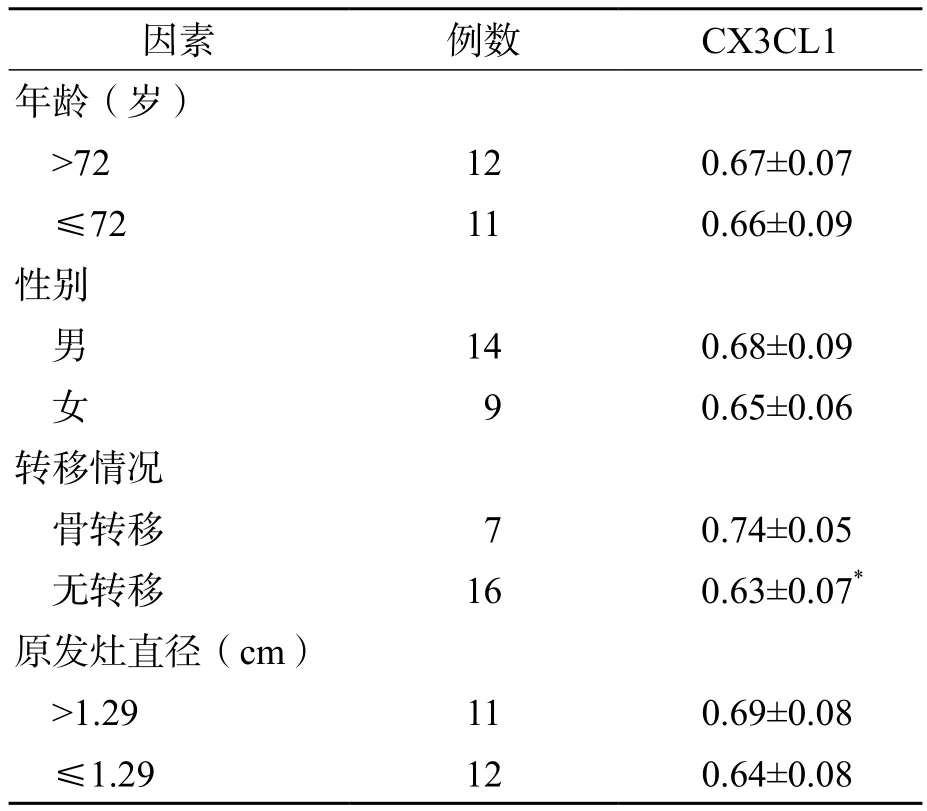
表3 不同临床及病理因素的肺鳞癌患者血清CX3CL1水平的比较 (ng/mL,±s)
注:与骨转移比较,*P=0.001
因素 例数 CX3CL1年龄(岁)>72 12 0.67±0.07≤72 11 0.66±0.09性别男14 0.68±0.09女9 0.65±0.06转移情况骨转移 7 0.74±0.05无转移 16 0.63±0.07*原发灶直径(cm)>1.29 11 0.69±0.08≤1.29 12 0.64±0.08
3 讨论
骨是肺癌最常见的远处转移器官。肺癌一旦发生骨转移,常会导致病理性骨折甚至瘫痪等严重并发症[7]。远处转移是肺癌预后的分水岭。肺癌一旦发生远处转移,其5年生存率仅为3.6%[8]。肺癌骨转移的早治疗将极大提高患者的生存质量[9],但临床上缺乏行之有效的肺癌骨转移预警手段。血清肿瘤标志物的检测因其方便、快捷等优点而被广泛用于肿瘤复发转移的临床监测[5]。因此,本研究初步探讨了血清CX3CL1水平在肺癌骨转移中的临床意义。
CX3CL1是趋化因子家族中重要的一员。人类CX3CL1基因位于16号染色体,兼有黏附和趋化活性[10]。目前,关于CX3CL1在癌症骨转移过程中作用的研究较少。CAI等[11]通过研究细胞系和动物模型,发现骨高转移细胞系中CX3CL1 RNA表达较其母细胞系升高1 000倍。LIU等[6]的研究结果显示,相对于血样,肺癌脊柱转移组织样本中的CX3CL1表达普遍升高。以上研究结果均提示CX3CL1在肺癌骨转移过程中发挥着重要作用。CX3CL1有膜结合型和可溶型2种形式。关于CX3CL1与癌症骨转移之间的相关研究主要集中于膜结合型,对于血清中的可溶性CX3CL1与肺癌骨转移相关的研究极少。LIU等[6]的研究显示肺癌脊柱转移患者血清CX3CL1水平明显高于正常对照者,提示血清中的可溶性CX3CL1可能与转移灶中的膜结合型CX3CL1一起通过趋化引导功能促进肺癌细胞的脊柱转移。但LIU等[6]的研究样本量过小(仅5例脊柱转移样本),具有较大的局限性,且无相关临床病理数据分析。本研究通过检测80例肺癌患者血清CX3CL1水平并结合临床资料进行分析,发现无论是在所有肺癌患者中还是在肺腺癌或肺鳞癌患者中,有骨转移的患者血清CX3CL1水平均高于无转移者(P<0.05),且不同年龄、性别的患者之间血清CX3CL1水平差异均无统计学意义(P>0.05)。因此,CX3CL1可能是促进肺癌骨转移的重要因子,且与性别、年龄无关。目前,血清CX3CL1水平与肺癌病理类型、原发灶大小之间的关系尚缺乏相关研究。本研究结果显示,在80例肺癌患者中,虽然不同肺癌病理类型、原发灶大小的患者之间血清CX3CL1水平差异无统计学意义(P>0.05),但肺鳞癌患者血清CX3CL1水平稍高于肺腺癌患者,原发灶较大的患者血清CX3CL1水平稍高于原发灶较小的患者。由此提示血清CX3CL1水平与肺癌病理类型、原发灶大小可能存在一定的关系,但尚需进一步扩大样本量验证。本研究还进一步分析了肺腺癌和肺鳞癌患者血清CX3CL1水平与原发灶大小之间的关系,结果显示无论是肺腺癌还是肺鳞癌,不同原发灶大小的患者之间血清CX3CL1水平差异均无统计学意义(P>0.05),但肺鳞癌患者中原发灶较大者血清CX3CL1水平稍高于原发灶较小者。这提示肺鳞癌原发灶的大小与血清CX3CL1水平可能存在一定的关系,但尚需进一步扩大样本量验证。
综上所述,本研究结果提示CX3CL1在肺癌骨转移过程中起重要作用,但尚需开展更大规模的前瞻性研究,评估其作为肺癌骨转移早期诊断指标的可行性。
[1]JEMAL A,BRAY F,CENTER M M,et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[2]赫捷,陈万青. 2012中国肿瘤登记年报[M]. 北京:军事医学科学出版社,2012:10-11.
[3]GUPTA G P,MASSAGUÉ J. Cancer metastasis:building a framework[J]. Cell,2006,127(4):679-695.
[4]SUGIURA H,YAMADA K,SUGIURA T,et al.Predictors of survival in patients with bone metastasis of lung cancer[J]. Clin Orthop Relat Res,2008,466(3):729-736.
[5]TSUKUSHI S,KATAGIRI H,KATAOKA T,et al.Serum tumor markers in skeletal metastasis[J]. Jpn J Clin Oncol,2006,36(7):439-444.
[6]LIU W,BIAN C,LIANG Y,et al. CX3CL1:a potential chemokine widely involved in the process spinal metastases[J]. Oncotarget,2017,8(9):15213-15219.
[7]COLEMAN R E. Skeletal complications of malignancy[J]. Cancer,1997,80(8 Suppl):1588-1594.
[8]SIEGEL R,DESANTIS C,VIRGO K,et al.Cancer treatment and survivorship statistics,2012[J].CA Cancer J Clin,2012,62(4):220-241.
[9]DABROWSKA M,GRUBEK-JAWORSKA H,DOMAGAL/A-KULAWIK J,et al. Diagnostic usefulness of selected tumor markers(CA125,CEA,CYFRA 21-1) in bronchoalveolar lavage fluid in patients with non-small cell lung cancer[J].Pol Arch Med Wewn,2004,111(6):659-665.
[10]LUSTER A D. Chemokines-chemotactic cytokines that mediate inf l ammation[J]. N Engl J Med,1998,338(7):436-445.
[11]CAI X,LUO J,YANG X,et al.In vivoselection for spine-derived highly metastatic lung cancer cells is associated with increased migration,inf l ammation and decreased adhesion[J]. Oncotarget,2015,6(26):22905-22917.

