尿液有形成分分析联合血清降钙素原检测在尿路感染诊断中的应用价值
虞培娟, 张杲琳, 严茹红, 冯 萍, 孙兰云, 朱雪明, 王敬华
(1.苏州大学附属第二医院检验科,江苏 苏州 215000;2.中国人民解放军第一〇〇医院检验科,江苏 苏州 215000;3.苏州科技城医院检验科,江苏 苏州 215153;4.上海市临床检验中心临床微生物学研究室,上海 200126)
尿路感染是医院获得性感染和社区获得性感染中最常见的一种类型,是由各种病原微生物在尿路中生长、繁殖所引起的炎症性疾病。非复杂性尿路感染、无症状性尿路感染与首次发生的尿路感染常由大肠埃希菌引起,医院获得性、复杂性与复发性尿路感染多由肠球菌、克雷伯杆菌、变形杆菌和铜绿假单胞菌等所致[1]。目前,尿液细菌培养仍然是诊断尿路感染的金标准[2],但其缺点是耗时,从培养到鉴定至少需要2~3 d,这大大影响了对患者的早期诊断与治疗,不利于患者的预后。另外,并不是所有尿液细菌培养都会得到阳性结果,盲目对所有标本进行培养会造成时间和资源的浪费。因此,需找到一种简便、快速、准确的方法,以满足临床的需求。本研究运用UF-1000i全自动尿有形成分分析仪(简称UF-1000i),探讨尿液有形成分分析联合血清降钙素原(procalcitonin,PCT)检测在尿路感染诊断中的应用价值。
1 材料和方法
1.1 标本来源
收集2015年7月—2016年12月苏州大学附属第二医院门诊以及住院疑似尿路感染患者的尿液标本1 372例,其中男性患者标本754例、女性患者标本618例。按无菌操作要求,留取患者中段尿于无菌尿杯中。所有标本均及时送检,标本转运时间均符合要求,并在2 h内完成检测。
1.2 仪器和材料
UF-1000i及配套试剂(日本Sysmex公司),血平板(上海科玛嘉微生物技术有限公司),接种环(江苏姜堰市康达实验器材厂),高压灭菌器(天津开发区合普工贸有限公司),培养箱(美国Thermo公司),Phoenix-100全自动细菌鉴定/药敏系统(美国BD公司),一次性无菌尿杯及无菌试管(浙江拱东医疗器械股份有限公司),cobas e411全自动电化学发光免疫分析系统(瑞士Roche公司)。
1.3 方法
1.3.1 尿液细菌培养 接收标本后,先将标本充分混匀,用移液枪吸取10 μL标本至血平板上,用经高压灭菌的接种环以连续划线方式进行接种。将接种后的血平板放置于(35±1)℃的二氧化碳培养箱内进行孵育,孵育时间为18~24 h。观察孵育后的血平板,对尿液细菌培养结果为阳性的血平板进行菌落计数。以革兰阴性杆菌的菌落计数>105CFU/mL、革兰阳性球菌的菌落计数>104CFU/mL为有临床意义[3-4]。对菌落进行菌种鉴定,鉴定到种。若同一份标本中培养出3种及以上的病原微生物,这可能与标本收集或处理不当有关,则判定该标本为污染标本。连续孵育48 h后,血平板上无细菌生长,则尿液细菌培养结果为阴性。
1.3.2 UF-1000i尿液有形成分分析 将尿液细菌培养后剩余的标本立即混匀,倒10 mL至无菌试管中,运用UF-1000i对标本进行白细胞计数和细菌计数。根据UF-1000i分析软件提供的数据,记录白细胞计数及细菌计数的结果,并分析细菌散点图信息与尿液细菌培养结果的符合性。
1.3.3 血清PCT检测 共检测550例标本的血清PCT(cobas e411全自动电化学发光免疫分析系统)。排除存在其他部位感染的患者标本146例,将其余的404例标本分为尿液细菌培养阳性组、尿液细菌培养阴性组和UF-1000i阳性组(白细胞计数、细菌计数同时阳性)、UF-1000i阴性组(白细胞计数、细菌计数同时阴性),与正常对照组(体检健康者87名)进行比较,并进行统计学分析。
1.4 统计学方法
采用SPSS 16.0软件进行统计分析。非正态分布数据以中位数(M)[四分位数(P25,P75)]表示,组间比较采用U检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价UF-1000i白细胞计数和细菌计数诊断尿路感染的价值。以P<0.05为差异有统计学意义。
2 结果
2.1 尿液细菌培养结果
1 372例标本中有34例尿液细菌培养结果包含3种及以上的病原微生物,判定为污染标本。1 338例合格标本中结果阳性有341例,阳性率为25.5%,其中男性患者标本124例,女性患者标本217例。革兰阳性球菌102株,革兰阴性杆菌222株(126株为大肠埃希菌),其余为酵母菌。
2.2 ROC曲线绘制及最佳临界值判断
以尿液细菌培养结果为金标准,根据UF-1000i白细胞计数和细菌计数结果绘制ROC曲线。白细胞计数的曲线下面积(area under curve,AUC)为0.723,最佳临界值为27.5/ μL。细菌计数的AUC为0.916,最佳临界值为143.5/ μL。见图1、图2、表1。
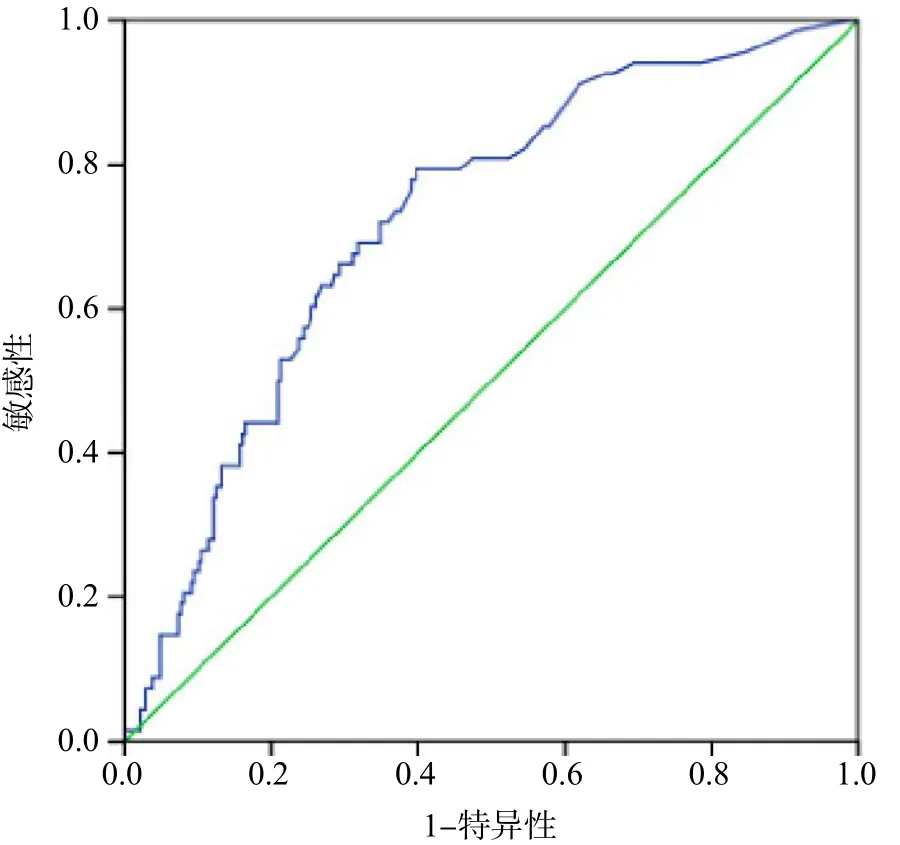
图1 UF-1000i检测尿液白细胞计数的ROC曲线
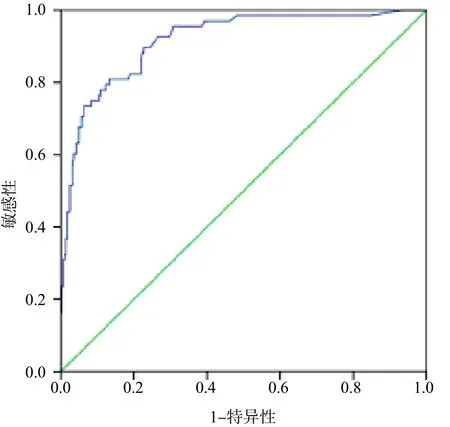
图2 UF-1000i检测尿液细菌计数的ROC曲线
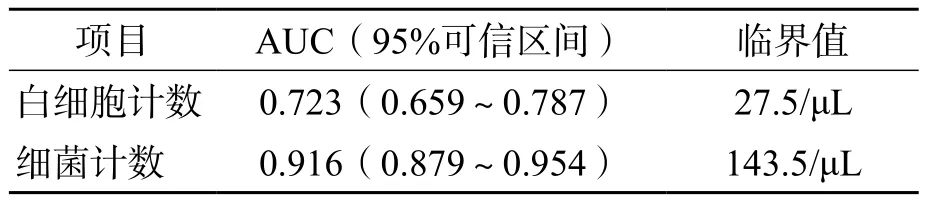
表1 白细胞计数和细菌计数诊断尿路感染的AUC最佳临界值
以大于白细胞计数和细菌计数的最佳临界值为阳性,1 338例标本中白细胞计数阳性667例,细菌计数阳性403例。UF-1000i细菌计数、白细胞计数与尿液细菌培养之间的关系见表2。单独以白细胞计数阳性作为筛查指标时,敏感性为80.1%,特异性为60.5%,阳性预测值为40.9%,阴性预测值为89.9%;单独以细菌计数阳性作为筛查指标时,敏感性为80.1%,特异性为87.0%,阳性预测值为67.7%,阴性预测值为92.7%;以细菌计数阳性或白细胞计数阳性作为筛查指标时,敏感性为90.0%,特异性为55.3%,阳性预测值为40.8%,阴性预测值为94.2%;以细菌计数阳性和白细胞计数阳性作为筛查指标时,敏感性为69.2%,特异性为92.7%,阳性预测值为76.4%,阴性预测值为89.8%。见表3。
2.3 UF-1000i细菌散点图信息分析
将尿液细菌培养结果与UF-1000i尿液有形成分分析结果进行比较,结果表明尿液细菌培养结果与UF-1000i细菌散点图信息的符合率为57%(194/341)。见表4。
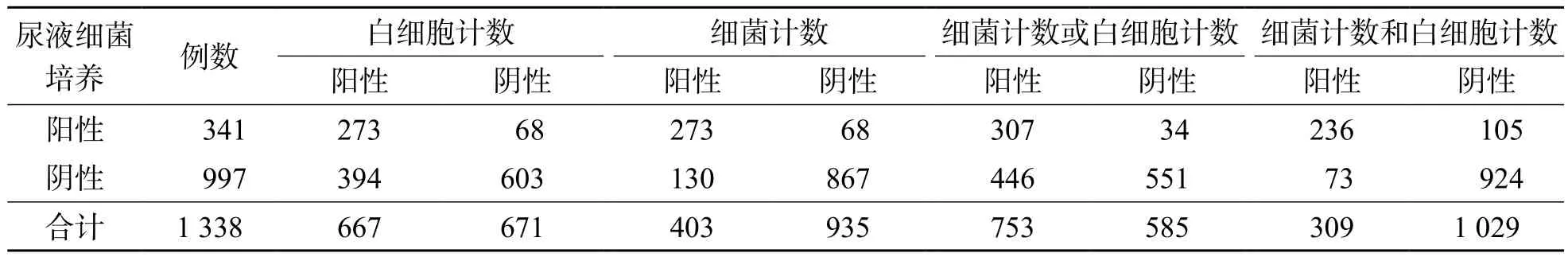
表2 UF-1000i细菌计数、白细胞计数与尿液细菌培养的关系
2.4 血清PCT检测结果分析
UF-1000i阳性组的PCT水平与UF-1000i阴性组和正常对照组比较差异有统计学意义(P<0.05),与尿液细菌培养阳性组比较差异无统计学意义(P>0.05)。见表5。
当UF-1000i阳性组联合血清PCT检测筛查尿路感染时,随着血清PCT临界值的升高,特异性也随之升高,但敏感性随之降低。见表6。
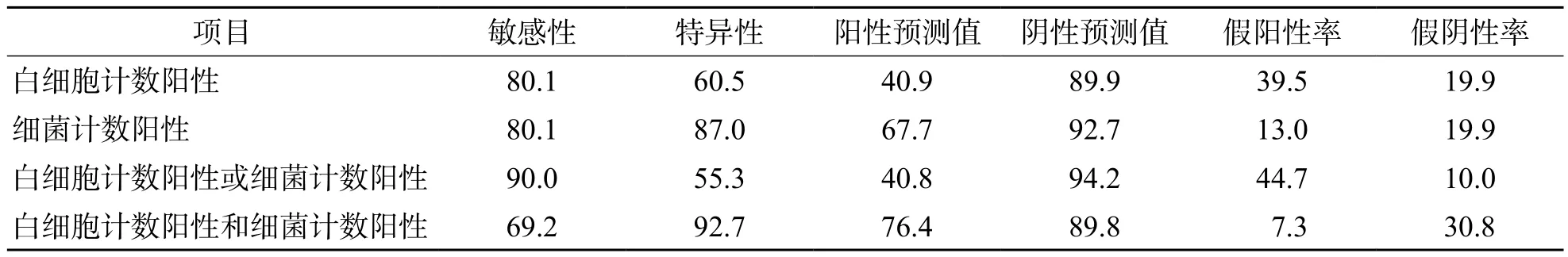
表3 细菌计数、白细胞计数单独或联合使用在尿路感染筛查中的价值 (%)
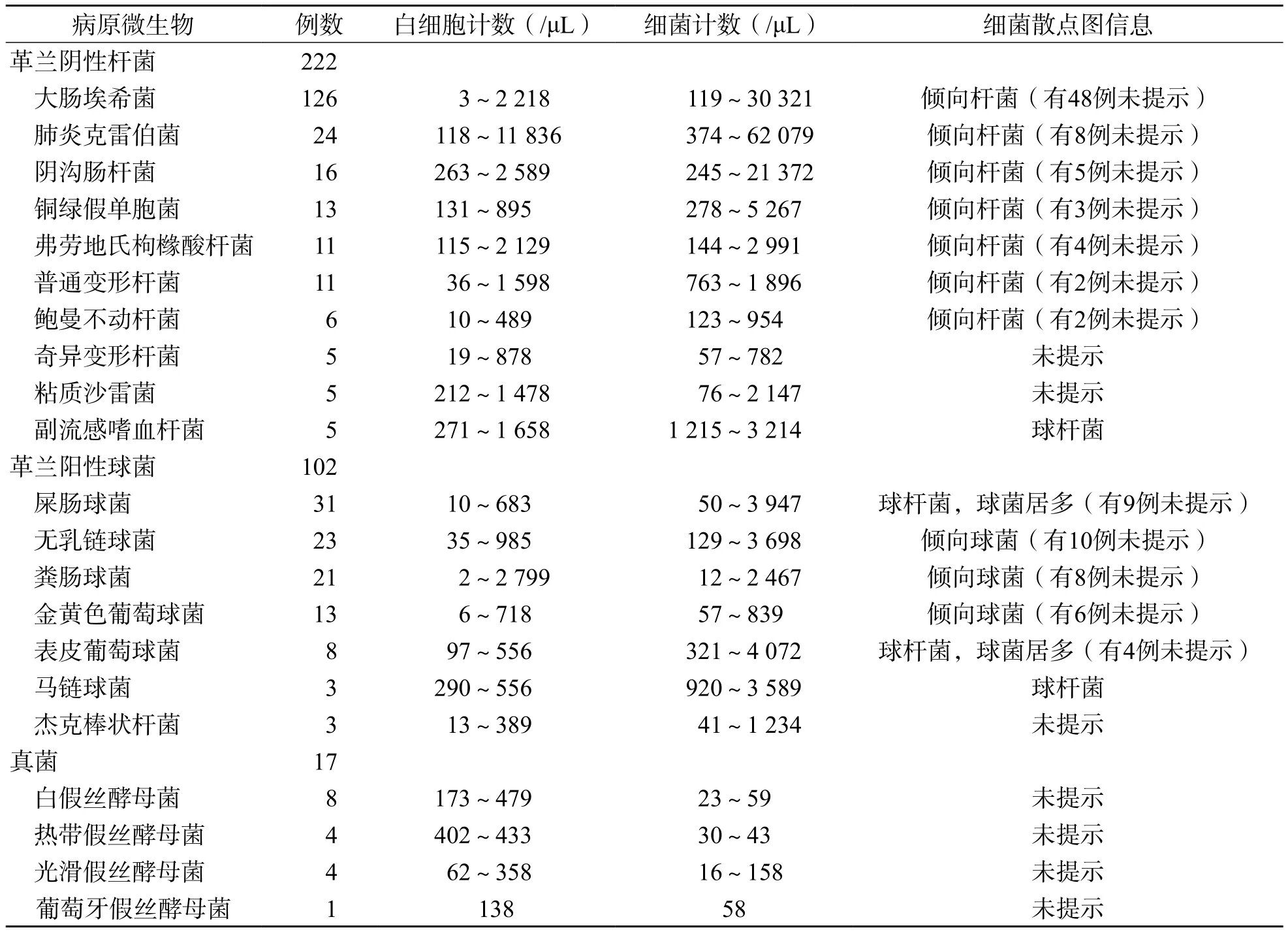
表4 UF-1000i尿液有形成分分析结果
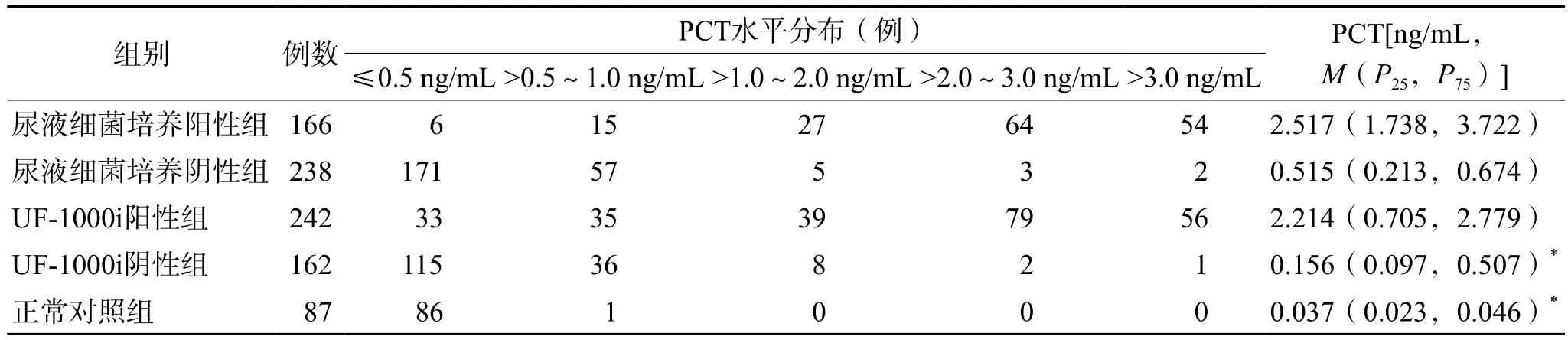
表5 各组血清PCT水平及分布
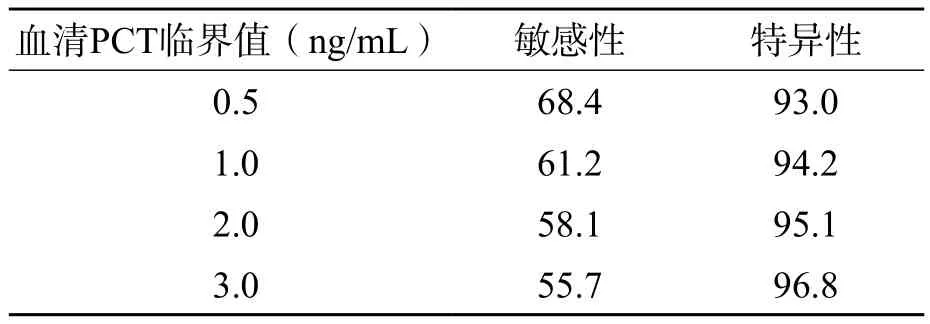
表6 UF-1000i阳性组联合血清PCT检测筛查尿路感染的价值 (%)
3 讨论
尿路感染发病率高,多发于老年人、育龄女性和免疫力低下者,主要由细菌感染引起,如果治疗不当或延误治疗,容易转化为慢性尿路感染,影响患者的身心健康。目前,诊断尿路感染依旧以尿液细菌培养结果为金标准。尿亚硝酸盐和白细胞酯酶可为临床诊断尿路感染提供依据[5]。然而,尿干化学检测结果与尿液细菌培养结果相关性差,影响因素较多。尿液有形成分人工镜检可提高尿路感染筛查的可靠性。然而,在实际工作中,临床实验室标本量大,工作繁忙,人工镜检难以广泛应用。UF-1000i因快速、定量、易于质量控制等优点得到了广泛使用。
本研究以尿液细菌培养结果为金标准,根据尿液有形成分分析结果,绘制出ROC曲线,得出细菌计数最佳临界值为143.5/μL,白细胞计数最佳临界值为27.5/μL,低于MANONI等[6]报道的40/μL,这可能是因为本研究尿液分析标本均为无菌方式留取所致,而非选取门诊随机尿,这可减少其他部位的携带污染。以细菌计数阳性和白细胞计数阳性作为筛查指标时,特异性达92.7%,显著高于白细胞计数或细菌计数单独使用时的特异性,但假阴性率也高达30.8%,存在一定的漏检。
UF-1000i根据不同细菌形态,通过激光束产生前向、侧向散射光以及荧光强度的不同,来大致区分球菌和杆菌。球菌的横截面直径往往大于杆菌,所形成的前向散射光强度也大于杆菌[7]。根据UF-1000i细菌散点图信息,可知UF-1000i细菌散点图信息与尿液细菌培养结果部分一致。本研究尿液细菌培养阳性率仅为25.5%,低于LE等[8]报道的40.4%和MOSHAVER等[9]报道的37.8%。有些患者临床尿路刺激征明显,UF-1000i细菌计数和白细胞计数结果也高于临界值,但是尿液细菌培养结果却为阴性,这可能有以下几种原因:苏州大学附属第二医院要求患者需清洗外阴后留取中段尿,门诊患者只能在第2天留取标本,而第1天晚上患者可能会服用抗菌药物,或者在清洗外阴时使用了消毒液,均可造成细菌活性受到抑制或者无活性,从而抑制细菌在血平板上的生长,另有部分患者可能为厌氧菌或支原体感染,故尿液细菌培养结果为阴性。
PCT在正常人的血清中水平很低,当发生细菌感染时会显著升高,故血清PCT检测近年来广泛应用于临床,对鉴别感染类型具有重要价值[10]。本研究血清PCT检测结果显示,尿液细菌培养阳性组和UF-1000i阳性组分别有96%(160/166)和86%(209/242)的患者血清PCT水平>0.5 ng/mL。当UF-1000i阳性组联合血清PCT检测筛查尿路感染时,随着血清PCT临界值的升高,特异性也随之升高,为临床筛查尿路感染提供了有力证据。
综上所述,UF-1000i以细菌计数>143.5/μL或白细胞计数>27.5/μL筛查尿路感染时,具有较好的敏感性以及较低的假阴性率,临床可筛查出大部分尿路感染患者,漏检率低,但具有较高的假阳性率。临床医生可结合血清PCT检测结果来决定是否进行尿液细菌培养,还可结合球菌、杆菌提示信息初步判断尿路感染的病原微生物类型,给予初步药物治疗以缓解病情,同时进行尿液细菌培养,根据结果对药物作进一步调整。若患者UF-1000i细菌计数<143.5/μL和白细胞计数<27.5/μL且血清PCT检测结果正常时,可基本排除尿路感染的可能。由此可见,采用UF-1000i尿液有形成分分析结合血清PCT检测,可筛查出大部分阴性结果,有针对性地进行尿液细菌培养,减少盲目培养的情况,为患者节约了医疗费用[11-12],满足临床检测快速、简便的需求。
[1]JEAN S S,COOMBS G,LING T,et al.Epidemiology and antimicrobial susceptibilityprof i les of pathogens causing urinary tract infections in the Asia-Pacific region:results from the Study for Monitoring Antimicrobial Resistance Trends(SMART),2010-2013[J]. Int J Antimicrob Agents,2016,47(7):328-334.
[2]GLASS J I,LEFKOWITZ E J,GLASS J S,et al. The complete sequence of the mucosal pathogen Ureaplasma urealyticum[J]. Nature,2000,407(6805):757-762.
[3]KASS E H. Asymptomatic infections of the urinary tract[J]. Trans Assoc Am Physicians,1956,69:56-64.
[4]PAPPAS P G. Laboratory in the diagnosis and management of urinary tract infections[J]. Med Clin North Am,1991,75(2):313-325.
[5] 战伟. SYSMEX UF-1000i尿有形成分分析仪对尿路感染的诊断价值[J].大连大学学报,2015,36(3):100-102.
[6]MANONI F,FORNASIERO L,ERCOLIN M,et al. Cutoff values for bacteria and leukocytes for urine flow cytometer Sysmex UF-1000i in urinary tract infections[J]. Diagnostic Microbiol Infect Dis,2009,65(2):103-107.
[7]樊云蓉,甘超,漆涌,等. UF-1000i全自动尿有形成分分析仪对尿路感染的诊断价值[J]. 中华检验医学杂志,2009,32(6):635-638.
[8]LE Z,LI F,FEI C,et al. Performance of the Sysmex UF-1000i urine analyser in the rapid diagnosis of urinary tract infections in hospitalized patients[J]. J Infect Chemother,2016,22(6):377-382.
[9]MOSHAVER B,DE BOER F,VAN EGMONDKREILEMAN H,et al. Fast and accurate prediction of positive and negative urine cultures by flow cytometry[J]. BMC Infect Dis,2016,16:211.
[10]崔晓莉,王忠勇,赵宏胜,等. 降钙素原对重症患者细菌感染预后的预测价值[J]. 中华急诊医学杂志,2013,22(6):610-633.
[11]VAN DER ZWET W C,HESSELS J,CANBOLAT F,et al. Evaluation of the Sysmex UF-1000i®urine flow cytometer in the diagnostic work-up of suspected urinary tract infection in a Dutch general hospital[J]. Clin Chem Lab Med,2010,48(12):1765-1771.
[12]BROEREN M A,BAHCECI S,VADER H L,et al.Screening for urinary tract infection with the Sysmex UF-1000i urine fl ow cytometer[J]. J Clin Microbiol,2011,49 (3) :1025-1029.

