洛铂联合紫杉醇在食管癌新辅助化疗中的应用
郑晓东 侯建彬 张卫民
新辅助化疗/放化疗联合手术是治疗局部进展期食管癌新标准[1]。2011年,由中国抗癌协会食管癌专业委员会编辑出版的《中国食管癌规范化诊治指南》中已把术前新辅助治疗提到十分重要的位置[2]。新辅助治疗方案尚无统一标准,化疗仍以含“铂类”的两药联合方案为主,目前国内外常用一线化疗方案为顺铂联合紫杉醇类或5-FU[3~5]。但顺铂作为第一代铂类化疗药物,在取得良好治疗效果的同时,常伴随着患者难以忍受的药物毒副作用[6]。目前洛铂在小细胞肺癌、宫颈癌等治疗方面取得显著疗效[7,8],但用于食管癌新辅助治疗的研究报道较少[9~11]。本研究通过对264例局部进展期食管癌患者的临床资料进行回顾性分析,评估洛铂联合紫杉醇在食管癌新辅助化疗中的短期疗效及不良反应,为临床用药选择提供循证医学依据。
1 材料与方法
1.1一般资料选择我院2016年1月~2017 年 12月初诊食管鳞状细胞癌患者264例,常规行超声胃镜、头/胸/腹部CT或MRI、颈部彩超、ECT等检查,进行准确cTNM分期。PS(Performance status)评分0~2分。患者按自愿原则分入观察组(TL)63例与对照组(TP)201例,两组患者性别、年龄、cTNM、PS等一般资料比较差异无统计学意义,见表1。
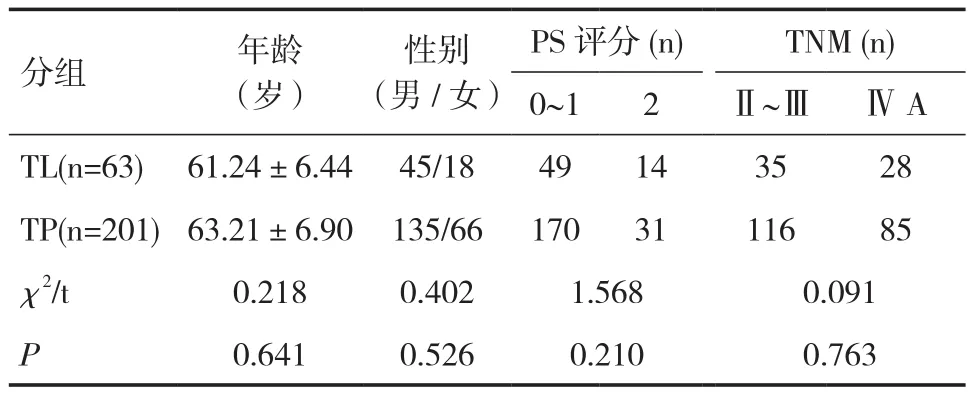
表1 两组患者基本资料比较
1.2治疗方法TL组:紫杉醇135mg/m2,静脉滴注3~4h,d1,全程心电监护;LBP30mg/m2,d2,静脉滴注1~1.5h。21d为1周期。TP组:紫杉醇用法同TL 组;DDP 30mg/m2,d2~4/5,静脉滴注 1~1.5h。21d为1个周期。详细记录新辅助化疗周期内患者骨髓移植、恶心、呕吐及肝、肾功能损伤等不良反应,并对病变进行疗效评价。化疗前均给予地塞米松、苯海拉明、5-HT3受体拮抗剂预防过敏、镇吐治疗。
1.3观察指标化疗2周期后评价近期疗效。疗效采用实体瘤RECIST(response evaluation criteria in solid tumors)标准进行评价[12]:完全缓解(CR):所有目标病灶消失,并至少维持4周;部分缓解(PR):所有(1个或多个)基线目标病灶最长径总和减少≥30%,并至少维持4周;稳定(SD):所有基线目标病灶最长径总和缩小但未达 PR,或增大但未达PD;进展(PD):较已记录到的最小目标病灶最长径总和增大≥20%,或出现1个或多个新病灶。客观缓解率(ORR)=(CR例数+PR例数)/总例数×100%,疾病控制率(DCR)=(PR例数+SD例数)/总例数×100%。每周期评价1次不良反应。不良反应按NCI毒性评价标准分级(0~Ⅳ度) 进行评价,Ⅲ~Ⅳ度为严重不良反应[13]。
1.4统计学方法采用SPSS 19.0统计软件对数据进行分析。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以%表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1两组患者NACT2周期后临床疗效比较两组患者均完成2个周期治疗。TL组ORR为61.9%,DCR为93.7%。TP组ORR为62.2%,DCR为96.0%。两组比较,ORR差异无统计学意义(χ2=0.002,P=0.968),见表 2。
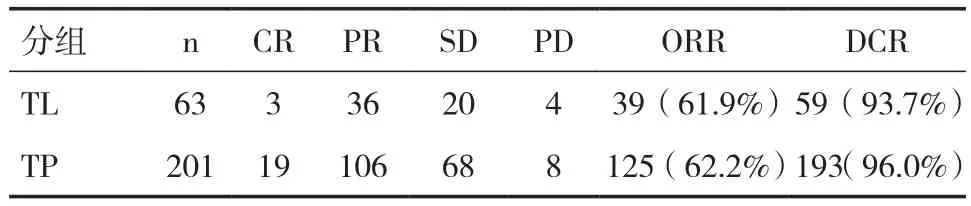
表2 两组患者临床疗效比较(n)
2.2两组患者NACT 2周期后不良反应比较TL组患者均无治疗相关性死亡,TL组在白细胞减少、红细胞减少及肝损伤指标上,与TP组比较无统计学差异(P<0.05),但在血小板减少、肾损伤及恶心/呕吐指标上,TL组优于TP组。TL组主要不良反应为Ⅳ度血小板减少,发生率为3.2%(2/63)。见表3。
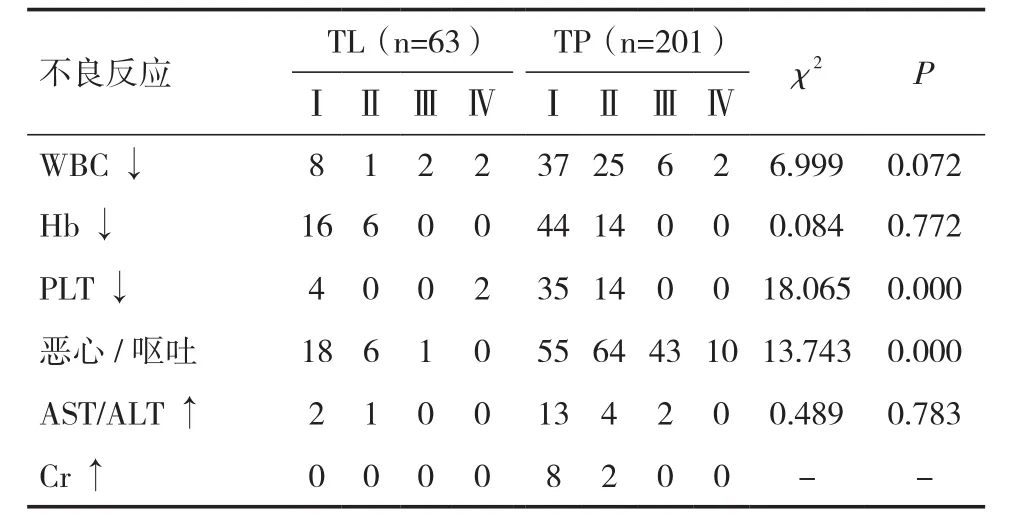
表3 两组患者不良反应比较(n)
3 讨论
我国是世界上食管癌发病率及死亡率最高的国家,对于可切除的局部进展期食管癌(cT3-4aN0-2M0) ,单纯手术5年生存率不足30%[14]。原因在于T3期肿瘤实际R0切除率仅为70%,T4a期更是低于50%,即使完整切除瘤体,T3、T4期食管癌5年生存率也仅为15%~35%[15,16]。因此,为提高食管癌切除率及患者生存率,新辅助治疗在世界范围内得到广泛开展[1,5,17,18],并且在 2012 年被评为十大医学进步。目前研究认为,新辅助治疗能显著降低肿瘤分期[19],增加 R0 切除率[17,20],减少微转移[21],提高生存率[17,22]。新辅助化疗疗效也能为预后判断提供有价值信息[23]。因此,新辅助治疗联合手术被认为是局部进展期食管癌标准治疗模式[1,17]。
食管癌新辅助治疗方案尚无统一标准,化疗仍以含“铂类”的两药联合方案为主,其中顺铂联合5-FU/紫杉醇类抗肿瘤药物是食管癌新辅助化疗常用方案,疗效可靠[5,6]。其中顺铂联合5-FU是国外食管腺癌新辅助化疗最常用方案,但我国食管癌组织学类型90%为鳞状细胞癌,5-FU在鳞状细胞癌患者中能否取得腺癌一致的治疗效果仍存在争议。国内外研究均表明,紫衫醇类化疗药物较5-FU用于食管鳞状细胞癌更具优势[4,23]。顺铂作为上世纪70年代第一代铂类药物,有明显的毒副作用和治疗诱导交叉耐药等缺点,尤其是对于中晚期食管癌患者,常出现严重毒副作用,导致治疗中断,甚至死亡,严重影响了该药物剂量的提高及临床应用广度。因此,探索疗效显著且毒副作用小的新型铂类药物及其为基础的化疗方案成为肿瘤研究热点。
洛铂作为新一代铂类抗癌药物,通过caspase依赖途径诱导细胞凋亡,具有广谱、稳定、活性强的优点。洛铂在体外实验及动物实验中均表现出了较强的抑制食管鳞状细胞癌细胞生长的活性[24,25]。洛铂联合紫杉醇在治疗局部晚期食管癌的临床研究中,与顺铂、奈达铂进行对比,3年生存率无统计学差异,但肾毒性及胃肠毒性显著低于顺铂及奈达铂组[3]。目前洛铂主要作为二线治疗药物用于食管癌术后辅助治疗,作为一线治疗食管癌的疗效及安全性报道较少。目前国内关于洛铂联合紫杉醇一线治疗局部晚期食管癌临床研究中,均显示疗效显著 [9~11]。
化疗前常规使用地塞米松预处理,化疗过程中常规使用5~HT3拮抗剂,TL组患者大多数表现为轻度恶心/呕吐(Ⅰ~Ⅱ级),类似于Li[26]的研究报道。此外,无论是第一或二线化疗方案,均未见肝毒性和肾毒性的报道[10,11,26]。本研究中,只有 3 例患者(4.8%)发现了Ⅰ级肝毒性,没有观察到肾毒性。所有这些温和的非血液学毒性并没有被要求减少治疗剂量,并且能够继续治疗。
综上所述,洛铂用于进展期食管癌新辅助化疗总疗效低于顺铂,但无统计学差异,血小板减少总发生率显著低于顺铂,但出现Ⅳ级血小板减少2例。洛铂组除了肾毒性、消化道不良反应程度轻外,其余指标均未显示出明显优势。洛铂用于食管癌新辅助治疗的有效性及安全性尚需前瞻性、大样本数据进一步证实。
1 Han Tang,Lijie Tan,Yaxing Shen,et al.CMISG1701:a multicenter prospective randomized phase Ⅲ clinical trial comparing neoadjuvant chemoradiotherapy to neoadjuvant chem otherapy followed by minimally invasive esophagectomy in patients with locally advanced resectable esophageal squamous cell carcinoma(cT3-4aN0-1M0)[J]. BMC Cancer,2017,17(1):450
2 中国抗癌协会食管癌专业委员会.食管癌规范化诊治指南[M].北京:中国协和医科大学出版社,2011:99-104
3 Chen J, Su T ,Lin Y, et al. Intens ity-modulated radiotherapy combined with paclitaxel and platinum treatment regimens in locally advanced esophageal squamous cell carcinom a[J]. Clin Transl Oncol,2017,17(4):1-9
4 Sanford NN, Catalano PJ, Enzinger PC , et al. A retrospective comparison of neoadjuvant chemoradiotherapy regimens for locally advanced esophageal cancer[J]. Dis Esophagus,2017,30(7): 1-8
5 傅剑华,杨弘.食管癌术前新辅助治疗原则及循证医学依据[J].中国癌症杂志,2011,21(7): 518-521
6 Hihara J, Hamai Y, Emi M, et al. Role of definitive chemoradiotherapy using docetaxel and 5- fluorouracil in patients with unresectable locally advanced esophageal squamous cell carcinoma:a phase Ⅱ study[J]. Dis Esophagus,2016,29(8):1115-1120
7 石磊,张一桥.洛铂和顺铂分别联合依托泊苷初治小细胞肺癌的临床应用 [J]. 中国肿瘤临床与康复,2016,23(10):1186-1188
8 张晓英, 姜晓春, 张新选,等.紫杉醇联合洛铂新辅助化疗用于局部晚期IB2-IIB期宫颈癌的近期疗效[J].广西医科大学学报,2016,33(1):130-132
9 Chen MQ,Chen C ,Lu HJ,et al. The efficacy and toxicities of combined lobaplatin with paclitaxel as a first-line chemotherapy for advanced esophageal squamous cell carcinoma[J].J Thorac Dis,2015,7(10):1749-1755
10 Chen JQ, Li JC, Zhu KS, et al.The adverse effects of chemotherapy with lobaplatin and paclitaxel in middle and advanced stage esophageal carcinoma[J].China Oncology,2012,22(4):287-290
11 Lin Y, Chen JQ, Li JC, et al. Recent results of concurrent chemoradiotherapy with lobaplatin and paclitaxel in advanced esophageal carcinoma[J].Cancer research and Clinic,2012,24:105-107
12 Eisenhauer EA, Therasse P, Bogaerts J, et al.New response evaluation criteria in s olid tumours: revised RECIST guideline(version 1.1)[J].Eur J cancer,2009,45(2):228-247
13 Trotti A , Colevas AD, Setser A , et al.CTCAE v3.0:development of a comprehens ive grading system for the adverse effects of cancer treatm ent[J].Semin Radiat Oncol, 2003,13(3):176-181
14 Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132
15 Tsukada Y,Higashi T,Shimada H,et al. The use of neoadjuvant therapy for resectable locally advanced thoracic es ophageal squamous cell carcinoma in an analysis of 5016 patients from 305 designated cancer care hos pitals in Japan[J].Clin Oncol,2017,17:1-11
16 Pennathur, A, Gibson, MK, Jobe, BA. et al. Oesophageal carcinoma[J].Lancet,2013,381(9864):400-412
17 Van Hagen P , Hulshof MC, Lanschot JJ, et al. P reoperative chemoradiotherapy for esophageal or junctional cancer[J].N Engl J Med,2012,366(22):2074-2084
18 Shapiro J , van L anschot JJ, Hulshof MC, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial[J].Lancet ncol,2015,16(9):1090-1098
19 Duan X,Yu Z. Neoadjuvant chemoradiotherapy combined with operation vs. operation alone for res ectable esophageal cancer:Meta-analysis on randomized controlled trials[J]. Zhonghua Wei Chang Wai Ke Za Zhi,2017,20(7):809-815
20 Deng HY, Wang WP, Wang YC, et al. Neoadjuvant chemoradiotherapy or chemotherapy? A comprehensive systematic review and meta-analysis of the options for neoadjuvant therapy for treating oesophageal cancer[J].Eur J Cardiothorac Surg, 2017,51(3):421-431
21 Matsuyama J, Doki Y, Yasuda T, et al. The effect of neoadjuvant chemotherapy on lym ph node m icrometastases in squamous cell carcinomas of the thoracic esophag--us[J].Surgery,2007,141(5):570-580
22 Kawai T,Kochi M,Fujii M,et al. Neoadjuvant Chemoradiotherapy for Stage Ⅱ or Ⅲ Esophageal Squamous Cell Carcinoma[J].Anticancer Res,2017,37(6):3301-3306
23 Xi M, Zhang P,Zhang L, et al. Comparing docetaxel plus cisplatin versus fluorouracil plus cisplatin in esophageal squamous cell carcinoma treated with neoadjuvant chemoradiotherapy[J]. Jpn J Clin Oncol,2017,47(8):683-689
24 Du L,Fei Z,Song S,et al. Antitumor activity of lobaplatin against esophageal squamous cell carcinom a through caspasedependent apoptosis and increasing the Bax/Bcl-2 ratio[J].Biomed Pharmacother,2017,95(8):447-452
25 Harstrick A,Vanhoefer U,Heidemann A,et al.Drug interactions of 5-flourouracil with either cisplatin or lobaplatin--a new,clinically active platinum analog in es tablished human cancer cell lines[J].Anticancer Drugs,1997,8(4):391-395
26 Li X, Li Y.Clinical study on chemotherapy of lobaplatin combined with docetaxel in patients with relapsed ovarian cancer[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2014,39(11):1131-1136

