耐多药及广泛耐药MTB菌株对SQ109的耐药性及其与北京基因型的关系
董文竹 王政 文舒安 张婷婷 霍凤敏 董玲玲 李云絮 赵立平 黄海荣 高飞 逄宇
结核病是由结核分枝杆菌(MTB)引起的慢性传染病,主要的治疗方法是依靠抗结核药物进行规范的化疗。但是常用的抗结核药物异烟肼(INH)、利福平(RFP)、吡嗪酰胺(PZA)等已经越来越多地被结核分枝杆菌所耐受。世界卫生组织(WHO)2017年全球结核病报告估算全球新发耐多药结核病(MDR-TB)患者约为49万例,其中,MDR-TB疫情最严重地区是印度、中国及俄罗斯;而其中约有5.6%的患者为广泛耐药结核病(XDR-TB)。治疗MDR-TB及XDR-TB的一个重要途径就是研发新的治疗药物。SQ109作为乙胺丁醇(EMB)类似物中筛选出的抗结核新药,在体外实验中表现出与INH和RFP具有协同作用,并且未见对其他抗结核药物的拮抗作用[1],但是其对MDR-MTB及XDR-MTB临床分离菌株的抑菌效果在我国缺乏进一步研究。因此,笔者选取MDR-MTB及XDR-MTB临床分离株,以微孔板阿尔玛蓝显色法(micro-plate alamar blue assay,MABA)检测菌株对于SQ109的最小抑菌浓度(minimal inhibit concentration,MIC),探究SQ109的体外抑菌效果。
材料和方法
1.菌株:收集首都医科大学附属北京胸科医院2014年7月至2016年12月临床分离培养阳性的MTB菌株。根据WHO建议,将对INH及RFP同时耐药的109株菌株作为MDR菌株;将对INH及RFP同时耐药,对氧氟沙星耐药且对于阿米卡星、卷曲霉素、卡那霉素中的至少1种耐药的114株菌株作为XDR菌株,两种菌株共计223株。本研究中所有耐药菌株均在国家结核病重点实验室以绝对浓度法进行药物敏感性试验(简称“药敏试验”),且通过对硝基苯甲酸(PNB)和噻吩-2-羧酸肼(TCH)进行抑制生长试验鉴定为结核分枝杆菌复合群。
2.试剂仪器:药敏试验所用SQ109、7H9培养基药粉购自美国Sigma公司;中性罗氏培养基购自珠海银科公司;营养添加剂OADC购自美国BD公司;96孔板购自美国Coster公司;阿尔玛蓝购自美国Bio-Rad公司。
3.MABA药敏试验:SQ109的药物终浓度为0.016~16.000 mg/L。将SQ109溶解后,用最高浓度进行2倍梯度稀释,制成含药的96孔板。将选取的菌株接种在中性罗氏培养基上,37 ℃培养4周,刮取新鲜菌落,用磨菌瓶研磨均匀。将菌液稀释至1麦氏单位后再次稀释1/20,加入预先加入药物的96孔板中,每孔100 μl。每株菌株设立1个不含药物的阳性对照孔。加入菌液后37 ℃培养7 d,每孔加入由20 μl 阿尔玛蓝和50 μl 5% Tween-80预混好的显色液,37 ℃培养24 h后进行结果判读。判断标准是孔内液体呈红色为有菌生长,呈蓝色则无菌生长,以最后一个蓝色孔的药物浓度作为MIC值。按照以MIC值为横坐标,菌株数或菌株所占百分比为纵坐标做图,如果呈单峰态分布,流行病学界值(ECOFF值)被定义为能抑制99.9%的细菌群的浓度;对于双峰态分布,ECOFF值则在2个峰值中间[2]。
4.菌株DNA提取:采用煮沸法粗提细菌DNA。刮取一环新鲜菌落到500 μl 三羟甲基氨基甲烷(Tris)-乙二胺四乙酸(EDTA)(TE)缓冲液中,金属浴加热煮沸30 min以裂解细菌。然后,离心半径8 cm,13 000 r/min离心5 min,取含有细菌DNA的上清液放入新的1.5 ml离心管中,作为PCR的DNA模板使用。

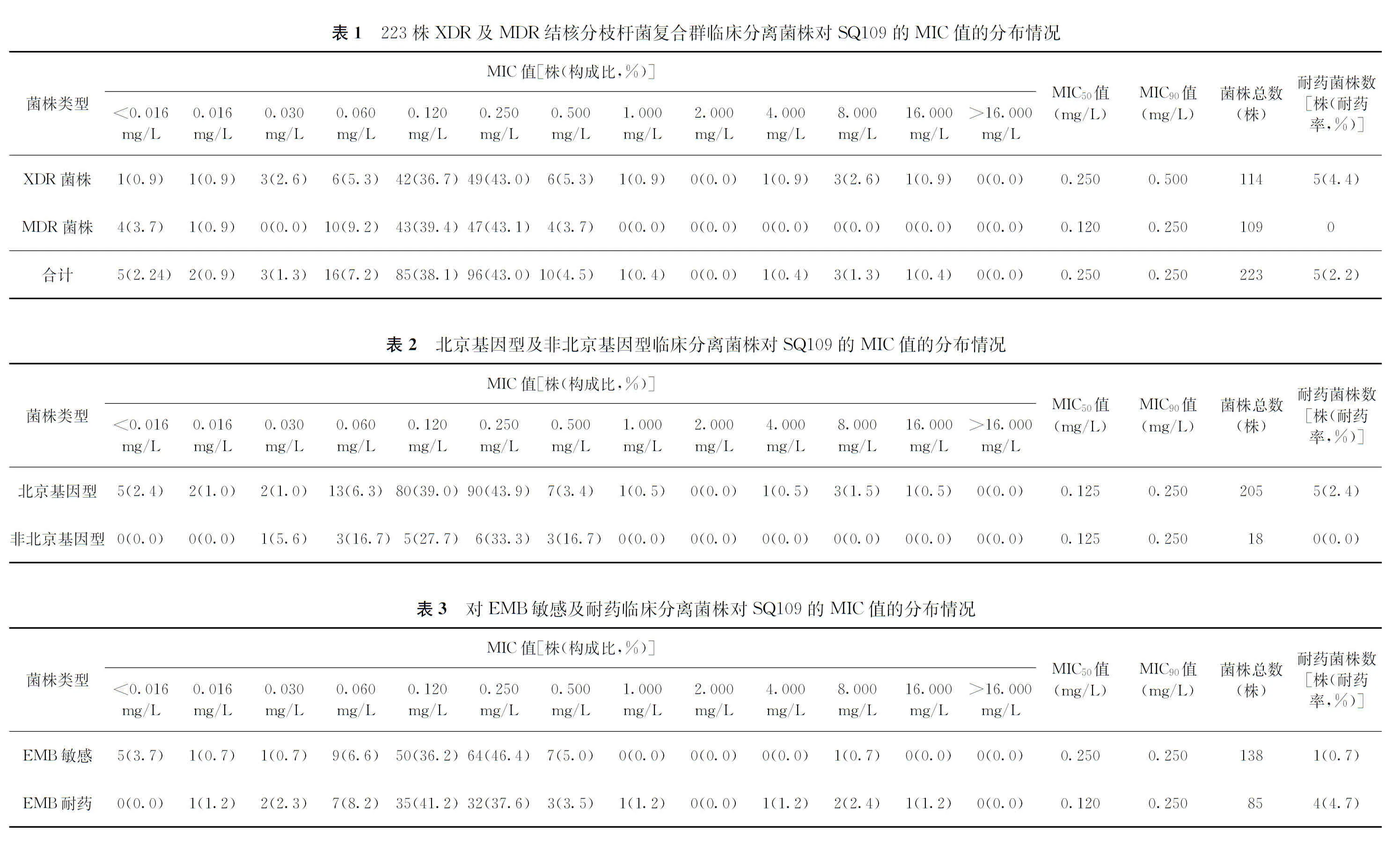
图1 223株XDR和MDR临床分离菌株对SQ109的MIC值频数分布情况
5.北京基因型与非北京基因型菌株的分离:采用RD207基因作为北京基因型和非北京基因型的分离标准,即缺乏RD207基因者为北京基因型,含有RD207基因者为非北京基因型。RD207引物序列为:P1:CATGCGGCGATCTCATTGTT;P2:GCACTGTTACCCGCACTTTC。50 μl的PCR体系按照25 μl 2×PCR混合物,5 μl的DNA模板,各0.2 μl的上下游引物。PCR的扩增条件:94 ℃预变性5 min;94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min。扩增产物采用前述方法进行判读。
6.EMB耐药及敏感菌株的耐药率比较:采用临床罗氏培养及液体药敏试验结果中的EMB耐药情况作为菌株分离标准,将菌株分为EMB耐药菌株和EMB敏感菌株,比较两者对SQ109耐药率的差异。
7.统计学处理:应用SPSS 15.0软件进行分析,计算MDR及XDR菌株、北京基因型及非北京基因型菌株、EMB敏感及耐药菌株对SQ109的耐药率;不同特征菌株耐药率的比较,以及北京基因型和非北京基因型菌株在不同MIC值分布差异的比较均采用Fisher精确概率法检验,以P<0.05为差异有统计学意义。
结 果
1. MIC值检测结果:223株XDR和MDR菌株的MIC值分布在<0.016~16.000 mg/L之间,主要集中在0.120 mg/L(38.1%,85/223)及0.250 mg/L(43.0%,96/223)。根据菌株对SQ109的MIC值频数分布情况,确定ECOFF值为1.000 mg/L(图1)。对SQ109总耐药菌株数为5株,总耐药率为2.2%(5/223)。其MIC值分别为4.000 mg/L(1/5)、8.000 mg/L(3/5)、16.000 mg/L(1/5)。XDR菌株中有5株对SQ109耐药,耐药率为4.4%(5/114);MDR菌株中无耐药菌株,耐药率差异无统计学意义(Fisher精确概率法,P>0.05),见表1。
2.不同基因型分离结果:109株MDR菌株中共分离出8株非北京基因型菌株,114株XDR菌株中共分离出10株非北京基因型菌株。205株北京基因型菌株MIC值范围为<0.016~16.000 mg/L,主要集中在0.120 mg/L(39.0%,80/205)和0.250 mg/L(43.9%,90/205);对SQ109耐药菌株数为5株,耐药率为2.4%。非北京基因型菌株的MIC值范围为0.030~0.500 mg/L,主要集中在0.120 mg/L(27.8%,5/18)和0.250 mg/L(33.3%,6/18);未发现对SQ109耐药菌株。经比较,北京基因型和非北京基因型菌株耐药率的差异无统计学意义(Fisher精确概率法,P>0.05),见表2。
3.EMB敏感及耐药菌株MIC值分布:223株菌株中共有138株EMB敏感菌株和85株EMB耐药菌株。EMB敏感菌株的MIC值范围为<0.016~8.000 mg/L,主要集中在0.120 mg/L(36.2%,50/138)和0.250 mg/L(46.4%,64/138);对SQ109耐药菌株为1株,其MIC值为8.000 mg/L,耐药率为0.7%(1/138)。EMB耐药菌株的MIC值范围为0.016~16.000 mg/L,主要分布于0.120 mg/L(41.2%,35/85)和0.250 mg/L(37.6%,32/85);对SQ109耐药菌株为4株,耐药率为4.7%(4/85)。经比较,EMB敏感和耐药菌株对SQ109耐药率的差异无统计学意义(Fisher精确概率法,P>0.05),见表3。
讨 论
MDR-MTB及XDR-MTB感染已成为全世界结核病治疗的难题。为解决这个难题,新药的研发成为关注的焦点。SQ109是从EMB类似物中筛选出来的具有潜力的新药。该药具有肠道吸收效果好,以及与INH、RFP具有协同作用,并与其他一线抗结核药物无拮抗作用的优点。研究显示,SQ109与RFP联合使用时,在极低浓度下可对超过99%的MTB具有生长抑制作用,且对耐RFP的菌株均有效[1]。这使得SQ109对MDR-MTB及XDR-MTB具有较强的抑菌作用。SQ109的Ⅰ期临床研究显示,其在人体内无论是单一剂量还是多剂量使用时均具有良好的安全性及耐受性;而Ⅱ期临床研究表明,SQ109单一疗法每日剂量为75、150和300 mg或和标准剂量的RFP联合使用时也表现出良好的安全性及耐受性[3-4]。
在本次研究中,XDR菌株对于SQ109的耐药率为4.4%,低于同类试验中的环丝氨酸(22.4%)、利奈唑胺(5.6%)、氯法齐明(5.6%),与德拉马尼(4.4%)、贝达喹啉(3.3%)结果相当[5-6]。显示出SQ109对XDR菌株生长抑制作用较好。这对于目前几乎“无药可治”的XDR-TB具有重要意义。而本次实验中,MDR菌株对SQ109的耐药率和XDR菌株相比,差异无统计学意义,考虑可能由于样本量较少所致,需要进一步扩大样本量进行验证。
ECOFF值是通过药物MIC值估计的药物最佳抑菌浓度,也就是当药物浓度达到ECOFF值时,能够抑制大部分细菌生长。本次研究通过MIC值确定的ECOFF值为1.000 mg/L,即当药物浓度为1.000 mg/L时,可以有效抑制98.2%的菌株的生长,与国外同类研究结果相符[7]。而既往研究显示,对MTB感染小鼠每天口服25 mg/kg的SQ109处理后,其血药浓度峰值为0.135 mg/L。而通过检测口服药物的小鼠组织中的SQ109水平,发现肺部药物浓度最高,其次为脾脏,肺部药物浓度至少可以达到其MIC值的10倍水平,在用药期间可以达到其血药浓度的120倍,可以有效抑制MTB生长;而心脏、脑、血浆中药物浓度较低[8-9]。所以,这个有效药物浓度在小鼠实验中的肺和脾脏中是可以达到的,但是在血浆、心脏、脑等组织中难以达到,也就是说SQ109可能对于肺结核的效果优于心包结核、结核性脑膜炎等肺外结核。而目前在小鼠实验中也证实了SQ109在停止给药后药效仍能延续10~15 d[10]。这对于降低药物口服频率,简化治疗方案较为有利。但是,目前缺乏SQ109在人体中药物浓度的研究数据,所以此ECOFF值还需要根据人体血药浓度及组织中药物浓度进行验证。
在223株XDR及MDR结核分枝杆菌复合群临床分离菌株中,实验分离出205株北京基因型菌株。研究发现,在俄罗斯、越南、伊朗、爱沙尼亚、美国纽约等地区,北京基因型菌株与对药物的耐药率间存在明显相关性,但是在印度尼西亚、阿塞拜疆、哥伦比亚等地区,北京基因型菌株和非北京基因型菌株在耐药率方面的差异无统计学意义[5];中国香港地区北京基因型分离株的耐药率低于非北京基因分离株[5]。说明北京基因型菌株和耐药率相关情况可能具有地区差异性。在对环丝氨酸、对氨基水杨酸药物的研究中显示,北京基因型和非北京基因型菌株耐药率差异无统计学意义[5];但是在对RFP研究中显示,两者差异具有统计学意义[11],说明北京基因型菌株和耐药率的相关情况也可能受到药物类型及使用情况的影响。本次研究显示SQ109的耐药情况可能与北京基因型无关。但是,本次研究中非北京基因型菌株仅为18株,样本量较少,因此,有待扩大样本量做进一步研究。SQ109作为EMB的类似物,是否和EMB形成交叉耐药也是临床用药的一个考虑要点。本次研究中,通过对MDR和XDR菌株中EMB敏感菌株和耐药菌株的分离对比发现,EMB敏感和耐药的菌株对SQ109的耐药率差异无统计学意义。
最后,本研究仅对SQ109的体外抑菌情况进行了分析讨论,在研究中出现的5株SQ109耐药菌株的耐药机制尚不明确,需要进一步做试验验证。
[1] Chen P, Gearhart J, Protopopova M, et al. Synergistic intera-ctions of SQ109, a new ethylene diamine, with front-line antitubercular drugs in vitro. J Antimicrob Chemother, 2006, 58(2): 332-337.
[2] Pang Y, Zheng H, Tan Y, et al. In vitro activity of bedaquiline against nontuberculous Mycobacteria in China. Antimicrob Agents Chemother, 2017, 61(5).pii: e02627-16.
[3] Sacksteder KA, Protopopova M, Barry CE 3rd, et al. Disco-very and development of SQ109: a new antitubercular drug with a novel mechanism of action. Future Microbiol, 2012, 7(7): 823-837.
[4] 中国防痨协会临床专业委员会. 结核病临床诊治进展年度报告(2012年)(第二部分结核病临床治疗). 中国防痨杂志, 2013,35(7): 488-510.
[5] 杨健, 逄宇, 赵雁林, 等. 耐多药结核分枝杆菌对环丝氨酸、对氨基水杨酸的耐药性及其与基因型关系分析. 中国防痨杂志, 2015, 37(2): 122-127.
[6] Pang Y, Zong Z, Huo F, et al. In vitro drug susceptibility of bedaquiline, delamanid, linezolid, clofazimine, moxifloxacin, and gatifloxacin against extensively drug-resistant tuberculosis in Beijing, China. Antimicrob Agents Chemother, 2017, 61(10).pii: e00900-17.
[7] de Knegt GJ, van der Meijden A, de Vogel CP, et al. Activity of moxifloxacin and linezolid againstMycobacteriumtuberculosisin combination with potentiator drugs verapamil, timcodar, colistin and SQ109. Int J Antimicrob Agents, 2017, 49(3): 302-307.
[8] Jia L, Tomaszewski JE, Hanrahan C,et al. Pharmacodyna-mics and pharmacokinetics of SQ109, a new diamine-based antitubercular drug. Br J Pharmacol, 2005, 144(1): 80-87.
[9] Jia L, Noker PE, Coward L, et al. Interspecies pharmacokinetics and in vitro metabolism of SQ109. Br J Pharmacol, 2006, 147(5): 476-485.
[10] Bogatcheva E, Hanrahan C, Nikonenko B, et al. Identification of SQ609 as a lead compound from a library of dipiperidines. Bioorg Med Chem Lett, 2011, 21(18): 5353-5357.
[11] 王胜芬, 赵雁林, 黄海荣, 等. 结核分枝杆菌北京基因型菌株与耐药表型的关系. 中国医学科学院学报, 2009, 31(4): 427-431.

