化脓性革兰阴性杆菌性脊柱炎患者的手术治疗效果分析(附13例报告)
严广璇 秦世炳 兰汀隆 董伟杰 范俊
伴随着老龄化社会的到来,糖尿病、慢性感染性疾病等呈现出高发的趋势,加之免疫抑制剂、抗生素长期广泛不规范的应用等高危因素的增加,化脓性脊柱炎的发病率也呈现出逐年上升的趋势[1],但其中关于化脓性革兰阴性杆菌性脊柱炎(Gram-negative bacterial vertebral osteomyelitis,GNB VO)的相关研究还较少。笔者通过回顾首都医科大学附属北京胸科医院收治的化脓性GNB VO行手术治疗患者的临床资料,归纳其临床特点并评价治疗效果。
资料和方法
一、 研究对象
1. 一般资料:收集2007年1月至2016年12月首都医科大学附属北京胸科医院收治的、有微生物学证据、诊断为化脓性GNB VO并行手术治疗的13例患者的临床资料。其中男7例,女6例;年龄33~79岁,平均(61.1±13.3)岁,病程4~40周,平均(14.5±9.2)周。13例化脓性GNB VO患者均有感染史或高危感染因素(高龄、并发糖尿病、其他慢性感染、长期使用抗生素、免疫抑制剂等);其中大肠埃希菌感染9例,肺炎克雷伯杆菌2例,铜绿假单胞菌1例,阴沟肠杆菌1例。患者首诊症状除1例患者为截瘫外,其余均为不同程度的腰背痛或颈项痛伴活动受限。8例患者入院时体温均≥38.5 ℃。发病节段为腰椎(L)8例,胸椎(T)4例,颈椎(C)1例。术前窦道或者脓肿穿刺培养阳性患者共6例,其中大肠埃希菌4例,肺炎克雷伯杆菌2例;术中标本送检培养阳性6例,其中大肠埃希菌3例,肺炎克雷伯杆菌1例,铜绿假单胞菌1例,阴沟肠杆菌1例;既往或入院后血培养阳性3例,其中大肠埃希菌2例,肺炎克雷伯杆菌1例;包含1例既往血培养、术前窦道培养及术后标本培养均提示肺炎克雷伯杆菌感染者。具体见表1。对手术前后痛觉视觉模拟评分(visual analogue scale score,VAS)、白细胞计数(WBC)、中性粒细胞比率、血红细胞沉降率(ESR)、C-反应蛋白(CRP)等水平进行比较,同时观察末次随访(第12个月末)时术后患者病椎的骨性融合、治愈等情况。见表1。
2.手术方案:13例GNB VO患者采取手术方式如下,(1)腰椎感染8例:7例行后路内固定+腰椎病灶清除+植骨融合术;1例因腰椎骨质缺损严重、双侧腰大肌脓肿区域大,给予一期后路腰椎内固定术,二期行右侧腹膜外腰椎病灶清除+髂骨取骨植骨融合术+左侧腹膜外腰大肌脓肿清除术。(2)胸椎感染4例:均行后路内固定+胸椎病灶清除+植骨融合术。(3)颈椎感染1例:行颈椎前路病灶清除+椎体次全切除+髂骨取骨植骨+钛板内固定术。见表1。
3.选取标准:(1)临床表现主要为腰背痛或者颈项痛等症状;(2)影像学检查提示椎体炎、椎间隙感染、硬膜外脓肿、椎旁或者腰大肌脓肿等;(3)有明确的血培养结果,或者病灶、脓肿穿刺标本培养,或手术标本培养提示化脓性革兰阴性杆菌感染;(4)完整的临床资料;(5)应用敏感抗生素联合手术治疗者。
4.排除标准:(1)脊柱术后感染可疑为医原性所致;(2)脊柱结核、布鲁杆菌病等特异性病原菌感染;(3)培养阴性,无明确微生物学证据的患者。
二、研究方法
1.微生物学检查方法:术前或术中进行采样送检。脓肿直径超过2 cm的患者,采用B超或CT定位下穿刺置管引流,脓液送检细菌培养;术前出现菌血症的患者,尽早、多次抽取脓液行血培养;并发窦道的患者,应反复多次留取窦道深部标本送检细菌培养,以期尽早获取微生物学证据。
2.药物敏感性试验(简称“药敏试验”)方法:采用全自动细菌鉴定/药敏检测系统,直接测定药物对受试菌的最低抑菌浓度(MIC)。
3.手术适应证:患者入院后绝对卧床休息,请营养医师会诊后加强营养,提高蛋白质摄入水平,监控血糖水平及各项实验室检查指标。对椎体骨质破坏明显,伴脊柱不稳定、严重畸形者,以及伴有脊髓、神经根性刺激进行性加重者,经敏感抗生素抗感染治疗后坏死病灶组织吸收困难者,中重度疼痛、保守治疗不满意、影响生活质量者[1-2],血糖水平稳定在空腹时5~8 mmol/L、餐后2 h 时8~10 mmol/L者,炎症指标呈明显下降趋势者行手术治疗。
4.手术治疗方式:手术入路采用后路、后前路联合,以及前路入路方式。
5.抗感染治疗原则:术前经静脉应用敏感抗生素治疗不少于2周,监测炎症指标呈明显下降趋势后行手术治疗。术后依据药敏试验结果给予针对性经静脉点滴敏感抗生素行抗感染治疗6~8周;围手术期内格外注意患者饮食及排便情况,为防止发生抗生素相关性腹泻,可预防性给予肠道益生菌。监测患者体温、WBC计数、中性粒细胞比率、ESR及CRP水平的变化情况,若控制不佳可延长抗生素使用时间。待患者体温正常,每日引流液少于20 ml,刀口愈合,炎症指标ESR、CRP较前呈下降趋势,WBC计数及中性粒细胞比率正常后可出院。出院后再继续口服抗生素6~8周,每2周监测炎症指标控制情况,继续完成12个月随访。
6.手术效果观察指标:(1)VAS评分标准:0分为无痛;1~3分为轻度疼痛;4~6分为中度疼痛;7~10分为重度疼痛。(2)植骨融合情况判读标准:脊柱X线摄影检查提示植骨处有连续的骨小梁,植骨处椎间高度维持不变[1-2]。(3)WBC、中性粒细胞、ESR、CRP指标的改善情况。
7.随访情况:术后门诊随访12个月,第1~3个月每2周进行1次血常规、肝肾功能、ESR、CRP复查,每个月进行1次X线摄影及CT复查,并发腰大肌脓肿者还需采用B型超声对腰大肌进行复查;第6、9、12个月末再次对上述项目进行复查。评估患者末次随访时VAS评分,观察植骨融合情况。
三、统计学处理
结 果
1.手术前与末次随访时各观察指标改变情况:13例GNB VO患者术前VAS评分、WBC计数、中性粒细胞比率、ESR、CRP平均水平均较末次随访时明显降低,差异均有统计学意义(P值均<0.05)。具体见表2。
2.植骨融合情况:13例患者在第12个月末随访时均达到骨性融合。
3.治疗转归:1例胸椎节段及1例颈椎节段患者治疗过程中出现不全截瘫症状,2例腰椎节段患者出现马尾神经损伤,围手术期给予营养神经、功能锻炼的方式,不全截瘫症状均获临床治愈。13例GNB VO患者经敏感抗生素抗感染12~16周联合手术治疗后均治愈。其中1例肺炎克雷伯杆菌感染患者术后2周因刀口破溃,复查细菌培养提示莫西沙星术前敏感,术后出现耐药,按照药敏试验结果给予敏感抗生素美罗培南联合阿米卡星进行抗感染治疗,同时行3次负压封闭引流后,刀口延期愈合。全部患者随访12个月无复发,均获得临床治愈。
4.典型患者介绍:患者,男,79岁(表1中编号3)。因背痛伴间断高热3个月,加重伴活动受限1个月入院。患者5个月前因急性胆原性胰腺炎于当地重症监护病房(ICU)治疗,血培养提示大肠埃希菌感染。入我院后行胸椎侧位X线摄影及术前胸椎CT重建(图1,2),可见T10、11椎体骨质破坏、缺损,椎间隙狭窄,伴后凸畸形及慢性感染形成的椎前骨赘;胸椎MRI(图3)显示T10、11椎体呈高信号,提示感染性病变。术前主要诊断为化脓性脊柱炎(T10、11)、2型糖尿病、慢性胆囊炎。依据药敏试验结果给予头孢米诺联合左氧氟沙星行抗感染治疗2周后,符合手术指征,行后路T10、11病灶清除+植骨融合+内固定术。术后标本细菌培养结果为大肠埃希菌,给予头孢吡肟联合左氧氟沙星行抗感染治疗2周,出院后继续口服左氧氟沙星8周。术后1个月复查胸椎侧位X线及胸椎CT重建(图4,5),可见T10、11骨质缺损区被植骨材料充分填充,内固定位置满意,后凸畸形得到纠正;术后1年随访时,胸椎侧位X线摄影可见骨性融合,内固定位置满意(图6)。
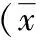
表2 术前与末次随访时VAS评分、WBC、中性粒细胞比率、ESR、CRP变化情况±s)
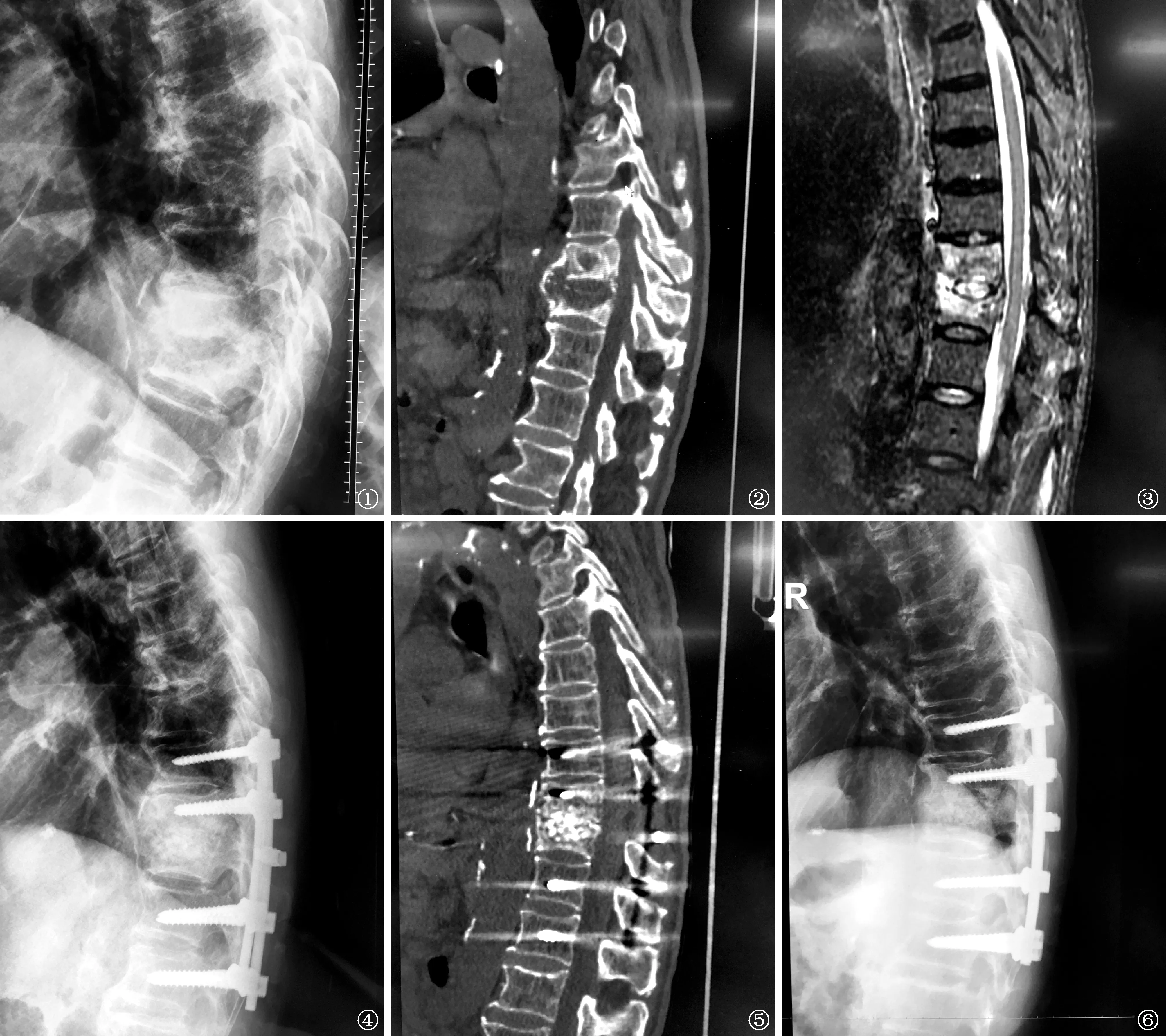
图1~6 患者,男,79岁,化脓性脊柱炎(T10、11)。图1,2为术前胸椎侧位X线摄影及术前胸椎CT重建,可见T10、11椎体骨质破坏、缺损,椎间隙狭窄,伴后凸畸形及慢性感染形成的椎前骨赘。图3为术前胸椎MRI,显示T10、11椎体高信号,提示感染性病变。图4,5为术后1个月胸椎侧位X线摄影及胸椎CT重建,可见T10、11骨质缺损区被植骨材料充分填充,内固定位置满意,后凸畸形得到纠正。图6为术后1年随访时胸椎侧位X线摄影,可见骨性融合、内固定位置满意
讨 论
一、GNB VO的流行特点及感染机制
GNB VO的发病率在化脓性脊柱炎中占10.5%~39.0%[2],由于革兰阴性杆菌致病机理与革兰阳性球菌不同,其流行病学特点、临床症状、影像学表现及治疗有其独特之处[2-4]。革兰阴性杆菌主要靠内毒素致病,可导致微循环障碍、感染性休克等,毒性成分包含类脂质A、多种细胞因子、炎症介质、心血管调节肽等。类脂质A可引起发热、微循环障碍、内毒素性休克及弥散性血管内凝血,其穿透性及定殖力强[2-3],但不易溶解细胞膜、血管及结缔组织,故影像学上表现为软组织水肿、脓肿形成。常见的革兰阴性杆菌为大肠埃希菌、铜绿假单胞菌、肺炎杆菌、变形奇异杆菌等[2,4]。其中,大肠埃希菌是引发泌尿系感染最常见的细菌,也是化脓性GNB VO最常见的细菌[1-4]。本研究患者中均有既往革兰阴性杆菌的相关感染史,对于疾病的诊断有借鉴作用,提示应详细收集患者疾病史,有助于快速诊断疾病。
二、高危因素
化脓性脊柱炎的常见高危因素有高龄、糖尿病、其他部位感染、长期应用免疫抑制剂、恶性肿瘤、慢性肝肾功能不全等[2-5],高龄是目前化脓性脊柱炎的重要高危因素。本项研究中13例患者的平均年龄为(61.1±13.3)岁,10例患者并发糖尿病,提示糖尿病是引起化脓性GNB VO的重要因素,可能与以下原因有关:(1)高血糖微环境提供了有利于细菌繁殖的培养基;(2)糖尿病可引起微血管病变,造成微循环、组织血供不良,导致抵抗感染的能力差;(3)糖尿病可导致神经-内分泌系统紊乱,造成机体免疫调节失衡[2]。本研究中3例并发泌尿系感染,3例并发肺部感染,可能与细菌可经血液途径传播至脊柱椎体有关;5例并发盆腹腔感染,可能与腹部动、静脉在腹压增大时可快速播散细菌,终板、椎体的感染多源自静脉丛内的播散有关。
三、GNB VO的诊断方法
细菌培养是诊断GNB VO的金标准[1,6],不仅诊断明确,还可提供细菌学依据及药敏试验结果,指导临床医生实施针对性的抗感染治疗。故建议利用穿刺活检、脓肿培养、血液培养、窦道分泌物培养、手术标本培养等技术手段相结合的方式提高细菌标本送检率,提高诊断阳性率。其中穿刺是获得标本的最好手段,但要注意穿刺时机的选择。笔者建议临床中发现可行穿刺的病灶时,应尽早穿刺送检,减少经验性抗生素应用后对优势菌的影响,提高诊断阳性率;防止标本污染,做好质量控制,避免误诊。如果不能取得深部组织标本,可能因窦道暴露在外引起继发性条件性致病菌感染,而误诊为化脓性脊柱炎。
四、GNB VO的治疗
1.抗感染治疗:应用敏感抗生素是GNB VO的首选治疗手段。由于革兰阴性菌定殖力强,故必须予以敏感、足量、全程的治疗[7-8]。可依据病灶区标本的培养及药敏试验结果选择敏感抗生素,进行针对性抗感染治疗,以达到控制病情的目的。但在临床中会遇到部分患者多次培养结果均为阴性,或就诊时全身症状重,在等待药敏试验结果的过程中往往已错过最佳治疗时间,故建议可尽早给予经验性抗感染治疗。可参考当前当地感染性疾病的细菌谱、或并发其他部位感染的代表性细菌谱进行不少于12~16周的经验性抗感染治疗。但需要注意的是,经验性抗感染治疗并不一定能够达到控制病情的目的,比如治疗化脓性脊柱炎常用的万古霉素、克林霉素等不能完全覆盖革兰阴性杆菌,可能会导致感染进展,可采用万古霉素联合氟喹诺酮类药物,兼顾革兰阳性球菌及革兰阴性杆菌。所以临床中需要提高对化脓性脊柱炎的认识,监测WBC、CRP、ESR等炎性指标,尽早应用敏感抗生素、必要时联合应用,将对感染控制起到决定性作用。根据本研究经验,采用氟喹诺酮类、三代或者四代头孢菌素类、碳青霉烯类抗生素对革兰阴性杆菌有良好的治疗效果。
对于围手术期抗感染治疗方案,笔者建议术前不少于2周经静脉应用敏感抗生素治疗,监测炎症指标呈明显下降趋势后行手术治疗,如无法获得药敏试验结果,可联合用药兼顾革兰阳性球菌及革兰阴性杆菌。术后综合观察患者体温、炎症指标、刀口情况、引流液性状,结合手术前后细菌培养结果,予以抗感染治疗。因手术创伤大、时间长,及内固定植入物的存在,在围手术期应给予静脉广谱抗生素联用。围手术期及术后经静脉抗生素应用的时间不少于6~8周,待患者体温正常,引流管无明显引流液排出,刀口愈合,炎症指标复查正常后出院。出院后继续不少于6~8周口服敏感抗生素进行抗感染治疗,门诊每2周采血观察炎症指标控制情况。指标正常后持续治疗4周无反弹,可予停用口服抗生素治疗,并且继续完成12个月的随访。
2.手术治疗:虽然多数患者通过敏感抗生素治疗后有效,但对于并发脊柱不稳定、神经功能障碍、死骨或脓肿吸收不良、治疗效果差的患者,建议采用手术治疗[9]。手术时机的选择主要从抗感染治疗效果及脊髓神经症状两方面综合考虑[9-10]。化脓性脊柱炎所致的截瘫多由软性致压物压迫脊髓引起,多为不全截瘫,术后神经功能多能恢复[11],故建议术前务必首先经敏感抗生素治疗,待炎症指标下降、体温有效控制后,再考虑行手术治疗。若抗感染治疗后脓肿吸收困难,体温控制不满意,则建议术前置管引流,可减少脓肿负荷、利于病情控制、节省手术时间、降低手术难度[12-13];既不易出现细菌播散、病情难以控制,又不会造成脊髓神经功能严重损伤[14]。
手术方式与脊柱结核类似,常用手术入路为后路、后前路联合、前路入路[10,15],其中每种入路均有各自优势及弊端。但化脓性脊柱炎的病原菌增殖迅速,全身症状及软组织粘连较脊柱结核严重,前路手术的选取较为慎重,多数患者倾向于后路手术治疗[16]。后路手术广泛应用于脊柱外科,技术成熟、规范、可靠,可获得良好的脊柱稳定性,但因采用非直视下病灶清除、植骨,可能病灶清除较为局限,同时椎管内感染风险增加;且后路椎板切除后,一旦感染控制不满意,由于椎管后方无遮挡,如果导致化脓性细菌增殖、继发大量炎性物质渗出,将引起后路刀口内积液、积脓[16]。本研究中有11例患者采取后路手术治疗,其中1例L3~S1肺炎克雷伯杆菌感染患者,术后2周出现刀口破溃,脓性积液;标本再次送检培养后提示术前对细菌敏感的头孢吡肟出现耐药,联合会诊后调整抗感染方案为美罗培南联合阿米卡星,并且行3次负压封闭引流治疗后刀口愈合,该患者术后静脉应用抗生素疗程共10周。后、前路联合手术,融合了单纯前路及后路的利弊,既能达到病灶充分清除、引流、植骨的目的,又能最大程度地稳定脊柱,避免后路内固定刀口的不良事件,但依然存在手术创伤大、手术时间长的弊端[15-17]。本研究中1例患者采取一期后路内固定,二期前路病灶清除、植骨融合手术方案。前路手术直视下清除病灶组织,引流充分,不破坏后柱稳定性,但是创伤较大、软组织粘连重,不适用于高龄患者,本研究中患者平均年龄高,故对胸腰椎感染患者并未采取单纯前路手术治疗。
本研究为回顾性分析,受限于患者例数过少,围手术期抗感染治疗规范仍需进一步扩大样本量验证及归纳。综上所述,GNB VO患者经过敏感抗生素联合手术治疗可达到骨性融合的治愈目的。
[1] Graham SM, Fishlock A, Millner P, et al. The management Gram-negative bacterial hematogenous vrtebral osteomyelitis: a case series of diagnosis, treatment and therapeutic outcomes. Eur Spine J,2013,22(8):1845-1853.
[2] 李永贤,张顺聪,莫凌,等.化脓性脊柱炎的诊疗研究进展.脊柱外科杂志,2016,14(5):316-320.
[3] Kang SJ, Jang HC, Jung SI, et al. Clinical characteristics and risk factors of pyogenic spondylitis caused by Gram-negative bacteria. PLoS One,2015,10(5):e0127126.
[4] Kasliwal MK1,Tan LA,Traynelis VC.Infection with spinal instrumentation: Review of pathogenesis, diagnosis, prevention, and management.Surg Neurol Int,2013,4 Suppl 5: S392-403.
[5] Marschall J,Bhavan KP,Olsen MA,et al. The impact of prebio-psy antibiotics on pathogen recovery in hematogenous vertebral osteomyelitis.Clin Infect Dis,2011, 52(7): 867-872.
[6] 徐仲阳.革兰阴性菌化脓性脊柱炎的临床特点及治疗效果分析.中华实验和临床感染病杂志(电子版),2015,9(5):685-688.
[7] Duarte RM,Vaccaro AR. Spinal infection: state of the art and management algorithm. Eur Spine J,2013, 22(12): 2787-2799.
[8] Lee KY.Comparison of pyogenic spondylitis and tuberculous spondylitis. Asian Spine J,2014, 8(2): 216-223.
[9] 崔云鹏,米川,施学东,等.培养阴性化脓性脊柱炎患者的临床特征及预后.北京大学学报(医学版), 2017, 49(2):19-23.
[10] Kwon JW, Hyun SJ, Han SH,et al. Pyogenic Vertebral Osteo-myelitis: Clinical Features, Diagnosis, and Treatment.Korean J Spine,2017, 14(2): 27-34.
[11] Lee CY, Wu MH, Cheng CC, et al. Comparison of Gram-nega-tive and Gram-positive hematogenous pyogenic spondylodiscitis: clinical characteristics and outcomes of treatment.BMC Infec Dis, 2016, 16(1):735.
[12] Tschugg A, Lener S, Hartmann S, et al. Primary acquired spondylodiscitis shows a more severe course than spondylodiscitis following spine surgery: a single-center retrospective study of 159 cases.Neurosurg Rev, 2018, 41(1): 141-147.
[13] Sheikh AF, Khosravi AD, Goodarzi H, et al.Pathogen Identification in Suspected Cases of Pyogenic Spondylodiscitis. Front Cell Infect Microbiol, 2017, 7: 60.
[14] Tamma PD, Cosgrove SE, Maragakis LL. Combination therapy for treatment of infections with Gram-negative bacteria. Clin Microbiol Rev,2012, 25(3): 450-470.
[15] 刘洪,Hirokazu Ishihara,马忠泰,等.一期前路病灶清除加植骨术治疗化脓性脊椎炎.中华骨科杂志,2005,25(11):700-701.
[16] 甫拉提·买买提, 盛伟斌, 郭海龙, 等. 腰椎化脓性脊柱炎的手术治疗. 中国修复重建外科杂志,2012,26(7):786-789.
[17] Menon VK, Kumar KM, Ghafri KA. One-stage biopsy, debridement, reconstruction, and stabilization of pyogenic vertebral osteomyelitis. Global Spine J, 2014, 4(2): 93-100.

