血清维生素D水平与2型糖尿病周围神经病变的关系
糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)是糖尿病患者常见的慢性并发症之一,在2型糖尿病(type 2 diabetes mellitus, T2DM)患者中,其发病率高达30%~70%,主要表现为肢体末端麻木不适、感觉减退,是糖尿病患者晚期致残的主要原因,严重影响患者生命质量。维生素D是一种类固醇激素,主要以25羟维生素D[25-hydroxyvitamin D, 25(OH)D] 的形式储存在血液中,维生素 D 受体(vitamin D receptor, VDR)广泛分布于视网膜、肾脏、神经等组织器官中。研究[1]发现,维生素D不仅能调节骨代谢,而且与肿瘤、心血管疾病、代谢综合征等密切相关。目前,国内外已陆续开展关于维生素D与糖尿病关系的研究,但关于维生素D与糖尿病并发症尤其神经病变关系的研究尚少,本文就血清维生素D与DPN的关系进行探讨,以期研究周围神经病变的发病机理及诊治思路。
1 资料与方法
1.1 一般资料 选择2016年1月至2017年4月安徽省立医院内分泌科住院的T2DM患者128例,所有患者均符合1999年WHO关于T2DM的诊断标准[2],按照有无并发症,分为无周围神经病变组(NDPN组)和合并周围神经病变组(DPN组),其中,DPN组78例(男性49例,女性29例),NDPN组50例(男性31例,女性19例)。DPN的诊断依据《糖尿病周围神经病诊断和治疗共识》[3],即有明确的糖尿病病史,存在周围神经病变的临床和/或神经电生理的证据,排除导致周围神经病变的其他原因。排除标准:①合并糖尿病急性并发症;②严重的周围血管病变;③肝肾功能不全;④恶性肿瘤;⑤甲状旁腺疾病;⑥严重的骨质疏松;⑦非糖尿病引起的神经病变。
1.2 方法 记录每位患者的糖尿病病史、年龄、吸烟史,测量身高、体质量、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP),计算体质指数(body mass index, BMI)。抽取肘静脉血8 mL,分离血清后,采用全自动生化分析仪测定空腹血糖(fasting plasma glucose, FPG)、碱性磷酸酶(alkaline phosphatase, ALP)、血钙(calcium, Ca)、血磷(phosphorus, P)、总胆固醇(total cholesterol , TC)、三酰甘油(Ttriglyceride, TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)及低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)的水平。采用高效液相色谱法检测糖化血红蛋白(hemoglobin A1c, HbA1c)。电化学发光法检测血清25 (OH)D水平,其中,25 (OH)D水平<20 ng/mL为维生素D缺乏;20~30 ng/mL为不足;≥30 ng/mL为充足。采用keypoint G4型肌电图诱发电位仪(丹麦DANTEC公司)检测神经传导速度(nerve conduction velocity, NCV),分别测定尺神经、桡神经、正中神经、胫神经及腓总神经的运动神经传导速度和尺神经、桡神经、正中神经及腓肠神经的感觉神经传导速度,根据相应正常值对照表评估神经传导速度。
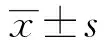
2 结果
2.1 一般资料比较 与NDPN组相比,DPN组患者的病程较长,HbA1c、LDL-c、TC及吸烟率较高,25(OH)D水平降低,差异均有统计学意义(P<0.05);其余指标差异均无统计学意义(P>0.05)。详见表1。

表1 一般资料比较
2.2 两组患者25(OH)D缺乏情况比较 与NDPN组比较,DPN组患者25(OH)D水平缺乏的患者比例较高,差异有统计学意义(Z=-3.180,P=0.001)。详见表2。

表2 两组患者25(OH)D缺乏情况比较[例(%)]
2.3 25(OH)D水平与其他指标的相关性 25(OH)D水平与病程(r=-0.432,P<0.001)、HbA1c(r=-0.467,P<0.001)、LDL-C(r=-0.439,P<0.001)呈负相关,与其余指标无相关性。详见表3、图1~3。

表3 25(OH)D与各个指标的相关性分析(n=128)

续表3

图1 25 (OH)D与病程的相关性分析

图2 25 (OH)D与HbA1c的相关性分析

图3 25 (OH)D与LDL-C的相关性分析
2.4 logistic回归分析 以是否合并DPN为因变量,单因素分析有差异的指标作为自变量进行logistic回归分析,25(OH)D水平及病程是糖尿病周围神经病变的影响因素。详见表4。

表4 多因素logistic回归分析
3 讨论
目前,DPN的病因及发病机制尚不明确,普遍认为是在糖代谢紊乱的基础上,由多因素共同作用的结果,包括氧自由基损失、血管自身免疫、微循环障碍、多元醇旁路的激活及神经营养因子缺乏等[4]。DPN是糖尿病常见的并发症之一,糖尿病病程达10年以上,其发病率可超过50%,因此,早期筛查、诊断、制定预防和治疗措施对于延缓周围神经病变的发生具有至关重要的作用。
研究[5-6]表明,维生素D不仅能调节钙磷代谢,还与胰岛素抵抗、血糖水平相关。有研究[7]显示,T2DM患者维生素D水平较正常人群低,维生素D 缺乏可能导致胰岛素分泌减少,并进一步加重T2DM患者的胰岛素抵抗程度。目前,关于维生素D与周围神经并发症关系的研究较少,血清25(OH)D 水平<30 ng/mL的糖尿病患者发生DPN的风险增加,25(OH)D水平与循环中的炎症因子IL-7、IL-13呈负相关[8]。补充维生素D可以提高血清25(OH)D水平,改善T2DM患者周围神经病变的神经损伤程度[9]。Alamdari等[10]研究发现,糖尿病周围神经病变患者的血清25(OH)D水平明显降低,低水平的25(OH)D与糖尿病神经感觉异常相关。本研究DPN组中,82.1%的患者25(OH)D水平缺乏,NDPN组则为56%,T2DM患者25(OH)D水平与HbA1c、病程及LDL-c呈负相关,且25(OH)D水平是DPN发生的独立预测因子,提示25(OH)D水平缺乏可能参与了周围神经病变的发生,与血糖控制程度、糖尿病病程及脂质紊乱有关,具体维生素D水平影响糖尿病神经病变的机制目前还不是很明确,可能有以下几个方面:①维生素D通过与分布在外周神经的受体相结合,可调节神经生长[11],维生素D缺乏导致神经生长因子水平降低,进而抑制神经感受器功能、减缓神经细胞修复,最终导致并加重DPN的发生;②25(OH)D水平缺乏导致甲状旁腺激素水平增高,从而增加脂肪细胞内脂质生成,同时,25(OH)D作用于维生素D受体(vitamin D receptor, VDR),能够抑制脂肪细胞分化,最终通过动脉粥样硬化的脂代谢紊乱机制促进DPN 发生[12];③糖尿病患者体内存在炎症因子的升高和糖基化终末产物的堆积,25(OH)D缺乏可能会导致血管慢性炎症[13],最终通过加速炎症反应和氧化应激损伤导致神经缺血及DPN的发生;④维生素D直接或间接影响胰岛素分泌,改善胰岛素敏感性,维生素D缺乏能够抑制胰岛素释放,升高血糖,使醛糖还原酶的活性增大,山梨醇旁路更为活跃,最终由于细胞中山梨醇的渗透压变大而引发DPN[14]。此外,缺乏维生素D还可能增加糖尿病大血管病变的发生风险,进而导致营养神经的血管动脉硬化[15],最终也促进DPN 的发生发展。
综上所述,维生素D缺乏与T2DM患者周围神经病变的发生关系密切,25(OH)D可作为DPN的预测因子,适量补充维生素D,可能有利于神经病变的及早防治,延缓其发生和发展。本研究属于回顾性研究,一些结论可能需要大样本调查及前瞻性研究来证实,维生素D保护周围神经病变的具体机制还有待进一步深入研究。
[1] 沈魏,郭忠良.AECOPD患者25-羟维生素D水平与IL-6、IgA的相关性研究[J].中华全科医学, 2015,13(10):1606-1607.
[2] 叶任高, 陆再英. 内科学[M]. 6版.北京: 人民卫生出版社, 2004:797.
[3] BOUHON A J,VINIK A I,AREZZO J C,et al.Diabetic neuropathies:a statement by the american diabetes association[J]. Diabetes Care,2005,28(4):956-962.
[4] 王国凤,徐宁,尹冬,等.糖尿病周围神经病变的诊断和治疗新进展[J].中国全科医学,2012,15(5):1661-1663.
[5] 刘燕, 戴伍. 维生素D与糖尿病肾病[J]. 安徽医学, 2015, 36(2):1552-1554.
[6] GUPTA T, RAWAT M, GUPTA N, et al. Study of effect of vitamin D supplementation on the clinical, hormonal and metabolic profile of the PCOS women[J]. J Obstet Gynaecol India, 2017, 67(5):349-355.
[7] BAJAJ S,SINGH R P,DWIVEDI N C,et al.Vitamin D levels and microvascular complications in type 2 diabetes[J].Indian J Endocrinol Metab,2014,18(4):537-541.
[8] BILIR B,FETI T,EKIZ B B,et al.The association of vitamin D with inflammatory cytokines in diabetic peripheral neuropathy[J].J Phys Ther Sci,2016,28(7):2159-2163.
[9] SHEHAB D,AL-JARALLAH K,ABDELLA N,et al.Prospective evaluation of the effect of short-term oral vitamin d supplementation on peripheral neuropathy in type 2 diabetes mellitus[J].Med Princ Pract,2015,24(3):250-256.
[10]ALAMDARI A,MOZAFARI R,TAFAKHORI A,et al.An inverse association between serum vitamin D levels with the presence and severity of impaired nerve conduction velocity and large fiber peripheral neuropathy in diabetic subjects[J].Neurol Sci,2015,36(7):1121-1126.
[11]CHABAS J F,STEPHAN D,MARQEESTE T,et a1.Cholecalciforol (vitamin D3) improves myelination and recovery after nerve injury[J].PLoS One,2013,8(5):e65034.
[12]张丽丽,卢艳慧,成晓玲,等.中老年人群血清25羟维生素D水平与血脂异常相关性分析[J].中华内科杂志,2016,55(8):599-603.
[13]MCCARTY M F.Secondary hyperparathyroidism promotes the acute phase response-a rationale for supplemental vitamin D in prevention of vascular events in the elderly[J].Med Hypotheses,2005,64(5):1022-1026.
[14]周浩锋, 张会娟. 2型糖尿病周围神经病变患者25-羟维生素D3的变化及意义[J].河南医学研究,2014,23(2):35-37.
[15]王怡, 刘逸群, 刘丽. 2型糖尿病患者血清25-羟维生素D3与下肢动脉病变的相关性研究[J].河北医药, 2017, 39(2):257-260.

