黄芩苷在Nb2O5-石墨烯纳米复合材料修饰电极上的电化学行为及测定
瞿万云, 吴 艳,2, 胡卫兵
(1.湖北民族学院化学与环境工程学院,湖北恩施 445000;2.湖北民族学院生物资源保护与利用湖北省重点实验室,湖北恩施 445000)
黄芩苷(Baicalin,Bai)是中药黄芩(RadixScutellariae)中主要的活性成分之一,它具有抗菌、消炎、镇静解热和抗癌等作用。研究表明,黄芩苷在低于细胞毒浓度时可抑制T细胞和艾滋病病毒,因此有望开发成为新的抗艾滋病药物。目前,许多含黄芩的中药复方制剂均采用黄芩苷作为质量控制的指标。因此,黄芩苷的测定在药物质量控制上十分重要。已报道测定黄芩苷的方法主要有高效液相色谱法[1]、毛细管电泳法[2]和电化学方法[3 - 6]等。其中,电化学分析方法以其仪器简单、检测快速、灵敏度高等优点受到广泛研究。
石墨烯凭借优良的电子传输能力、大的比表面积以及良好的生物相容性,已广泛应用于电分析化学领域[7 - 8]。石墨烯基复合材料借助不同材料的协同作用,具有更快的电子迁移率、更大的比表面积和更好的生物相容性。近年来,以石墨烯作为载体材料,合成石墨烯-金属纳米粒子和石墨烯-金属氧化物复合材料,用于电化学和生物传感领域的报道越来越多。例如,MnO2-石墨烯[9]、ZnO-石墨烯[10]、TiO2-石墨烯[11]、WO3-RGO[12]等。Nb2O5耐酸碱腐蚀性强,具有稳定优越的电化学性能[13],Nb2O5-石墨烯(Nb2O5-RGO)纳米复合材料用于黄芩苷的检测尚未见报道。
本文采用一步溶剂热法合成Nb2O5-RGO纳米复合材料,并用其作修饰剂制备Nb2O5-RGO修饰玻碳电极。详细研究了黄芩苷在该修饰电极上的电化学行为,发现Nb2O5-RGO修饰电极对黄芩苷具有良好的电催化活性。基于此,建立了黄芩颗粒制剂中黄芩苷的检测新方法,为提高含黄芩的中药复方制剂的质量控制提供一定的实验依据。
1 实验部分
1.1 仪器和试剂
CHI660E电化学工作站(上海辰华仪器公司),三电极系统:工作电极为玻碳电极(GCE,Φ=3 mm)或修饰电极,参比电极为饱和甘汞电极(SCE),对电极为铂丝电极;JSM-650LV型扫描电子显微镜(日本,电子株式会社)。
黄芩苷(中国药品生物制品检定所)标准溶液:准确称取一定量黄芩苷溶于N,N-二甲基甲酰胺(DMF),配制成1.0×10-2mol·L-1的储备液,置于冰箱中避光保存,使用时适当稀释;鳞片石墨(>99.98%,国药集团化学试剂有限公司);NbCl5(99.99%,Sigma-Aldrich公司);双十六烷基磷酸(DHP,Fluka公司)。其他试剂均为分析纯,所有试剂未经纯化直接使用。实验用水为二次蒸馏水。
黄芩颗粒(某制药有限公司)。
1.2 Nb2O5纳米棒、RGO和Nb2O5-RGO材料的制备
用鳞片石墨为原料,采用改进的Hummers方法[14]制备氧化石墨。称取100 mg氧化石墨于50 mL二次蒸馏水中,超声30 min后,离心分离即得氧化石墨烯(GO)分散液。
将25 mg NbCl5用少量无水乙醇溶解。把上述GO分散液和NbCl5乙醇溶液加入到100 mL聚四氟乙烯反应釜内衬中,反应釜置于不锈钢外壳中拧紧盖好,于235 ℃保温72 h,得到黑色的Nb2O5-RGO复合材料。同时,分别将单一的GO分散液和NbCl5乙醇溶液转入到100 mL聚四氟乙烯反应釜内衬中,于235 ℃保温72 h,得到黑色的RGO悬浮液[15]和Nb2O5纳米材料[13]。上述产物分别用水、乙醇和丙酮各离心洗涤三次,60 ℃真空干燥得到Nb2O5-RGO、RGO和Nb2O5粉末。
1.3 修饰电极的制备
将4 mg Nb2O5-RGO和2 mg DHP加至4 mL水中,超声分散40 min直至得到均一、黑色的悬浮液。GCE用粒径为0.05 μm的Al2O3抛光粉进行抛光,冲洗干净后分别在无水乙醇、水中各超声清洗2 min,红外灯下烘干。取10 μL上述Nb2O5-RGO分散液滴加至GCE表面,红外灯下挥发掉溶剂即得到Nb2O5-RGO/DHP/GCE。Nb2O5-DHP/GCE和RGO-DHP/GCE参照上述方法制备。
1.4 实验方法
修饰电极先在10 mL pH=2.1的B-R缓冲溶液中循环伏安扫描(扫描范围为0.0~1.0 V),直至循环伏安曲线稳定。然后,加入一定量的黄芩苷标准溶液,在搅拌条件下开路富集2 min,静止15 s,在0.1~0.9 V之间进行循环伏安(CV)、线性扫描伏安(LSV)和差分脉冲伏安(DPV)实验。
2 结果与讨论
2.1 Nb2O5和Nb2O5-RGO材料的表征
用扫描电子显微镜(SEM)对制备的Nb2O5和Nb2O5-RGO材料进行表征,见图1。从图1a中可以看出Nb2O5纳米棒的形貌;由图1b可以清晰看到在RGO里分散有Nb2O5纳米棒,且纳米棒长度为2.1 μm左右,直径为400 nm左右。

图1 Nb2O5(a)和Nb2O5-RGO(b)的扫描电镜(SEM)图Fig.1 SEM image of Nb2O5 (a) and Nb2O5-RGO(b)
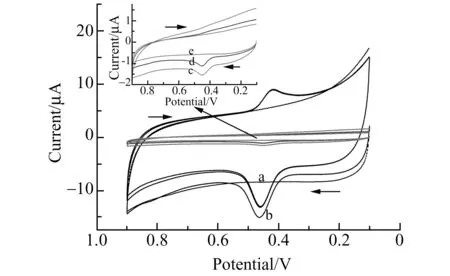
图2 黄芩苷在不同电极上的循环伏安图 Fig.2 Cyclic voltammograms of the different modified electrodes in 5.0×10-6 mol·L-1 baicalin solutiona:Nb2O5-RGO/DHP/GCE in pH=2.1 B-R buffer solution without baicalin;b:Nb2O5-RGO/DHP/GCE;c:bare GCE;d:Nb2O5-DHP/GCE;e:RGO-DHP/GCE.scan rate:0.1 V·s-1;t=120 s .
2.2 黄芩苷在Nb2O5-RGO-DHP/GCE上的电化学行为
黄芩苷在不同电极上的CV曲线见图2。在0.1 V到0.9 V的扫描范围内,黄芩苷在RGO-DHP/GCE(内插图曲线e)上没有观察到电化学响应信号;在裸GCE(内插图曲线c)和Nb2O5-DHP/GCE(内插图曲线d)上开路富集2 min后出现较小的氧化峰,说明这两种电极对黄芩苷的电化学氧化活性较低;在Nb2O5-RGO/DHP/GCE(曲线b)上出现了一对灵敏的氧化还原峰(曲线a是Nb2O5-RGO/DHP/GCE在空白B-R缓冲溶液中),峰电位差为45 mV,峰电流之比(Ipa/Ipc)为2.29,表明黄芩苷在Nb2O5-RGO/DHP/GCE上的反应为准可逆的电化学过程;而氧化峰电位比在裸GCE上正移了13 mV,氧化峰电流增大约18倍,说明Nb2O5-RGO复合材料能显著增强黄芩苷的电氧化活性。这可能是由于Nb2O5纳米棒分散在RGO里时阻止了氧化石墨烯在还原过程中的团聚和堆叠,使复合材料具有较大的比表面积,为黄芩苷的氧化提供了较多的反应位点;也有可能是复合材料中的RGO和Nb2O5产生了协同效应,有效促进了电子的传输速率,从而提高了黄芩苷的电氧化活性。另外,随着扫描次数的增加,氧化峰电流逐渐降低,最后趋于稳定;还原峰随扫描次数增加略有降低,说明黄芩苷及其氧化产物在修饰电极上均有吸附。因此,为了得到更好的灵敏度和重现性,选择第一圈的氧化峰作为研究对象。
2.3 影响黄芩苷电化学行为的因素
2.3.1测定介质及pH值的影响用CV法研究了黄芩苷在HClO4、NaAc-HAc缓冲溶液、磷酸盐缓冲溶液、B-R缓冲溶液和NaOH溶液(浓度均为0.1 mol·L-1)中的电化学行为。实验发现,黄芩苷在碱性溶液中无峰出现,在酸性溶液中有明显的氧化峰出现,且在B-R缓冲液中的峰形较好,峰电流较大。在B-R缓冲溶液中,用LSV法研究了pH值对黄芩苷氧化峰电流的影响。发现pH在1.98~2.21范围内,黄芩苷的氧化峰电流几乎不变;当pH值继续增加时,氧化峰电流逐渐减小。所以实验选择pH=2.1的B-R缓冲溶液为测定介质。另外,随着pH的增加,黄芩苷的氧化峰电位逐渐负移,这表明质子参与了黄芩苷的氧化过程。峰电位与pH值的关系为:EP(V)=0.5742-0.04871pH(R=0.9930),斜率48.71 mV/pH,说明参加氧化反应的电子数和质子数之比为1,这与文献报道[4 - 5]的结果相似。
2.3.2扫描速率的影响用CV法考察了扫描速率对黄芩苷峰电流的影响,见图3。黄芩苷在修饰电极上的氧化还原峰电流都随扫速的增加而增大,而且在0.025~0.25 V·s-1范围内,氧化峰电流(Ip)与扫速(v)呈良好的线性关系(图3插图),线性回归方程为:Ip(μA)=2.5593+57.3319v(V·s-1)(R=0.9947),表明黄芩苷在此修饰电极上的反应是受吸附控制的。当扫速为0.1 V·s-1时信噪比最好,所以本实验选择扫速0.1 V·s-1。
另外,黄芩苷的氧化还原峰电位也随扫速的改变而改变。随扫速的增加,黄芩苷的氧化峰电位正移而还原峰电位负移,说明黄芩苷的氧化还原可逆性随扫速的增大而变差。氧化峰电位与扫速的线性关系为:Ep(V)=0.5101+0.01561lnv(V·s-1)(R=0.9953)。对于受吸附控制的非可逆反应,氧化峰电位(Ep)与扫描速度(v)遵循以下关系式:Ep=E0+(RT/anaF)ln(RTk0/αnaF)+(RT/αnaF)lnv,Ep的斜率为RT/αnaF,其中na为转移电子数,α为电子转移系数,对于非可逆过程,α通常取0.5,由此求出na=1.7。故有两个电子参与电极反应,与文献报道[4 - 5]的结果一致。
2.3.3Nb2O5-RGO用量的影响Nb2O5-RGO的用量对黄芩苷的氧化峰电流有很大的影响。当Nb2O5-RGO分散液的量从0逐渐增加到10 μL时,黄芩苷的氧化峰电流显著增加;从10 μL增加到15 μL的过程中,黄芩苷的氧化峰电流没有明显变化;继续增加Nb2O5-RGO分散液的量,则峰电流反而降低。可能是因为此时电极表面的DHP太多,降低了电极表面膜的导电性能,从而阻碍了黄芩苷与电极之间的电子交换。因此实验选择Nb2O5-RGO分散液的用量为10 μL。
2.3.4富集时间和富集电位的影响分别试验了开路富集和闭路富集(富集电位-0.2~0.2 V范围)情况下富集时间对黄芩苷氧化峰电流的影响。结果发现,峰电流随富集时间的增加而增大,在相同富集时间条件下,开路富集的峰电流大于闭路富集的峰电流,故实验选择开路富集。在开路富集条件下,对不同浓度的黄芩苷溶液进行了搅拌富集时间试验。实验发现,浓度为5.0×10-7mol·L-1的溶液富集3 min后峰电流达到最大值,而浓度为2.0×10-6mol·L-1的溶液富集2 min后就达到最大峰电流。说明黄芩苷在Nb2O5-RGO/DHP/GCE电极表面发生了吸附,浓度较小的溶液达吸附平衡所需时间较长。
2.4 线性方程和检出限

图4 不同浓度黄芩苷的差分脉冲伏安曲线Fig.4 Differential pulse voltammograms of different concentrations of baicalin at Nb2O5-RGO/DHP/GCEcBai(a-j):0.05,0.1,0.5,0.7,1.0,2.5,5.0,7.5,10.0 mol·L-1.pH=2.1 B-R buffer solution;scan rate:40 mV·s-1.
在上述优化条件下,用DPV法(脉冲振幅50 mV,电位增量4 mV,脉冲宽度0.04 s)考察了黄芩苷的氧化峰电流与其浓度的关系,见图4。黄芩苷的氧化峰电流(IP)与其浓度(c)在5.0×10-8~1.0×10-6mol·L-1和1.5×10-6~1.0×10-5mol·L-1范围内有良好的线性关系,其线性回归方程分别为:Ip(μA)=0.05846+7.8268c(c,μmol·L-1)(R=0.9979);Ip(μA)=7.8237+2.5321c(c,μmol·L-1)(R=0.9978),开路条件下富集3 min后,黄芩苷的检出限(S/N=3)为1.5×10-8mol·L-1。
2.5 稳定性、重现性和选择性
在最佳条件下,对1.0×10-6mol·L-1黄芩苷溶液平行测定5次的相对标准偏差(RSD)为4.6%;用5支修饰电极分别测定1.0×10-6mol·L-1的黄芩苷溶液,其RSD为4.8%,说明修饰电极具有良好的重现性。将制备好的修饰电极在4 ℃冰箱中分别放置1、2、4 d后再进行测定,其氧化峰电流分别降低1.6%、3.5%、8.2%,说明该修饰电极有好的稳定性。
在此体系中研究了一些常见金属离子和有机物对黄芩苷测定的影响。1.0×10-3mol·L-1Zn2+、K+、Cu2+、Fe2+、Ca2+;1.0×10-5mol·L-1乳酸、尿酸、抗坏血酸、葡萄糖等几乎不干扰2.0×10-6mol·L-1黄芩苷的测定(误差<5%)。说明修饰电极有好的选择性。
2.6 样品分析及回收率的测定
取不同批号(批号:501640L、501630L、501644L)的黄芩颗粒制剂,分别研成细粉。称取约0.5 g,精密称定,用70%乙醇超声提取两次(每次20 mL,超声30 min),提取液过滤后置于100 mL容量瓶中,用70%乙醇稀释至刻度,摇匀。取一定体积的样品溶液加入到10 mL电解池中,在最佳条件下进行DPV测量。通过计算求得黄芩颗粒中黄芩苷含量分别为6.95%、7.12%和7.03%,平均值为7.03%。在该制剂中加入一定量的黄芩苷标准溶液,按上述方法提取,提取液在优化条件下连续测定4次,结果见表1。其回收率在93.0%~95.1%之间。

表1 黄芩苷的回收率测定结果(n=4)Table 1 Recovery results of baicalin in samples(n=4)
3 结论
本文用一步溶剂热法制备了Nb2O5-RGO纳米复合材料,制作了Nb2O5-RGO/DHP/GCE,用于黄芩苷的灵敏检测。与裸GCE相比,黄芩苷在Nb2O5-RGO/DHP/GCE上的氧化峰电流显著增强。Nb2O5-RGO/DHP/GCE有良好的稳定性和选择性,对黄芩苷的检测具有较宽的线性范围。可用于黄芩颗粒制剂中黄芩苷的测定。
参考文献:
[1] WANG Y,ZHONG S X.Journal of Analytical Science (王艳,钟韶霞.分析科学学报),2008,24(4):488.
[2] Li X J,Zhang Y P,Yuan Z B.Chromatographia,2002,55(7):453.
[3] Sun Z Y,Ma Z,Zhang W J,Wang X Y,Fan C H,Li G X.Analytical and Bioanalytical Chemistry,2004,379(2):283.
[4] ZHANG Y,QIAO G J,ZHANG H F,et al.Chinese Journal of Applied Chemistry(张亚,乔广军,张宏芳,等.应用化学),2008,25(8):890.
[5] JI Y L,WANG G F,FANG B.Chinese Journal of Analysis Laboratory(吉玉兰,王广凤,方宾.分析试验室),2010,29(6):11.
[6] Zhang H Y,Wang T Y,Qiu Y L.Journal of Electroanalytical Chemistry,2016,775:286.
[7] Kang X H,Wang J,Wu H,Aksay I A,Lin Y H.Talanta,2010,81(3):754.
[8] Wu Y,Huang M,Song N N,Hu W B.Anal Methods,2014,6:2729.
[9] Li L M,Du Z F,Liu S,Hao Q Y,Wang Y G,Li Q H,Wang T H.Talanta,2010,82:1637.
[10] Xu J,Liu C H,Wu Z F.Microchimica Acta,2011,172(3):425.
[11] Fan Y,Lu H T,Liu J H,Yang C P,Jing Q S,Zhang Y X,Yang X K,Huang K J.Colloids and Surfaces B:Biointerfaces,2011,83(1):78.
[12] Huang M,Wu Y,Hu W B.Ceramics International,2014,40:7219.
[13] HUANG M,HU W B.Journal of Huazhong Normal University (Nat Sci)(黄猛,胡卫兵.华中师范大学学报(自然科学版)),2013,47(4):501.
[14] Tang L H,Wang Y,Li Y M,Feng H B,Lu J,Li J H.Advanced Functional Materials,2009,19:2782.
[15] Nethravathi C,Rajamathi M.Carbon,2008,46(14):1994.

