心血管造影图像的分割与诊断
,,
(上海交通大学机械系统与振动国家重点实验室,上海 200240)
0 引言
随着人口老龄化程度的加剧,我国心血管疾病的患病率呈现出逐年增加的态势[1],心血管疾病的诊断和治疗具有显著意义。X线造影是诊断心血管疾病的常用方法。传统诊断过程是医生肉眼观察造影图像,根据其自身的经验进行诊断,用时较多,不仅不能快速对大量造影图像进行诊断,且诊断结果的准确性受个人经验因素影响较大,不能对病变进行量化描述。近年来,利用图像处理技术对造影图像进行辅助分析,可快速准确地分割出血管结构,识别出血管中的可疑病灶,能大大减轻医生的负担。
血管分割是造影图像处理的基础,也是血管三维重建、定量分析、手术导航等的理论依据。近年来,各种各样应用于血管分割的方法被提出[2]。潘立丰等[3]通过局部自适应阈值来提取视网膜血管,计算速度快,但其要求血管和背景在局部范围内均匀。仇恒志等[4]通过多尺度形态学重构来提取主要血管,由小尺度的匹配滤波增强中小血管,合并两部分得到最终血管分割,其对小血管的灵敏度不高。陈丽平[5]在梯度矢量流的血管增强图上使用水平集的原理分割血管,但基于水平集的分割对于复杂的图像容易收敛于局部能量极值,且计算量一般较大。在冠状动脉狭窄检测方面,陈相廷等[6]对10种狭窄检测的主流算法进行了实验和比较,说明了现阶段的检测算法的灵敏度和准确率整体均不高,与人工检测的性能仍有一定的差距。
为分割出有效的血管轮廓,在此,提出基于多尺度增强的新的血管函数和分段区域增长的血管分割方法。在基于Zhang-Sue算法提取的血管骨架上,对分割出的血管逐点计算血管直径,并分段自动检测血管是否阻塞病变。
1 血管分割
1.1 多尺度血管增强
血管在造影图像中呈线性的管状结构,常用基于Hessian矩阵的增强滤波器对血管进行增强。二维图像I的原始Hessian矩阵定义为:
(1)
Ixx,Ixy,Iyy,Iyx为图像的二阶倒数。图像的Hessian矩阵为实对称矩阵,其特征向量相互垂直,最大特征值及对应的特征向量表征三维曲面最大曲率的强度和方向,较小的特征值对应的特征向量表征垂直于最大曲率的方向。
由于噪声对图像的二阶微分影响很大,且血管的直径尺度大小不一,单纯用式(1)无法对各个尺度的血管均产生很大的影响。为此,在计算图像的二阶倒数之前,先用高斯函数与图像做卷积,既可去除噪声的干扰,又可以作为一个匹配滤波器来检测不同的血管尺寸大小。所以将式(1)修改为:
H(p,σ)=σ2·(∂2Gσ)⊗I
(2)
其中高斯函数为:
(3)
σ为空间尺度因子,通过改变σ,可使不同尺寸的血管得到增强,式(2)中的σ2项用于归一化各个尺度的响应。
在一般的X造影图像中,血管相对于背景呈低暗的管状结构,血管内的点的Hessian矩阵具有1个绝对值较小的特征值λ1(对应于沿血管轴向的特征向量)和1个较大的正特征值λ2(对应于垂直血管轴向的特征向量),且满足|λ2|≫|λ1|。本文对比了当前的一些血管函数[7-9],并提出了一种新的血管函数:
(4)
c为基于特定造影环境的经验阈值,取c=2。则基于多尺度增强的最终图像输出为:
(5)
σmin和σmax分别对应高斯函数的最小和最大尺度。由于高斯函数95%的权值都在[-2σ,2σ]之间,可取[σmin,σmax]=[dmin/4,dmax/4][5],dmin和dmax分别为造影图像中血管直径的最小值和最大值。为叙述方便,本文称式(5)输出的增强图为“血管特征图”。
本文的新血管函数和传统的Frangi血管函数[7]下的多尺度增强效果,如图1所示。显而易见,本文的新血管函数具有更好的增强效果,增强的图像清晰地显示了各个尺寸的血管轮廓,血管区域亮度较高,且周边干扰元素较少。
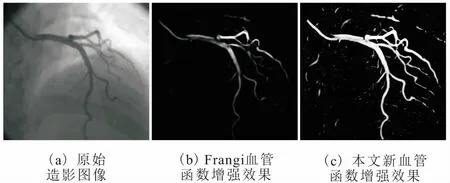
图1 不同血管函数对造影图像的增强效果对比
1.2 双阶段区域增长
在得到的血管特征图的基础上,提出了一种全自动化的双阶段区域增长的方法来提取血管轮廓。主要分为3个过程:初始种子点的自动选择;第一阶段区域增长提取主血管分支;第二阶段区域增长增强细小血管。首先,在初始种子点的自动选取上,文献[9]通过边角掩膜处理后选取最大强度点作为初始点,但不排除图像中间区域也有大强度的噪声干扰点,致使初始点选择错误。在此,用直径为dmax的圆盘匹配整个图像,当圆盘内所有点的强度之和最大时,此时的圆盘圆心作为区域增长的初始点,这样可有效避免噪声点的干扰。
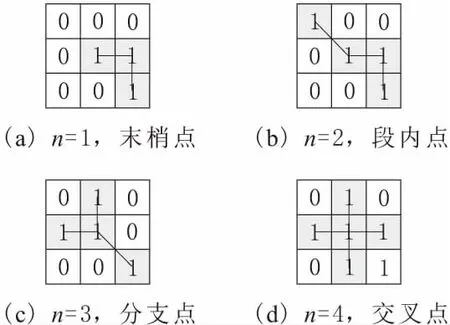
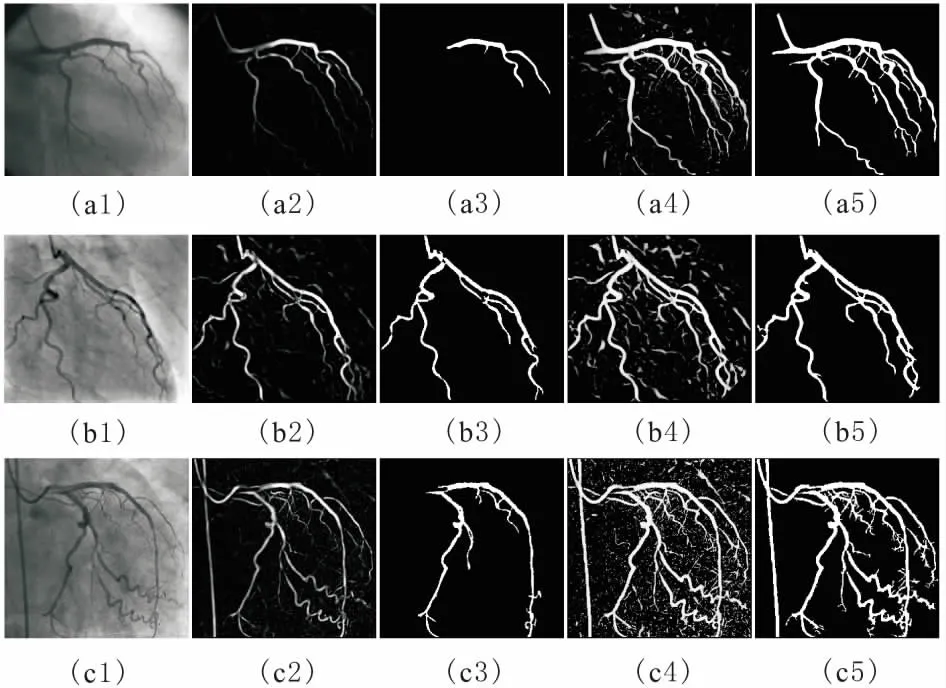
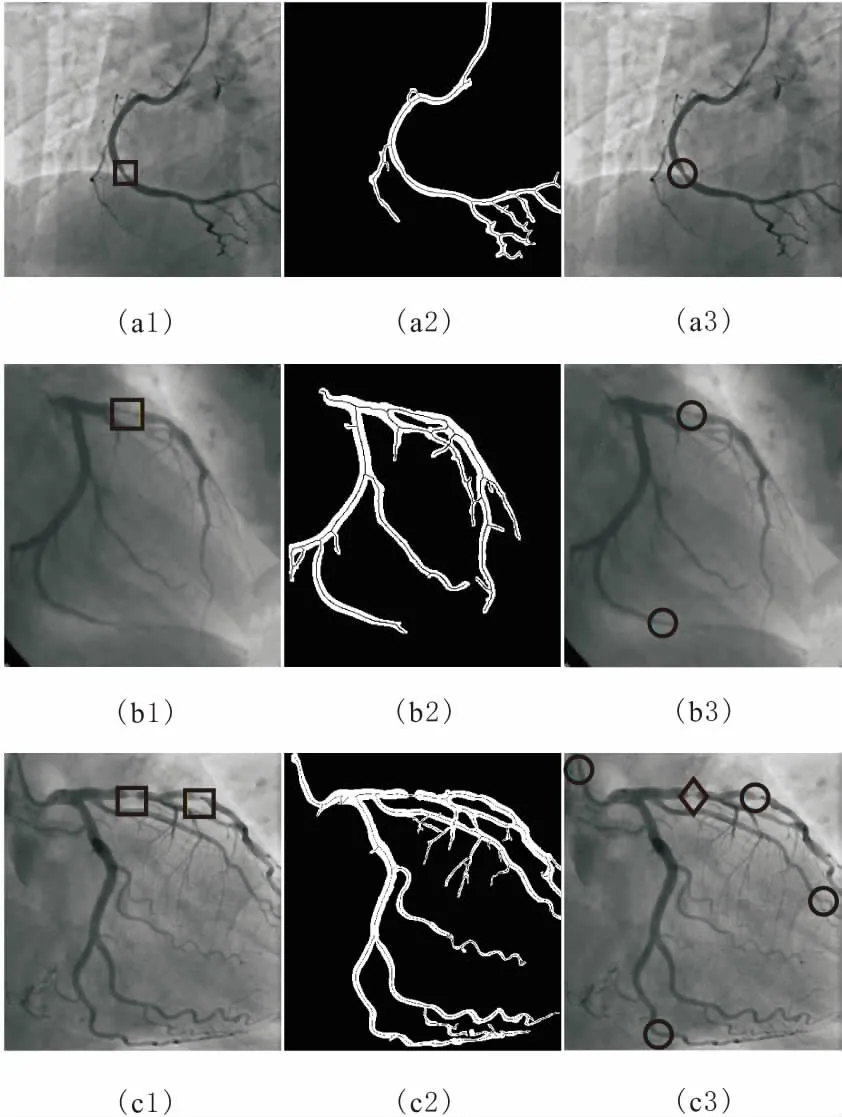
造影图像中血管的主分支轮廓边界一般比较明显,而微小血管的轮廓较模糊,与周围背景区别较小。传统的区域增长分割血管只有单一阈值,阈值的选取对血管分割的精准程度影响较大,阈值较小则不能提取出微小血管,阈值较大则可能使血管主分支加入周边点干扰点而变得比实际粗大。对此,采用分阶段阈值的区域增长。第一阶段选择1个较小的阈值k1,从选取的初始种子点开始搜索围边像素点,当周围像素点满足|f(p)-faverage| 第二阶段选择稍大的阈值k2,当周围像素点满足|f(p)-faverage| 图2 双阶段区域增长及骨架提取 图像的骨架提取常用的办法有最大圆盘法、火种传播法和剥皮法[10]。本文使用剥皮法中基于删除的Zhang-Suen算法[11]来提取血管骨架,该算法定义了像素点被删除的4个条件,对满足条件的点进行删除,最终得到二值图像的骨架。该算法执行效率较高且得到的骨架没有多余的枝杈,如图 2c所示。 为检测血管狭窄位置,需要搜索骨架上的所有点,并计算每个点处血管的直径。由Zhang-Suen算法提取的骨架点可由其八领域的直连点数目n分为4类:n=1,该点是血管的末梢点;n=2,该点是血管的段内点;n=3,该点是血管分支点;n=4,该点为血管交叉点。各类骨架点的示例如图3所示。一个骨架点八领域的直连点由以下条件取得:1)该点四领域为1的点是直连点;2)该点的对角点为1且对角点的四领域点无直连点,则该对角点为直连点。 图3 各类骨架点的示例 骨架上的血管末梢点、血管分支点、血管交叉点把整个血管网络分成不同的血管段。骨架点的整个搜索过程按递归的方式进行:首先,随机选取一个血管末梢点作为起始搜索点,把该点作为本段血管的当前搜索点,然后依次计算当前点的后续直连点,若后续直连点数为1,则加入该点到本段血管,把后续直连点作为当前点继续搜索;若后续直连点数≥2,当前血管段搜索完毕,针对每个后续直连点搜索新的血管段,直到骨架上所有点均搜索完毕。对于每一个骨架点,计算以该点为圆心,圆内所有点均在血管内的最大圆盘直径,并把其作为该点处的血管直径。 (6) 本文实验分为2部分:一是造影图像增强和血管分割;二是骨架提取及血管狭窄处全自动诊断。实验中的造影图像来自医学论坛网,实验采用MATLAB R2014b编程。 血管分割实验通过与采用Frangi算法的血管特征图上的单阈值区域增长得到的血管轮廓效果图进行对比,验证本论文的血管分割方法的有效性。3幅造影图像的实验效果对比,如图4所示。图4a1、图4b1和图4c1是3张原始造影图像;图4a2、图4b2和图4c2是Frangi血管函数增强的效果;图4a3、图4b3和图4c3分别是图4a2、图4b2和图4c2单阈值区域增长的结果;图4a4、图4b4和图4c4是本文血管函数增强的效果;图4a5、图4b5和图4c5分别是图4a4、图4b4和图4c4采用本文分阶段区域增长的结果。由图4可知,采用Frangi的血管函数得到的血管特征图在大血管区域具有较高的响应,而在细小血管和血管边缘处的响应较弱,以致在此基础上只能得到粗大血管的轮廓。而采用本文的新血管函数得到的血管特征图血管轮廓明显,粗大血管和细小血管均得到了很好的增强,血管区域亮度较高,且周围具有较少的干扰元素。采用本文提出的双阶段区域增长得到了良好的血管轮廓,造影图中相对清晰明显的粗大血管提取出了精准轮廓,较模糊的细小血管在第二次区域增长中得到了很好的增强和分割。实验结果证明了本文的血管分割方法大大优于采用Frangi算法和单阈值区域增长的血管分割方法。 图4 血管增强和分割效果对比 对多张医生诊断过的的含病变狭窄血管的造影图像,采用本文的全自动诊断方法圈出血管直径狭窄位置,并与医生标记出的血管狭窄位置进行对比分析,实验中的狭窄位置明显的3张代表图像,如图5所示。图5a1、图5b1和图5c1是3张原始造影图像,正方形方框是医生框出的血管狭窄位置;图5a2、图5b2和图5c2是采用本文方法提取的血管轮廓及骨架;图5a3、图5b3和图5c3是本文自动诊断圈出的血管狭窄位置,圆圈表示一般阻塞,菱形表示严重阻塞。 由图5a3可知,在血管轮廓清晰,细小分支较少的造影图像中,可以准确地识别出血管狭窄位置,没有多余的误诊断点。在具有许多细小血管分支的复杂造影图像中,除了医生标记的阻塞位置被找出,还圈出了另外一些疑似血管狭窄位置。 这里定义血管狭窄检测的2个评价指标:识出率和准确率。识出率指自动诊断出的且也为医生圈出的狭窄点数与医生圈出的总病灶点数的比值;准确率指自动诊断出的且也为医生圈出的狭窄点数与自动诊断圈出的总病灶点数的比值。本文对10张阻塞比较明显的造影图像做了实验,结果表明,总的病灶识出率可达80%,准确率约为50%。自动诊断的准确率较低,且错误识别多发生在血管段的末端、拐角处和分支处,其原因是在这些位置的干扰元素较多,且血管轮廓偏离管状,Hessian矩阵增强效果较差,致使测得的血管直径偏小。虽然自动诊断的识别准确率不高,但是对于真正病灶的识出率较高,可以把本文的自动诊断作为医生最终判断前的预诊断,通过预诊断找出所有疑似血管狭窄处,然后医生再根据预诊断结果,排除一些干扰点,便可以快速精准地找到血管真正狭窄位置,大大减少医生的工作量。并且预诊断可以量化血管直径,医生可以对感兴趣的血管段画出血管直径的变化曲线,便于对血管病变做进一步分析和诊断。 图5 血管狭窄处自动诊断结果 提出了一种基于Hessian矩阵多尺度增强的新血管函数,并在增强的血管特征图上采用了双阶段区域增长的分割方法提取了血管轮廓,在此基础上进行了血管骨架提取和直径测量,实现了全自动的血管狭窄预诊断。实验结果表明,在多尺度图像增强阶段,采用本文提出的新血管函数可以使血管轮廓更加明显,且具有较少的干扰。采用种子点自动探测和双阶段的区域增长方法,提取出的血管主分支轮廓精准,细小血管也得到了很好的增强和分割。对提取出的血管轮廓实现了快速的全自动预诊断,诊断结果较准确,可以为医生的最终判断提供辅助参考和量化依据。 参考文献: [1] 陈伟伟, 高润霖, 刘力生,等.《中国心血管病报告2016》概要[J].中国循环杂志, 2017, 32(6):521-530. [2] 游佳, 陈卉. 数字图像中血管的分割与特征提取[J].生物医学工程与临床,2011,15(1):91-95. [3] 潘立丰,王利生.一种视网膜血管自适应提取方法[J].中国图象图形学报,2006,11(3):310-316. [4] 仇恒志,钟鼎苏.一种视网膜血管的分割方法[J].南昌大学学报(医学版),2009,49(1):129-133. [5] 陈丽平.基于Hessian矩阵的血管图像增强与水平集分割算法研究[D].长沙:湖南大学, 2012. [6] 陈相廷,张帆,张一凡,等. CT造影冠状动脉狭窄检测与量化的相关研究[J]. 激光与光电子学进展, 2015, 52(8):47-54. [7] Frangi A F, Niessen W J, Vincken K L, et al. Multiscale vessel enhancement filtering[C]// International Conference on Medical Image Computing and Computer-Assisted Intervention. Springer-Verlag, 1998,1496:130-137. [8] Zhou S, Yang J,Wang Y, et al. Automatic segmentation of coronary angiograms based on fuzzy inferring and probabilistic tracking[J]. Biomedical Engineering Online, 2010, 9(1):1-21. [9] 梅川, 吴桂良, 杨媛,等. 一种基于区域增长和结构识别的心血管X线造影图像分割方法[J]. 生物医学工程学杂志, 2014(2):413-420. [10] 王晓静, 吴亚坤, 毛红艳,等. 迭代骨架化算法在汉字图像识别中的分析与应用[J]. 辽宁大学学报(自然科学版), 2013, 40(3):227-232. [11] Zhang T Y, Suen C Y. A fast parallel algorithm for thinning digital patterns[J]. Communications of the Acm, 1984,27(3):236-239.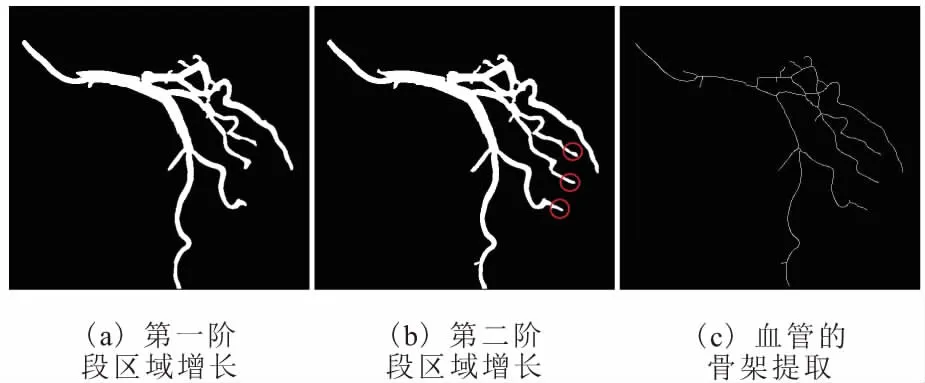
2 骨架提取与狭窄识别
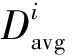
3 实验方法及分析
3.1 血管分割实验
3.2 血管狭窄自动诊断实验
4 结束语

